β-榄香烯对人胰腺癌Panc-1细胞凋亡的影响
王秉钧,王先坤,晏波,李绍平
兰州大学第二医院急救中心,甘肃 兰州,730030
β-榄香烯对人胰腺癌Panc-1细胞凋亡的影响
王秉钧,王先坤,晏波,李绍平
兰州大学第二医院急救中心,甘肃 兰州,730030
目的观察β-榄香烯对人胰腺癌Panc-1细胞凋亡的影响,探讨其作用机制。方法β-榄香烯浓度设置为10、20、40、80、160 μg/mL,作用于体外培养的Panc-1细胞24、48、72 h。台盼蓝拒染法检测Panc-1细胞抑制率;TUNEL法检测Panc-1细胞凋亡;Hoechst33258荧光染色观察Panc-1细胞核变化;ELISA检测Panc-1细胞Caspase-3、8、9活性;Western blot检测Panc-1细胞Fas、FasL、细胞色素C(Cyt c)、凋亡诱导因子(AIF)蛋白表达。结果与对照组比较,β-榄香烯作用Panc-1细胞24、48、72 h,Panc-1细胞抑制率明显增加(P<0.05,P<0.01),细胞凋亡率明显增加(P<0.01,P<0.001),并呈时间/浓度依赖性;β-榄香烯作用Panc-1细胞72 h,Panc-1细胞核可见明显碎裂,染色质浓缩,呈强蓝色荧光,形成凋亡小体;β-榄香烯作用Panc-1细胞48 h,Caspase-3、8、9活性明显增加(P<0.05,P<0.01),Fas、FasL、Cyt c及AIF蛋白表达明显增强(P<0.05,P<0.01,P<0.001)。结论β-榄香烯能够抑制 Panc-1细胞增殖、诱导细胞凋亡,其可能激活细胞内死亡受体途径及线粒体凋亡途径发挥抗肿瘤作用。
β-榄香烯;胰腺癌;Panc-1细胞;细胞凋亡
虽然胰腺癌发病率仅占所有癌症的 2.8%,但其侵袭性强、预后差、死亡率高[1]。榄香烯是从姜科植物温郁金中提取的有效成分。β-榄香烯注射液是由我国自行研发的抗肿瘤药物,其抗肿瘤作用主要机制包括诱导肿瘤细胞凋亡、阻滞细胞周期及放化疗增敏作用、逆转肿瘤细胞多药耐药、抗肿瘤转移、提高机体免疫力等[2]。由于β-榄香烯具有抗肿瘤谱广、作用高效、毒副作用小等特点[3],临床上已用于胶质瘤、乳腺癌、肝癌、卵巢癌、胃癌、大肠癌等恶性肿瘤的治疗。本实验以胰腺癌Panc-1细胞株为模型,观察 β-榄香烯对Panc-1细胞凋亡的影响,探讨其作用机制。
1 实验材料
1.1细胞
人胰腺癌Panc-1细胞株,中国科学院上海细胞库。
1.2药物
β-榄香烯注射液,大连远大制药有限公司,批号140623-2。
1.3试剂
10%胎牛血清,DMEM培养基(GIBCO公司);四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)及台盼蓝染色检测试剂盒,碧云天生物研究所;Caspase-活性检测试剂盒,Hoechst33258染色液,武汉博士德生物制品有限公司;抗Fas、FasL、细胞色素C(Cyt c)及凋亡诱导因子(AIF)鼠抗抗体,美国 Santa Cruz公司。
1.4仪器
IX51荧光显微镜(日本Olympus 公司),Spectra Mr型全波长酶标仪(美国DYNEX公司),Z-323高速低温离心机(德国HERMLE公司),EPICS XL流式细胞仪(美国COULTER公司)。
2 实验方法
2.1细胞培养
Panc-1细胞用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基于37 ℃、5%CO2孵育箱中孵育,常规方法培养细胞。以对数生长期细胞用于实验。
2.2台盼蓝拒染法检测Panc-1细胞抑制率
实验分为药物组和对照组。当细胞生长至对数期时,弃去旧培养液,37 ℃预热的PBS洗3次,0.25%胰酶消化,以新鲜培养液制细胞悬液,调整细胞密度5×104/孔,接种于96孔培养板,5%CO2、37 ℃细胞孵育箱中培养 24 h。弃去培养液,药物组给予含 β-榄香烯的新鲜培养液,药物终浓度为10、20、40、80、160 μg/mL。对照组予等体积新鲜培养液,每个浓度设置6个复孔。分别置孵育箱继续培养24、48、72 h。收集细胞,台盼蓝染色5 min,细胞计数板计数,计算细胞抑制率[(1-药物组OD值÷对照组OD值)× 100%]。β-榄香烯浓度设置参考文献[4]。所有实验均重复3次。
2.3TUNEL法检测细胞凋亡率
实验分组、细胞接种及给药方法同“2.2”项。取对数生长期Panc-1细胞接种于12孔板中,5%CO2、37 ℃孵育24 h,药物组β-榄香烯终浓度为10、20、 40、80、160 μg/m,继续培养24、48、72 h,弃去培养液,PBS冲洗3次,0.25%胰酶消化,得细胞悬液,1500 r/min离心5 min,收集细胞,4%多聚甲醛固定1 h,用含0.1%Triton X-100 PBS重悬细胞,冰浴孵育5 min。按照试剂盒说明书采用流式细胞仪进行检测。
2.4Hoechst33258荧光染色法观察细胞核的变化
实验分组、细胞接种及给药方法同“2.2”项。取对数生长期Panc-1细胞接种于6孔板中,5%CO2、37 ℃孵育24 h,药物组β-榄香烯终浓度为20、40、80 μg/mL的新鲜培养液,继续培养48 h。收集细胞,分散制成细胞悬液。按照Hoechst33258荧光染色说明书进行染色,荧光显微镜下观察细胞核的形态和荧光的强弱,采集图像。
2.5ELISA检测Caspase-3、8、9酶活性
实验分组、细胞接种及给药方法同“2.2”项。接种于6孔培养板的Panc-1细胞置于37 ℃、5%CO2条件下孵育24 h,药物组β-榄香烯的终浓度为20、40、80 μg/mL,继续培养48 h。弃去培养液,4 ℃预冷PBS冲洗3次,加入适量裂解液冰浴30 min。细胞刮子刮下细胞,置预冷离心管中,4 ℃、20 000 r/min离心15 min,取上清液存于-80 ℃冰箱保存备用。所测酶活性以Caspase活性增加的百分比表示(药物组OD值÷对照组OD值×100%)。严格按照试剂盒说明书进行操作。
2.6Western blot检测Fas、FasL、细胞色素C及凋亡诱导因子蛋白表达
实验分组、细胞接种及给药方法同“2.2”项。细胞加入预冷的适量细胞裂解液(100~150 μL/孔,含蛋白酶抑制剂),冰浴裂解30 min,收集细胞,4 ℃、20 000 r/min离心25 min,取上清液,BCA法测定总蛋白浓度,-80 ℃冰箱保存备用。10%SDS-PAGE凝胶电泳后,转移至PVDF膜,一抗Fas、FasL、Cyt c 及AIF抗体1∶1000稀释,4 ℃过夜,二抗(1∶1000稀释)室温孵育2 h,ECL法显色。
3 统计学方法
4 结果
4.1β-榄香烯对Panc-1细胞增殖的影响
不同浓度β-榄香烯作用Panc-1细胞24、48、72 h后,与对照组比较,药物组Panc-1细胞抑制率明显增加(P<0.05,P<0.01),并呈时间-浓度依赖性,两者间无交互作用(P>0.01)。结果见表1。
表1 各组Panc-1细胞不同时点Panc-1细胞抑制率比较(±s,%)
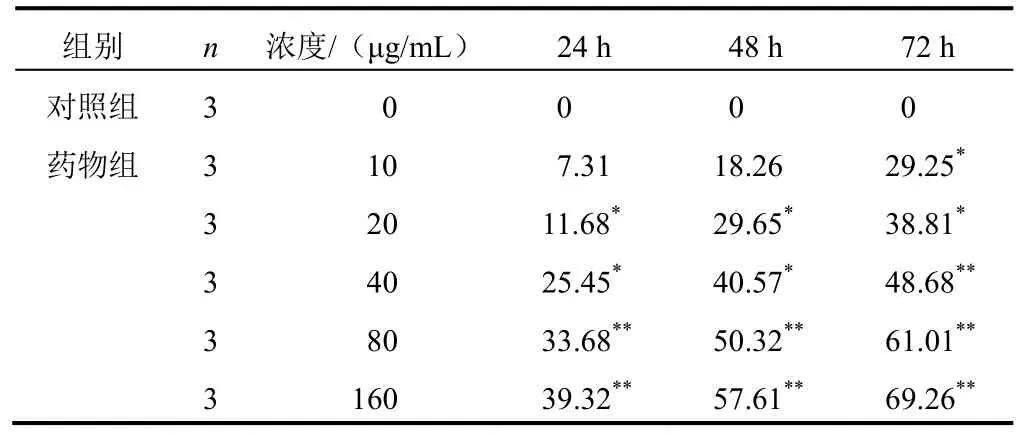
表1 各组Panc-1细胞不同时点Panc-1细胞抑制率比较(±s,%)
注:与对照组比较,*P<0.05,**P<0.01
组别 n 浓度/(μg/mL) 24 h 48 h 72 h对照组 3 0 0 0 0药物组 3 10 7.31 18.26 29.25*3 20 11.68* 29.65* 38.81*3 40 25.45* 40.57* 48.68**3 80 33.68** 50.32** 61.01**3 160 39.32** 57.61** 69.26**
4.2β-榄香烯对Panc-1细胞凋亡的影响
不同浓度β-榄香烯作用Panc-1细胞24、48、72 h后,与对照组比较,药物组细胞凋亡率增加(P<0.01,P<0.001),并呈时间-浓度依赖,80、160 μg/mL β-榄香烯诱导作用相同时间细胞凋亡率差异无统计学意义(P>0.05)。结果见表2。
表2 各组Panc-1细胞不同时点细胞凋亡率比较(±s,%)
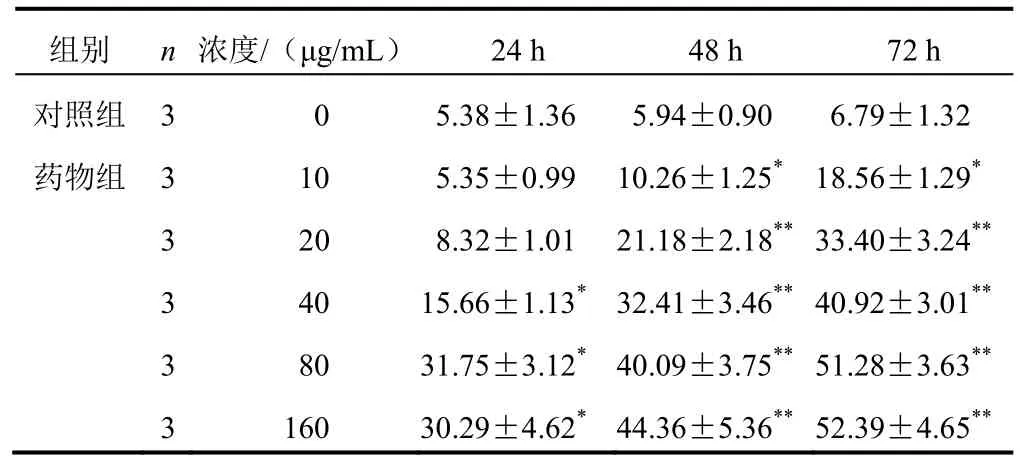
表2 各组Panc-1细胞不同时点细胞凋亡率比较(±s,%)
注:与对照组比较,*P<0.05,**P<0.01
组别 n 浓度/(μg/mL) 24 h 48 h 72 h对照组 3 0 5.38±1.36 5.94±0.90 6.79±1.32药物组 3 10 5.35±0.99 10.26±1.25*18.56±1.29*3 20 8.32±1.01 21.18±2.18**33.40±3.24**3 40 15.66±1.13* 32.41±3.46**40.92±3.01**3 80 31.75±3.12* 40.09±3.75**51.28±3.63**3 160 30.29±4.62* 44.36±5.36**52.39±4.65**
4.3β-榄香烯对Panc-1细胞核形态的影响
经Hoechst33258荧光染色后,荧光显微镜下可见对照组细胞核形态完整,呈弱蓝色荧光;给予榄香烯作用Panc-1细胞72 h后,细胞核可见明显碎裂,染色质浓缩并致密浓染,呈强蓝色荧光,伴有凋亡小体出现。随着药物浓度增大,细胞凋亡发生更加明显。结果见图1。
4.4β-榄香烯对Panc-1细胞Caspase-3、8、9活性的影响
Caspase-3、8、9均是细胞凋亡过程中关键的Caspase,20、40、80 μg/mL β-榄香烯作用Panc-1细胞48 h后,Caspase-3、8、9活性均显著增加(P<0.05,P<0.01)。结果见表3。
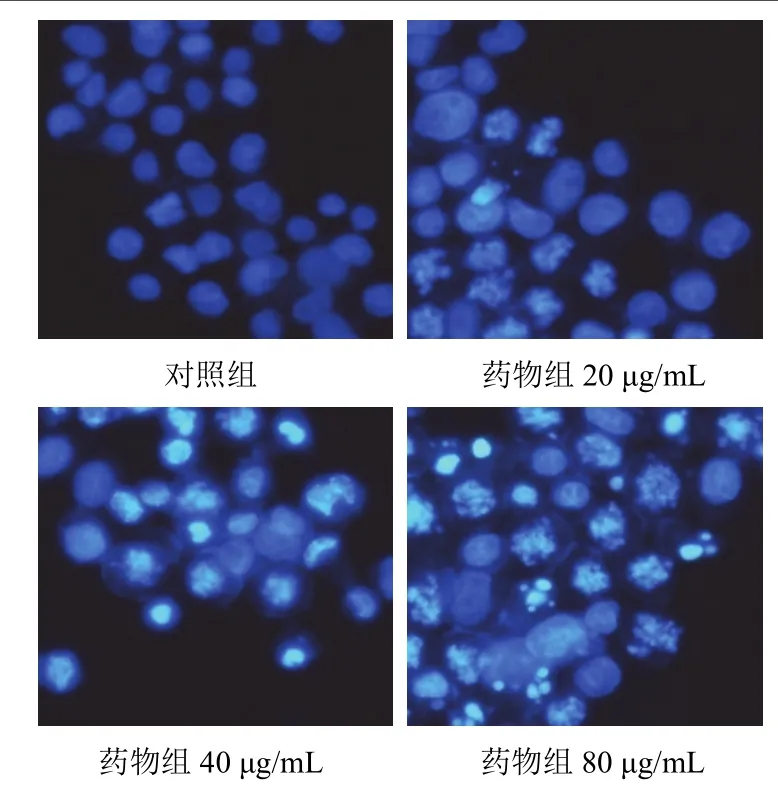
图1 各组Panc-1细胞核病理形态(Hoechst33258荧光染色,×200)
表3 各组Panc-1细胞Caspase-3、8、9活性比较(±s)
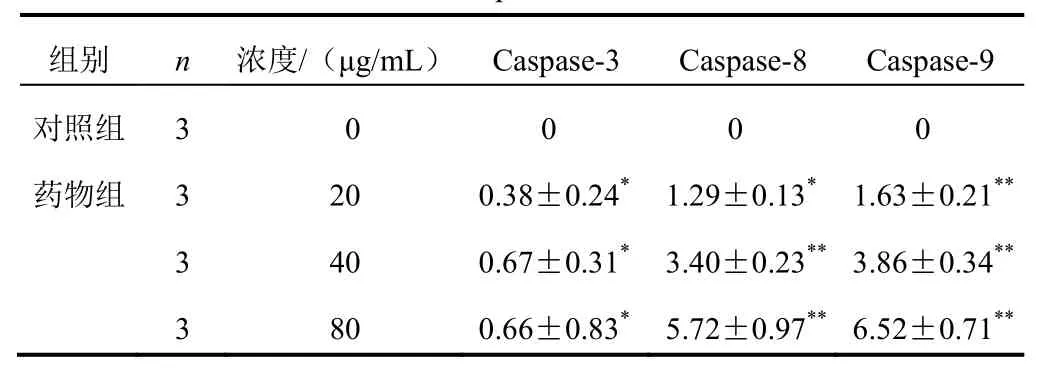
表3 各组Panc-1细胞Caspase-3、8、9活性比较(±s)
注:与对照组比较,*P<0.05,**P<0.01
4.5β-榄香烯对Panc-1细胞Fas、FasL、细胞色素C及凋亡诱导因子蛋白表达的影响
20、40、80 μg/mL β-榄香烯作用Panc-1细胞48 h后,与对照组比较,Panc-1细胞Fas、FasL、Cyt c及AIF蛋白表达明显增强(P<0.05,P<0.01,P<0.001)。结果见图2、表4。

图2 各组Fas、FasL、Cyt c及AIF蛋白表达免疫印迹电泳图
表4 各组Panc-1细胞Fas、FasL、Cyt c及AIF蛋白表达比较(±s)

表4 各组Panc-1细胞Fas、FasL、Cyt c及AIF蛋白表达比较(±s)
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001
对照组 3 0 0.98±0.11 0.67±0.11 1.13±0.25 0.95±0.08药物组 3 20 1.75±0.23* 1.64±0.65** 1.98±0.65** 1.29±0.41*3 40 3.44±0.45** 4.93±0.73** 2.45±0.74** 2.67±0.91**3 80 5.86±1.18*** 7.54±0.82*** 4.65±0.64** 4.36±0.70**组别 n 浓度/(μg/mL) Fas FasL Cyt c AIF
5 讨论
由于β-榄香烯广谱、高效、低毒等特点,目前临床上应用于多种恶性肿瘤的治疗。研究表明,β-榄香烯具有直接抗肿瘤作用,体内外均能够抑制肺癌细胞DNA、RNA的合成,从而抑制肿瘤细胞增殖,此作用具有一定的时间和浓度依赖性[5]。毛氏等[6]研究发现,β-榄香烯通过下调人肝癌 HepG2细胞内微管蛋白,从而抑制细胞内微管的聚合,发挥增殖抑制作用。本研究发现,不同浓度的β-榄香烯注射液作用Panc-1细胞24、48、72 h后,均有显著的增殖抑制作用。
除抗肿瘤作用外,诱导肿瘤细胞凋亡是β-榄香烯重要的抗肿瘤作用机制之一。有研究发现,β-榄香烯作用于胶质瘤U87细胞后,经流式细胞仪分析,可将细胞周期阻滞于G1/S期,此外Fas和FasL的mRNA和蛋白表达水平上升,表明 β-榄香烯通过调节Fas/FasL信号通路抑制胶质瘤细胞增殖并诱导凋亡。通过TUNEL法检测细胞凋亡实验发现,不同浓度β-榄香烯注射液作用24、48、72 h后能显著诱导Panc-1细胞凋亡;再通过Hoechst33258染色,荧光显微镜下观察到细胞核碎裂浓染,染色质浓缩,伴有凋亡小体出现。但是,笔者发现,80、160 μg/mL β-榄香烯注射液在作用相同时间时诱导的凋亡率之间无明显差异,可能是β-榄香烯诱导肿瘤细胞凋亡的作用与药物浓度并不是简单的线性关系。当药物达到一定浓度时,肿瘤细胞其他死亡方式如坏死增多,β-榄香烯诱导的程序性死亡即凋亡减少[2]。
有研究发现,榄香烯能促进人胃癌SCG-7901细胞凋亡,其机制与调节ERK/P38/MAPK信号通路表达有关[7];有研究显示,β-榄香烯可能通过调节Fas/FasL信号通路抑制胶质瘤细胞的增殖并诱导凋亡[8-9]。在哺乳动物细胞内存在2条经典的凋亡途径:死亡受体途径和线粒体凋亡途径。Fas是一种跨膜蛋白,属于肿瘤坏死因子受体超家族成员,在死亡受体途径中,Fas受体与Fas结合后,Fas受体胞浆区的死亡域发生多聚化使Fas活化,活化的Fas与Fas相关死亡结构域蛋白(FADD)连接,FADD另一端与无活性的Caspase-8酶原发生交联,从而激活Caspase-8,活化的Caspase-8可以剪切并活化Caspase-3、9及其他 Caspase,进而引起随后的级联反应,最终导致了细胞凋亡的发生。
Cyt c是第1种被发现的线粒体释放促凋亡蛋白。线粒体凋亡途径中,Cyt c从线粒体释放是细胞凋亡的关键步骤,这是线粒体外膜通透性增高的结果[10]。释放到细胞浆的Cyt c与凋亡相关因子1结合并将其激活,使其形成多聚体,并促使Caspase-9与其结合形成凋亡小体,Caspase-9被激活,其进一步激活下游的 Caspase-3,介导细胞凋亡。本研究发现,20、40、80 μg/mL β-榄香烯作用Panc-1细胞48 h后,Caspase-3、8、9活性均显著增加,Fas、FasL、Cyt c、AIF蛋白表达明显增强,这可能是 β-榄香烯诱导Panc-1细胞凋亡从而发挥抗肿瘤作用的机制之一。
[1] ONESTI C E, ROMITI A, ROBERTO M, et al. Recent advances for the treatment of pancreatic and biliary tract cancer after first-line treatment failure[J]. Expert Review of Anti-infective Therapy,2015,15(10):1183-1198.
[2] 吴稚冰,马胜林.β-榄香烯抗肿瘤作用的研究进展[J].中华中医药学刊,2011,29(10):2255-2258.
[3] ZHANG G N, ASHBY C R, ZHANG Y K, et al. The reversal of antineoplastic drug resistance in cancer cells by β-elemene[J]. Chinese Journal of Cancer,2015,34(3):1-8.
[4] 朱郁飞,陈恳,钱俐,等.榄香烯乳对人胰腺癌细胞株 Panc-1增殖和凋亡的影响[J].江苏医药,2013,39(21):2516-2519.
[5] 秦叔逵,钱军,杨爱珍,等.榄香烯乳抗肺癌细胞的实验研究[J].肿瘤防治研究,1996,23(4):251-255.
[6] 毛雨秋,高山,付海雁,等.β-榄香烯注射液对人肝癌 HepG2细胞微管系统的影响[J].中国实验方剂学杂志,2013,19(10):211-215.
[7] 俞耀军,盛维为,叶海波,等.榄香烯和 PD98059诱导人胃癌 SCG-7901细胞株凋亡及其机制的探讨[J].温州医科大学学报,2014,44(4):258-263.
[8] CHEN-LONG L, LIANG C, LIN G, et al. β-elemene induces caspase-dependent apoptosis in human glioma cells in vitro through the upregulation of Bax and Fas/FasL and downregulation of Bcl-2[J]. Asian Pacific Journal of Cancer Prevention,2014,15(23):10407-10412.
[9] 明键光,李晨龙,蒋传路.β-榄香烯通过Fas/FasL信号通路调控胶质瘤细胞增殖和凋亡[J].哈尔滨医科大学学报,2015,49(4):300-304.
[10] SINHA K, DAS J, PAL P B, et al. Oxidative stress:the mitochondria-dependent and mitochondria-independent pathways of apoptosis[J]. Archives of Toxicology,2013,87(7):1157-1180.
Effects of β-Elemene on Apoptosis of Human Pancreatic Cancer Panc-1 Cells
WANG Bing-jun,WANG Xian-kun, YAN Bo, LI Shao-ping
(Emergency Center, The Second Hospital of Lanzhou University, Lanzhou 730030, China)
Objective To investigate the effects of β-Elemene on the apoptosis of human pancreatic cancer Panc-1 cells; To discuss its mechanism of action. Methods β-Elemene (10, 20, 40, 80, 160 μg/mL) were incubated to the Panc-1 cells in vitro cultured for 24 h, 48 h and 72h, and trypan blue refusal method was used to detect cell inhibition rate;Apoptosis rate was measured by TUNEL; Hoechst33258 fluorescent staining was used to observe the changes of the nucleus. The activity of Caspase-3, 8 and 9 were detected by ELISA. Western blot was used to detect the expressions of Fas, FasL and Cyt c and AIF. Results The activity of Panc-1 cells was obviously inhibited time/concentration dependent inhibition (P<0.05, P<0.01), and the apoptosis rate increased after incubated with β-Elemene (P<0.01,P<0.001) after incubated with β-Elemene for 24 h, 48 h and 72 h; After giving β-Elemene 72 h, Panc-1 cells nucleus were broken obviously, and chromatin condensed and showed strong blue fluorescence, along with of apoptotic bodies; After incubated with β-Elemene for 48 h, Caspase-3, 8 and 9 activity significantly increased (P<0.05,P<0.01); protein expressions of Fas, FasL, Cyt c and AIF were significantly enhanced (P<0.05, P<0.01, P<0.001). Conclusion β-Elemene can inhibit Panc-1 cell proliferation, induce apoptosis, and the mechanism may be related to activating cell death receptor pathway and mitochondrial apoptosis pathway to play anti-tumor effects.
β-Elemene; pancreatic cancer; Panc-1 cells; cell apoptosis
R285.5
A
1005-5304(2016)10-0078-04
2015-12-07)
(
2015-12-30;编辑:华强)
甘肃省自然科学基金(1506RJZA251);兰州市科技计划项目(2012-1-32)
李绍平,E-mail:lzulsp@163.com
DOl:10.3969/j.issn.1005-5304.2016.10.018

