离子交换树脂对D-甘油酸的吸附热力学和动力学
王宝贝,蒲洋,林丽芹,李清彪,,卢英华
离子交换树脂对D-甘油酸的吸附热力学和动力学
王宝贝1,蒲洋2,林丽芹1,李清彪1,2,卢英华2
(1泉州师范学院海洋与食品学院,福建泉州 362000;2厦门大学化学与化工学院,福建厦门 361005)
D-甘油酸是一种重要的甘油衍生物,具有解酒护肝的功能。关于D-甘油酸生产方法的研究已有不少,但对其分离方法及分离机理的研究却鲜见报道。通过静态吸附实验,研究了D-甘油酸在201×7阴离子交换树脂上的等温热力学和动力学特性。结果表明,D-甘油酸在201×7阴离子交换树脂上的最大平衡吸附容量随pH的增加而降低,其吸附等温线符合Freundlich模型。在293~308 K下,吸附焓变为14.77 kJ·mol−1,表明该吸附过程为吸热过程。升高温度有利于提高吸附速率,但对最大平衡吸附容量影响不大。同时,采用动边界模型描述D-甘油酸在该树脂上的交换行为,分别考察了料液浓度、树脂粒径和温度对交换过程的影响。交换过程的吸附速率随D-甘油酸浓度和温度的增加而增大,但随树脂粒径的增大而减小。研究表明该离子交换过程的速率控制步骤为颗粒扩散过程,交换过程的反应速率常数0为1.22×10−3,反应级数为0.631,表观活化能a为14.90 kJ·mol−1,并得到了动力学总方程。
D-甘油酸;离子交换;吸附;动力学;热力学
引 言
甘油酸(glyceric acid,化学名2, 3-dihydroxypropionic acid)是一种重要的甘油衍生物。它在化工合成、精细化工、医药等行业中具有广泛的应用[1-2]。其右旋产品,D-甘油酸,具有解酒护肝的功效[3],是一种重要的医药原料。虽然化学合成的甘油酸产量较高,但产品中D型和L型各占50%,而其中只有D-甘油酸才具有生物学活性。当前,药用D-甘油酸主要采用生物发酵法生产[1, 4],再利用电渗析法进行分离[5]。虽然该法能有效从发酵液中分离得到纯度较高的D-甘油酸,但其生产效率有限,且使用过程中发酵液中的细胞常黏附于膜上,大大缩短了膜的使用寿命。此外,电渗析设备成本高、能耗大,不利于规模化生产使用[6]。相比之下,离子交换吸附分离方法设备投资少、工艺简单、污染小、能耗小,并且易于中试放大,因此工业生产中常用该法分离纯化各种羧酸[7-8]、弱酸[9-10]、金属离子等产品[11-12]。D-甘油酸具有弱酸性,在碱性条件下可以完全电离,电离出的甘油酸根离子可与阴离子交换树脂上的活性基团发生离子交换,因此具备了采用离子交换分离的条件。有研究成功采用阴离子交换树脂(IRA400和IRN78)从裂解液中分离出D-甘油酸和乳酸[13]。然而,当前对采用离子交换技术分离D-甘油酸的研究较少,对离子交换吸附D-甘油酸的动力学和热力学特性的研究鲜有报道。为此,研究了D-甘油酸在201×7阴离子交换树脂(与IRA400性质相近)上的吸附动力学和热力学,为今后采用离子交换法分离D-甘油酸的生产实践提供理论基础。
1 实验材料和方法
1.1 试剂
D-甘油酸标准品购自Sigma公司;201×7型阴离子树脂购自西陇化工股份有限公司;其他试剂均为分析纯试剂。
1.2 树脂预处理
树脂先用2 mol·L-1的NaOH和HCl溶液反复浸泡3次后,用2 mol·L-1的NaOH转成OH-型,最终用去离子水洗至中性,然后于60℃干燥2 h备用。
1.3 吸附等温线的测定
准确称取0.5000 g预处理树脂,分别在pH为8、9、10、11和12条件下,加入15 ml不同浓度的D-甘油酸溶液,于25℃下100 r·min-1振荡24 h,确保达到吸附平衡。检测上清液中D-甘油酸浓度e,按式(1)计算平衡吸附量e,作e-e图,得吸附等温线。
1.4 吸附动力学实验
本实验采用间歇法,即准确称取0.5000 g预处理的树脂于锥形瓶中,加入已知浓度的D-甘油酸溶液,于恒温恒速摇床中进行反应,定时测定溶液中的D-甘油酸浓度。分别在不同浓度、不同粒径和不同温度条件下测定溶液浓度随时间的变化关系,得到相关的动力学数据。第次取样时D-甘油酸的交换度为
式中,0为初始D-甘油酸浓度,g·L−1;C为第次取样时溶液中D-甘油酸浓度,g·L−1;为料液体积,L;m为树脂饱和吸附量,g·kg−1;为树脂质量,kg。
1.5 检测方法
D-甘油酸采用高效液相色谱(Agilent 1200)分析检测,以0.5 mmol·L-1H2SO4为流动相,流速为0.8 ml·min−1,分离柱为Shodex SH1011[4]。
2 实验结果与讨论
2.1 吸附等温线
2.1.1 不同pH下的吸附等温线 在离子交换分离过程中,料液溶质浓度越高,溶质与树脂接触的机会越多,就越容易进入树脂的网孔内进行离子交换。这可在一定程度上对树脂的交换容量和交换速度产生影响。但料液溶质浓度太高也可能引起树脂表面及内部交联网孔收缩,进而影响离子的进入,从而降低树脂的交换容量。谢友坪等[14]、程亮等[12]通过对色氨酸、镉离子的离子交换分离研究均发现料液溶质浓度是影响树脂吸附容量、吸附速率的一个重要因素。此外,Caetano等[9]、Xie等[15]在对苯酚、色氨酸的离子交换分离机理的研究中发现料液pH会通过改变溶质的解离平衡和溶质在树脂上的离子交换吸附平衡,影响吸附选择性及树脂交换容量。鉴于料液浓度和pH在离子交换过程中的重要作用,本研究分别考察了不同料液浓度和不同料液pH对D-甘油酸的离子交换吸附平衡的影响。由图1可见,在该树脂上,D-甘油酸的平衡吸附量随着料液浓度的增加而逐渐增大。这主要是由于提高料液中D-甘油酸的浓度,增加了吸附过程的推动力,从而促进了吸附过程。此外,随着料液pH的降低,树脂的最大平衡吸附量逐渐增加。当pH为8时,树脂的最大平衡吸附量达到最大。D-甘油酸属于弱酸,碱性条件有利于D-甘油酸的解离,进而促进离子交换吸附。然而,本实验所用树脂为OH-型,OH-是离子交换吸附过程的产物之一。因此,太高的料液pH反而会使离子交换吸附朝反方向进行,进而降低最大平衡吸附量。本研究分别采用Langmuir[式(3)]、Freundlich[式(4)],对以上静态吸附数据进行拟合
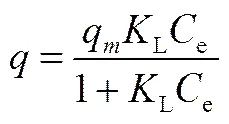
(4)
两方程的拟合结果如图1所示,回归结果及其相关系数见表1。由表可知,Freundlich方程回归曲线的相关系数2均比Langmuir方程高。在所考察的pH中,Freundlich模型对D-甘油酸的静态吸附都有很好的拟合效果(2>0.98)。不同pH条件下,Freundlich模型中的1/均介于0与1之间,表明树脂201×7对D-甘油酸具有良好的吸附效果。相反,Langmuir模型并不适用于所有pH条件:在弱碱条件下,D-甘油酸的静态吸附并不满足Langmuir模型(2<0.95),但是随着pH的升高,Langmuir模型的拟合度越来越高。在pH=12时,其拟合度达到2=0.99。
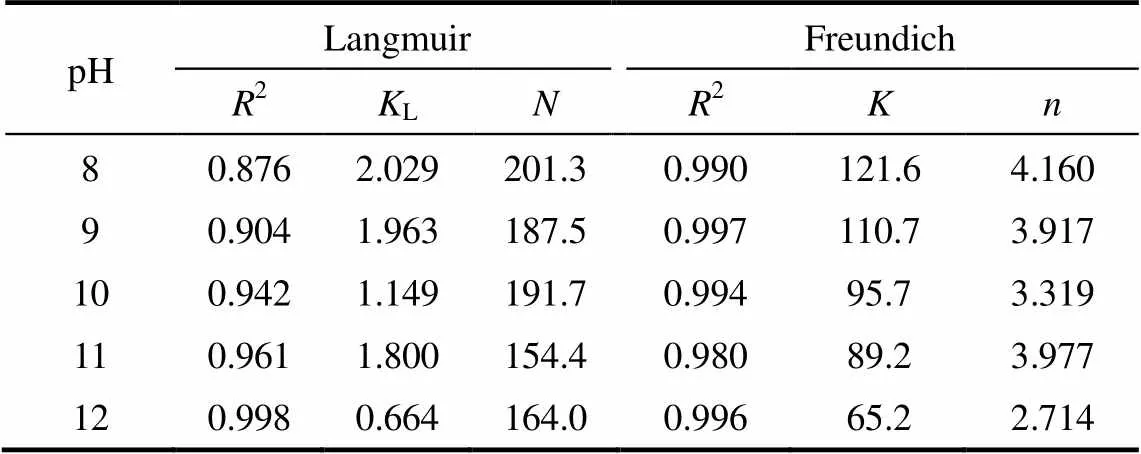
表1 Langmuir和Freundlich方程回归结果
2.1.2 不同温度下的静态吸附等温线 在293、298、303和308 K时,分别研究了树脂201×7对D-甘油酸的吸附等温线,并采用拟合效果较好的Freundlich模型拟合,结果如图2、表2所示。由图2可见,随着温度的升高,该树脂对D-甘油酸的吸附速率越快,但温度对最大平衡吸附量影响不大。由表2可知,Freundlich模型中的1/随温度升高而减小,这表明温度越高树脂对D-甘油酸的吸附效果越好。
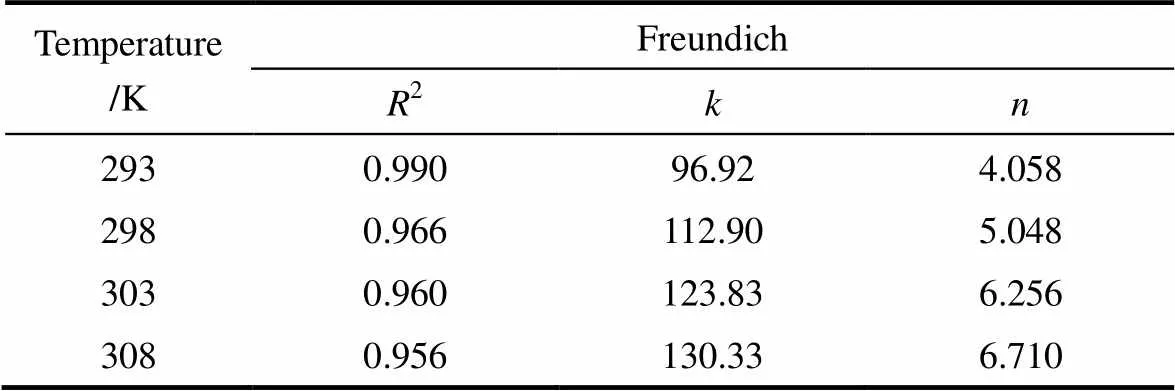
表2 Freundlich方程回归结果
2.2 静态吸附D-甘油酸的热力学参数
树脂201×7对D-甘油酸的吸附规律可以通过计算吸附自由能变(Δ)、吸附焓变(Δ)、吸附熵变(Δ)等热力学函数加以解释。根据Freundlich经验模型的吸附系数与温度、吸附焓存在如下关系[16]
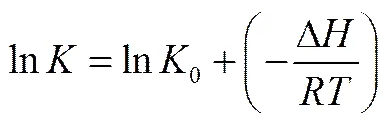
式中,为热力学温度,K;0为常数;为摩尔气体常数,=8.314 J·mol−1·K−1;Δ为吸附焓变,kJ·mol−1。
以ln对1/作图,进行线性拟合,通过斜率求得Δ。此外,吸附自由能变Δ可由式(6)得到[17]
Δ= −(6)
式中,为Freundlich常数;Δ为吸附自由能变,kJ·mol−1。
吸附熵变Δ(kJ·mol−1·K−1),可根据Gibbs-Helmhotz方程计算
Δ=(ΔΔ)/(7)
由式(5)~式(7)计算出热力学函数Δ、Δ、Δ,结果如表3所示。
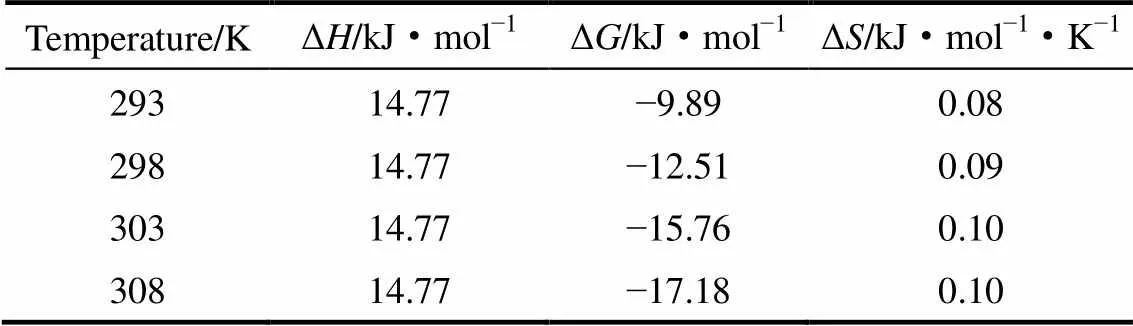
表3 树脂201×7吸附D-甘油酸的热力学函数值
由表3可以看出,D-甘油酸在树脂上的吸附焓变Δ>0,表明体系中D-甘油酸的吸附产生的放热效应小于溶剂水的解吸等带来的吸热效应。因此,D-甘油酸在该树脂上的吸附过程是吸热过程,适当提高温度有利于增大吸附速率。该分析结果与图2实验结果一致,即温度越高树脂对D-甘油酸的吸附效果越好。Δ>0表明树脂吸附D-甘油酸的过程是熵增的过程,这说明达到平衡时,该吸附体系的自由度升高。Δ<0表明被吸附到树脂上的D-甘油酸与溶液中的D-甘油酸相比,自由运动得到更大限制,且该吸附过程是自发进行的。
2.3 D-甘油酸与树脂作用的动力学研究
为了研究树脂201×7吸附D-甘油酸的动力学过程,并探知其速率控制步骤,采用动边界模型(shell progressive model, SPM)拟合D-甘油酸的动力学吸附数据。该模型将离子交换吸附分为3个步骤:①离子由溶液经液膜扩散到树脂表面(即液膜扩散过程);②离子由树脂表面向树脂内部扩散(即颗粒扩散过程);③离子在树脂内活性基团的位置发生交换反应(即化学反应过程)。因此,离子交换的动力学过程受到以上3个步骤的共同影响,其中速率最慢的一步为该离子交换过程的速率控制步骤。当液膜扩散、颗粒扩散和化学反应分别为速率控制步骤时,其模型方程分别为[18]:
膜扩散
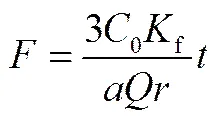
颗粒扩散
(9)
化学反应
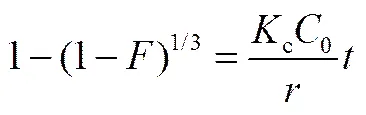
分别以、3−3(1−)2/3−2和1−(1−)1/3与进行线性拟合。拟合结果如图3所示,上述各方程的线性相关系数R分别为0.926、0.985、0.946,即3−3(1−)2/3−2与的拟合线性关系最好,故在树脂201×7吸附D-甘油酸的过程中,颗粒扩散为速率控制步骤。
图3 吸附过程速率控制步骤的拟合
Fig.3 Estimation of controlling step of adsorption process
2.3.1 料液浓度对交换过程的影响 料液浓度对离子交换吸附过程有很大的影响,该树脂对D-甘油酸的平衡吸附量随着料液浓度的升高而逐渐增加(图1)。本研究考察了3种D-甘油酸浓度对离子交换过程的影响,通过动边界模型颗粒扩散控制方程式(9)拟合数据,结果如图4所示,线性回归结果见表4。从表4可见不同料液浓度下,各直线斜率,即表观速率常数(×10−4)分别为:6.128、4.475、2.883。

表4 不同料液浓度的颗粒扩散方程
由于表观速率常数与浓度幂函数呈正比,即
ln=ln0(11)
其中是D-甘油酸浓度的反应级数,对ln和ln0进行线性拟合,可得ln= −9.2820.631ln0(2=0.99998),反应级数为0.631。
2.3.2 树脂粒径对交换过程的影响 D-甘油酸在树脂中的扩散速率受到树脂粒径的直接影响,而上述研究表面颗粒扩散是该离子交换过程的速率控制步骤,因此树脂粒径对离子交换速率的影响至关重要。本研究考察了两种不同粒径的树脂对D-甘油酸吸附过程的影响。所得动力学数据用颗粒扩散控制方程式(3)进行拟合,结果如图5所示,线性回归结果见表5。

表5 不同粒径的颗粒扩散方程
由表可知,粒径较小的树脂对D-甘油酸的吸附速率更快。这是由于粒径较小的树脂,溶液中D-甘油酸根离子通过树脂表面进入内部未反应区的路径也较短,从而加快了树脂对D-甘油酸的吸附速率。同时,通过方程式(6)可以发现,表观速率常数和树脂粒径平方的倒数呈正比。为验证该关系,将图6中的数据用式(12)[14]处理
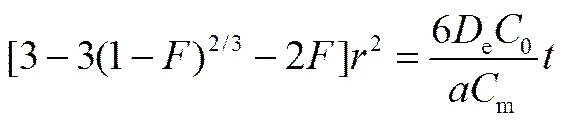
结果如图6所示。当树脂直径分别为0.4、0.5 mm时,拟合直线的2为0.9920。这说明与1/2呈较好的正比关系,进一步表明D-甘油酸的吸附过程受颗粒内扩散控制。
图6 不同树脂粒径下[3−3(1−)2/3−2]2与的关系
Fig.6 Relation of [3−3(1−)2/3−2]2andat different particle diameters
2.3.3 温度对交换过程的影响 考察4种温度下树脂对D-甘油酸的动态吸附过程,通过颗粒内扩散模型对数据进行拟合,3−3(1−)2/3−2与呈线性关系,如图7所示,所得线性回归见表6。由表6可知,温度升高,扩散速率加快,有利于吸附过程的进行。从表中各直线斜率可得到不同温度下D-甘油酸交换过程的表观速率常数,将其代入Arrhenius方程
ln= −a/+(13)
以ln对1/作图,拟合得到方程:ln= −1792.6/−1.407(R=0.9706)。由此,可得D-甘油酸吸附过程的表观活化能a为14.90 kJ·mol−1。

表6 不同温度的颗粒扩散方程
2.3.4 离子交换过程的动力学方程 通过研究D-甘油酸浓度、反应温度以及树脂粒径对离子交换过程的影响,以及通过颗粒扩散方程得到一系列的表观速率常数,可表示为D-甘油酸浓度、温度以及树脂粒径的函数关系[19]
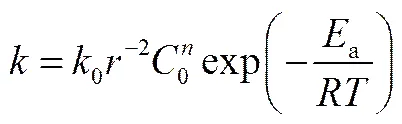
求得D-甘油酸吸附过程的速率常数0为1.22×10−3,因此该吸附过程的动力学总方程式为
(15)
3 结 论
(1)D-甘油酸在201×7型阴离子交换树脂上的吸附等温线符合Freundlich等温方程,而Langmuir等温方程只有在pH为12时拟合效果才较好。
(2)离子交换树脂201×7吸附D-甘油酸的热力学研究表明:静态平衡吸附等温线较好地符合Freundlich模型,其中Δ>0,Δ<0,Δ>0,表明树脂对D-甘油酸的吸附是一个吸热的过程,且是自发进行的,吸附过程是熵增加的过程,升温有利于提高吸附速率。
(3)动力学研究表明,离子交换过程的速率控制步骤为颗粒扩散,其表观活化能为14.90 kJ·mol−1,D-甘油酸浓度的反应级数为0.631,表观速率常数和树脂粒径平方呈反比,并推导出该离子交换过程的动力学总方程为。
符 号 说 明

a——反应级数 Ce——吸附平衡后溶液中D-甘油酸的浓度,g·L−1 Ci——第i次取样时,溶液中D-甘油酸的浓度,g·L−1 C0——料液中初始D-甘油酸的浓度,g·L−1 D——颗粒有效扩散系数,m2·s−1 Ea——表观活化能,kJ·mol−1 F——交换度 ΔG——吸附自由能变,kJ·mol−1 ΔH——吸附焓变,kJ·mol−1 K——Freundlich吸附平衡常数 KL——Langmuir常数,L·g−1 k——表观速率常数 m——树脂质量,g n——Freundlich方程的特征常数 qe——树脂平衡吸附量,g·g−1 qm——树脂饱和吸附量,g·g−1 R——气体常数,J·mol−1·K−1 r——树脂颗粒半径,m ΔS——吸附熵变,kJ·mol−1·K−1 T——热力学温度,K V——料液体积,L
References
[1] HABE H, FUKUOKA T, KITAMOTO D,. Biotechnological production of D-glyceric acid and its application [J]. Applied Microbiology and Biotechnology, 2009, 84(3): 445-452.
[2] FUKUOKA T, IKEDA S, HABE H,. Synthesis and interfacial properties of monoacyl glyceric acids as a new class of green surfactants [J]. Journal of Oleo Science, 2012, 61(16): 343-348.
[3] HABE H, SATO H, FUKUOKA T,. Effect of glyceric acid calcium salt on the viability of ethanol-dosed gastric cells [J]. Journal of Oleo Science, 2011, 60(11): 585-590.
[4] HABE H, FUKUOKA T, KITAMOTO D,. Biotransformation of glycerol to D-glyceric acid by acetobacter tropicalis [J]. Applied Microbiology and Biotechnology, 2009, 81(6): 1033-1039.
[5] HABE H, FUKUOKA T, KITAMOTO, D,. Application of electrodialysis to glycerate recovery from a glycerol containing model solution and culture broth [J]. Journal of Bioscience and Bioengineering, 2009, 107(4): 425-428.
[6] MOLDES A B, ALONSO J L, PARAJO J C. Recovery of lactic acid from simultaneous saccharification and fermentation media using anion exchange resins [J]. Bioprocess Biosystems Engineering, 2003, 25(6): 357-363.
[7] LOPEZ-GARZON C S, STRAATHOF A J. Recovery of carboxylic acids produced by fermentation [J]. Biotechnology Advances, 2014, 32(5): 873-904.
[8] ATAEI S A, VASHEGHANI-FARAHANI E.separation of lactic acid from fermentation broth using ion exchange resins [J]. Journal of Industrial Microbiology and Biotechnology, 2008, 35(11): 1229-1233.
[9] CAETANO M, VALDERRAMA C, FARRAN A,. Phenol removal from aqueous solution by adsorption and ion exchange mechanisms onto polymeric resins [J]. Journal of Colloid and Interface Science, 2009, 338(2): 402-409.
[10] CHEN K, LYU H, HAO S,. Separation of phenolic compounds with modified adsorption resin from aqueous phase products of hydrothermal liquefaction of rice straw [J]. Bioresource Technology, 2015, 182(1): 160-168.
[11] 张金丽, 孙道华, 景孝廉, 等. Au(Ⅲ)离子在黑曲霉菌上的吸附热力学和动力学特性[J]. 化工学报, 2013, 64(4): 1283-1292. ZHANG J L, SUN D H, JING X L,. Thermodynamic and kinetic characteristic of Au(Ⅲ) biosorption onto[J]. CIESC Journal, 2013, 64(4): 1283-1292.
[12] 程亮, 侯翠红, 徐丽, 等. 纳米腐殖酸动态吸附废水中镉离子及其洗脱特性[J]. 化工学报, 2016, 67(4): 1348-1356. CHEN L, HOU C H, XU L,. Dynamic adsorption and de-sorption characteristics of wastewater containing cadmium ion on nanoscale humic acid [J]. CIESC Journal, 2016, 67(4): 1348-1356.
[13] JACKSON J E, MILLER D J, MARINCEAN S. Process for the preparation of lactic acid and glyceric acid: US 7459584 (B) [P]. 2008-12-02.
[14] 谢友坪, 敬科举, 姚传义, 等. 离子交换树脂吸附L-色氨酸的动力学研究[J]. 高校化工学报, 2012, 26(4): 710-715.XIE Y P, JING K J, YAO C Y,. Study on the kinetics of L-tryptophan adsorption by ion exchange resin [J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(4): 710-715.
[15] XIE Y P, JING K J, LU Y H. Kinetics, equilibrium and thermodynamic studies of L-tryptophan adsorption using a cation exchange resin [J] Chemical Engineering Journal, 2011, 171(3): 1227-1233.
[16] 程亮, 侯翠红, 刘国际, 等. 纳米腐殖酸对镉离子的吸附热力学及动力学 [J]. 高校化学工程学报, 2015, 29(1): 72-77. CHENG L, HOU C H, LIU G J,. Thermodynamics and kinetics of cadmium ions adsorption by nanoscale humic acid [J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(1): 72-77.
[17] MARK S, PINHUA R, IRENE L. Effects of hardness and alkalinity on the removal of arsenic (Ⅴ) from humic acid-deficient and humic acid-rich groundwater by zero-valent iron [J]. Water Research, 2009, 43(17): 4296-4304.
[18] 杨莉丽, 康海彦, 李娜, 等. 离子交换树脂吸附镉的动力学研究[J]. 离子交换与吸附, 2004, 20(2): 138-143. YANG L L, KANG H Y, LI N,. Study on the kinetics of adsorption of cadmium by ion-exchange resin [J]. Ion Exchange and Adsorption, 2004, 20(2): 138-143.
[19] 王永利, 马晓建, 常春. 离子交换树脂吸附乙酰丙酸的动力学研究[J]. 离子交换与吸附, 2007, 23(4): 330-336. WANG Y L, MA X J, CHANG C. Study on the kinetics of adsorption of levulinic acid by ion-exchange resin [J]. Ion Exchange and Adsorption, 2007, 23(4): 330-336.
Thermodynamics and kinetics of D-glyceric acid adsorption on ion exchange resin
WANG Baobei1, PU Yang2, LIN Liqin1, LI Qingbiao1, 2, LU Yinghua2
(1College of Oceanography and Food Science, Quanzhou Normal University, Quanzhou 362000, Fujian, China;2Department of Chemical and Biochemical Engineering, College of Chemistry and Chemical Engineering, Xiamen University, Xiamen 361005, Fujian, China)
D-glyceric acid, one of the promising glycerol derivatives, has various biological functions such as accelerating ethanol and acetaldehyde oxidation. Plenty studies on the synthesis but few studies on downstream processes to recover D-glyceric acid were available. A static equilibrium adsorption was performed to study isothermal thermodynamics and kinetics of D-glyceric acid adsorption onto 201×7 strong basic anion exchange resin. The results showed that the adsorption process followed the Freundlich isothermal model at different pH and temperature conditions, which the maximum adsorption capacity decreased with increasing initial pH. The change of adsorption enthalpy was 14.77 kJ·mol−1at 293—308 K, suggesting an endo-thermic adsorption process. Raising temperature improved adsorption rate with limited influence on equilibrium adsorption capacity. The Dynamic Boundary Model was used to investigate adsorption kinetics with a focus on effects of D-glyceric acid concentration, resin particle diameter and adsorption temperature. The results suggested the particle diffusion was rate-limiting step of the adsorption process. The adsorption rate increased with the increase of D-glyceric acid concentration and temperature, but decreased with the increase of resin particle diameter. The general kinetics equation was obtained with the rate constant of exchange (0), reaction order () and the apparent activation energy of reaction (a) as following0=1.22×10−3,=0.631,a=14.90 kJ·mol−1.
D-glyceric acid; ion exchange; adsorption; kinetics; thermodynamics
2016-05-18.
Prof. LU Yinghua, ylu@xmu.edu.cn
10.11949/j.issn.0438-1157.20160685
TQ 028.3
A
0438—1157(2016)11—4671—07
王宝贝(1982—),女,博士,讲师。
福建省高校产学合作项目(2015N5006);福建省教育厅中青年教师教育科研项目(JA15393);泉州师范学院青年博士预研基金项目(2015QBKJ04)。
2016-05-18收到初稿,2016-07-12收到修改稿。
联系人:卢英华。
supported by the Industry-University Cooperation Project of Fujian Province (2015N5006), the Young PhD Pre-research Fund of Quanzhou Normal University (2015QBKJ04), and the Education Research Fund for Young and Middle-aged Teachers in Fujian Province (JA15393).

