测量生物组织等效杨氏模量的毫米压痕仪
杨红穗,高琦,刘逍逸,周红生
测量生物组织等效杨氏模量的毫米压痕仪
杨红穗1,高琦2,刘逍逸1,周红生1
(1. 中国科学院声学研究所东海研究站,上海200032;2. 长春理工大学机电工程学院,吉林长春130022)
生物组织的弹性是诊断其是否发生病变的重要依据,杨氏模量是反映组织弹性的重要参数。以Labview为软件平台结合数据采集和运动控制等硬件设备,研制了一套测量弹性模量的毫米压痕弹性仪。以市购冷鲜牛肉、猪肉、猪肝和猪肾为试样,测量了球形压头向试样施加的负载力和对应的试样压痕深度,在对测量数据进行校准的基础上,利用基于赫兹接触力学模型的压头半径、作用力、压痕深度与试样等效杨氏模量E间的解析关系,得到各试样的等效杨氏模量。实验结果表明,测得的组织试样等效杨氏模量数值与文献基本相符,所设计的毫米级压痕法测试装置可用于生物组织等效杨氏模量的检测。
生物组织;等效杨氏模量;压痕法;毫米压痕弹性仪
0 引言
生物软组织包括皮肤、血管、肌肉、肌腱、韧带及各种器官(如肝、肾等),是非线性黏弹性的、各向异性的非均质材料[1],病变通常会导致其弹性的变化,如癌症通常表现为组织硬块,囊肿呈现为柔软的结构,而类似肝硬化、纤维化肝之类的疾病也会使肝的弹性系数发生明显的变化[2-3]。测量生物组织的弹性,可以辅助疾病情况的准确诊断及确定针对性的治疗方案,并可对治疗方案的效果进行评估[4]。杨氏模量反映物体本身的弹性性质,是生物组织的重要本征弹性参数,对它的定量检测,是国内外研究人员关注的生物力学研究方向之一[5-15],利用生物组织的弹性而发展形成的各种弹性成像技术,如磁共振弹性成像、超声成像、声幅射力冲击成像等[16-25],已成为临床诊断的重要手段。
对组织杨氏模量的测量,可以离体或活体方式进行。由于活体测量受到样本、医学伦理等方面的限制,因此,目前多以离体方式进行组织的杨氏模量的测量。具体的测量方法有基于传统力学测试的方法如静态拉伸法[6,11]或压缩法[4-8]、压痕法[11-15]及基于超声技术的方法[5-6, 8-10]等。尽管压痕法测试类似于压缩测试,但是对测试边界条件的要求降低了,其作用也接近于过去一直用来进行组织病情判断的手指触诊,因此,利用压痕法测试离体组织杨氏模量的研究,具有较高的实用意义,特别是在扫描探针显微技术基础上发展而来的纳米压痕技术已成功地实现了细胞和软组织微区等效杨氏模量检测[11-13],进一步证实了压痕法具有定量和操作简便的特点,对利用压痕技术测量生物软组织弹性的研究有极大的促进作用。
结合正在开展研究的微创超声手术刀系统,本文利用原子力显微镜技术中的力曲线测量方法和原理,设计和建立了一套毫米级压痕法测量装置(毫米压痕弹性仪),以离体猪肝、猪肾和猪肉块体为样本,实测半径为的球形压头向试样加载正压力时试样上产生的压痕深度,并对测得数据进行了校准,用校准后的数据作出力-位移(-)曲线,从而推导出被测生物软组织试样的等效杨氏模量*。
1 理论基础
选取合适的球型压头直径与试样大小,可以认为是球形压头在轴向力作用下与半无限试样界面相接触,压痕深度等于针尖处的试样位移,其数值等于压头与试样表面之间的距离,从而,在接触区的试样的力-位移关系曲线可用接触力学的赫兹模型估算。若不考虑所使用刚性压头的弹性,在微小压痕下,则压头半径、作用力、压痕深度与试样等效杨氏模量*之间存在着如式(1)的关系[7]:
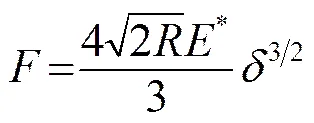
因此,实测接触区中球形压头与试样间的作用力和压痕深度(见图1),利用式(1),即可推导得到生物组织的等效杨氏模量*。
图1 -曲线测量示意图
Fig.1 The schematic diagram of -curve measurement
2 装置
基于曲线的生物组织等效杨氏模量的压痕法测量中,最主要是获取试样所受到的由半径的球形压头向试样施加的作用力,以及在力作用下试样所凹陷的深度即压痕深度D(“-”表示方向,为压头与试样表面之间的距离)。由此,设计了如图2所示的检测装置——毫米压痕弹性仪。
2.1 硬 件
图2所示装置的硬件,主要由作用力加载系统(激光位移传感器、力传感器和伺服电机系统)、二维调节台以及工控机(信号采集卡和运动控制卡)组成,各配置部分的型号和主要参数如表1所示。

表1 系统硬件配置
装置中,压头作用于试样的示意图如图3所示。由于压头的进退运行缓慢,该结构内部受力保持平衡状态,试样受力与压头受试样组织应力,力传感器受弹簧力与力传感器施予弹簧的力,压头受弹簧力与弹簧受压头的力,为三对相互作用力。压头受试样组织应力和弹簧力,见图4。弹簧受压头施予的力和力传感器施予的力,见图5。

图4 压头受力的示意图

图5 弹簧受力的示意图
压痕深度与伺服电机滑台的总位移、压头的位移之间存在关系,因此测得伺服电机滑台总位移与压头的位移就可以计算得到压痕深度。
故而,装置的实际测量过程为:工控机通过控制运动控制卡和伺服驱动器,驱动伺服电机滑台(滑台的总位移可由运动控制卡获得),带动探针,实现对被测软组织试样的应力加载或卸载。同时,由信号采集卡和激光位移传感器组成的信号采集系统,实现对试样所受作用力以及压头位移的实时采集和检测。
2.2 软 件
测量装置的软件装配于上位机中,以Labview为开发平台,主要完成伺服电机滑台运动控制、信号采集分析与显示功能,其工作流程如图6所示。
(1) 运动控制
运动控制卡从工控机中接收控制命令,完成发脉冲/方向、检测限位/原点等信号,带动伺服滑台移动。电机的转速由脉冲频率决定。
(2) 信号采集、分析与显示
完成对由激光位移传感器提供的探针位移和由力传感器提供的试样所受作用力的信号采集后,对两者进行相关运算和处理,转化为反映软组织试样杨氏模量的曲线。
2.3 校 准
(1) 压痕深度
本装置测得的压痕深度数据来自于电机滑台总位移和压头位移的推算,因而数据的精确度依赖于电机滑台和压头的位移精度,为减小误差,需要进行校准。
由于不锈钢板的硬度很高,压头对其进行加载后不会产生压痕深度,故将其作为参考对象。分别对不锈钢板和试样进行压头加载和卸载,在压头与测量对象接触后,相同的电机滑台位移下(不锈钢板电机滑台位移为,试样的电机滑台位移,即),不锈钢板的压头位移即为试样的压头位移与压痕深度之和,,于是。
以猪肉为例进行压痕深度校正,如图7所示。首先将不锈钢板作为实验对象进行测量,将获得的电机滑台位移和压头位移线性拟合,作为校正压痕深度的参考曲线。再以猪肉为实验对象,将获得的电机滑台位移和压头位移线性拟合,得到试样的压痕深度实测曲线。压头前进和后退时,参考曲线与实测曲线在相同横坐标下所对应的纵坐标的差值,即为校正后的压痕深度。
(2) 生物组织黏弹性的影响
利用本装置在进行测量时,基于生物组织实际上为组分复杂的各向异性粘弹体,其表面可能存在的黏液或筋膜等,以及在检测过程中可能产生的蠕变,将会使得利用测得数据线性拟合得到的-呈现出非线性,推算出的杨氏模量会有较大误差。为减小生物组织的粘弹性对测量的影响,文中对不同压痕深度分别计算出其对应的等效杨氏模量*,并将每一组与*进行作图。选取其中等效杨氏模量值*比较稳定的一段,以红色虚线标识,即该段压痕深度下,试样与探针接触良好,试样组织的应力正常,故测得等效杨氏模量值较稳定。将该值作为上述拟合所得等效杨氏模量的参考值(见图8)。
3 结果
测量中,力曲线可以从加载过程中测量,也可以从卸载过程中得到。考虑组织的粘弹特性,通常取卸载的力曲线估算等效杨氏模量。
利用图4的弹性测试仪,市场采购冷鲜肉,对牛肉(后腿肉,60 mm×60 mm×20 mm)、猪肉(后腿肉,60 mm×60 mm×20 mm)、猪肝(去筋膜,60 mm×60 mm×20 mm)、猪肾(去筋膜,60 mm×60 mm×20 mm)等的弹性进行测量。压头半径2.5 mm。压头的前进加载速度和后退的卸载速度是0.1 mm/s。由卸载过程中测得的力曲线如图9所示。
然后,利用式(1)可得到各组织的*-曲线(图10)。由于生物组织只是在某一个应变区域内可以近似为一个弹性体,它的弹性常数不随压痕深度而变化,这样,由图10可以确定所测牛肉、猪肉、猪肝和猪肾试样的等效杨氏模量分别为
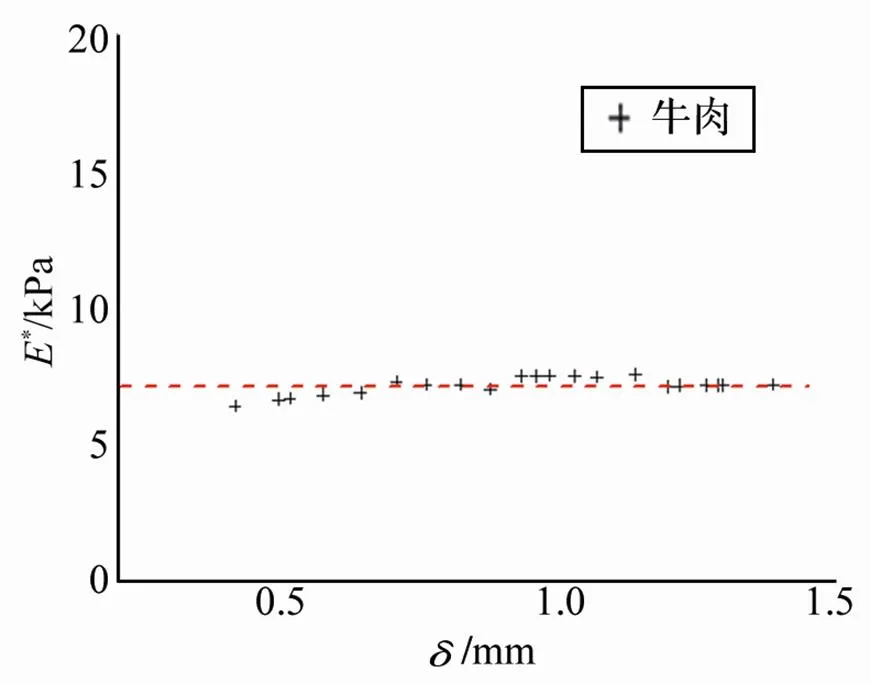
上述测量结果与文献[14,10,19]的结果基本相符,且不同生物组织的等效杨氏模量数值有一定差异,肝和肾的器官比牛肉和肌肉组织明显要更加柔软。
4 结论
对牛肉、猪肉、猪肝和猪肾的等效杨氏模量的实验测量结果表明,本文研发的毫米压痕弹性测量仪可以成功地应用于软组织的弹性测量。但因为该装置利用弹簧作为力的加载元件,限制了仪器在mN量级上力曲线的测量精度,因此有必要对装置进行改进以提高精度。今后还可以在以下方面做进一步的深入研究:如采用超声或光声等方法对系统进行验证;从理论层面对测试条件如压头形状和半径、试样大小、最大压痕深度等进行分析,以支撑具体的实验测试参数的选择;对因生物组织粘弹性导致的进退针测量结果差异进行对比分析。
[1] 杨桂通, 陈维毅, 徐晋斌. 生物力学[M]. 重庆: 重庆出版社, 2000. YANG Guitong, CHEN Weiyi, XU Jinbin. Biomechanicas[M]. Chongqing: Chongqing Publish Press. 2000.
[2] Krouskop T A, Wheeler T M, Kallel F, et al. Elastic moduli of breast and prostate tissues under compression [J]. Ultrasonic Imaging, 1998, 20(4): 260-274.
[3] 付晓丹, 王艳滨. 声触诊组织定量技术评估2 型糖尿病肾病患者肾脏弹性[J]. 实用医学杂志, 2015, 31(1): 81-83. FU Xiaodan, WANG Yanbin. Virtual touch quantification in patients with ii diabetic kidney disease[J]. The Journal of Practical Medicine. 2005. 31(1): 81-83.
[4] 郑永平, 黄燕平. 生物组织弹性测量: 技术、仪器和应用[J]. 中国医疗设备, 2011, 26(5): 1-15. ZHENG Yongping, HUANG Yanping. Soft tissue elasticity measurement: techniques, instrument and applications[J]. China Medical Devices. 2011, 26(5): 1-15.
[5] 王凤港. 软组织的杨氏模量测试方法的研究[D]. 天津: 天津大学硕士学位论文, 2007. WANG Fenggang. Study on testing method of soft tissue’s Young’s modulus[D]. Tianjin: Tianjin University, 2007.
[6] 王宝珍. 肌肉类软组织动态力学性能研究[D]. 合肥: 中国科技大学博士学位论文, 2009. WANG Baozhen. Study on dynamic mechanical characteristics of soft tissues[D]. Hefei: China Science and Technology University. 2009.
[7] Korhonen R K, Laasanen M S, Töyräs J, et al. Comparison of the equilibrium response of articular cartilage in unconfined compression, confined compression and indentation[J]. Journal of Biomechanics, 2002, 35(7): 903-909.
[8] 李醒飞, 孙颖, 张国雄.软组织特性超声测量方法的研究[J]. 仪器仪表学报, 2005, 26(2): 119-123. LI Xingfei, SUN Ying, ZHANG Guoxiong. A study on measurement method of soft tissue features using ultrasound[J]. Chinese Journal of Scientific Instrument, 2005, 26(2): 119-123.
[9] 李江华, 唐志列, 郑楚君, 等. 用光声技术测量生物组织粘弹特性的研究[J]. 生物物理学报, 2005, 21(5): 355-358. LI Jianghua, TANG Zhilie, ZHENG Chujun, et al.Study on viscoelastic characterization of biological tissue by photoacoustic technique [J]. Acta Biophysica Sinica, 2005, 21(5): 355-358.
[10] 李添捷, 郑永平, 汪源源. 生物组织弹性的测量与成像: 基于振动的超声检测方法综述[J]. 中国医疗器械信息, 2013, 19(3): 7-16. LI Tianjie, ZHENG Yongping, WANG Yuanyuan. Measurement and imaging of biological tissue elasticity: a review of the vibration-based ultrasound methods[J]. China Medical Device Information, 2013, 19(3): 7-16.
[11] Clayton T McKee, Julie A Last, Paul Russell, et al. Murphy, D.V.M. indentation versus tensile measurements of young’s modulus for soft biological tissues[J]. TISSUE ENGINEERING: Part B, 2011, 17(3): 155-164.
[12] Donna M Ebenstein, Lisa A Pruitt. Nanoindentation of biological materials[J]. Nanotoday, 2006, 1(3): 26-33.
[13] Adam J Engler, Ludovic Richert, Joyce Y Wong, et al. Surface probe measurements of the elasticity of sectioned tissue, thin gels and polyelectrolyte multilayer films: Correlations between substrate stiffness and cell adhesion[J]. Surface Science, 2004, 570(1-2): 142-154.
[14] Stephanie L Barnes, Andrej Lyshchik, Mary K Washington, et al. Development of a mechanical testing assay for fibrotic murine liver[J]. Medical Physics, 2007, 34(11): 4439-4450.
[15] Egorov V, Tsyuryupa S, Kanilo S, et al. Soft tissue elastometer[J]. Medical Engineering & Physics, 2008, 30(2): 206-212.
[16] Gao L, Parker K J, Lerner R M, et al. Imaging of the elastic properties of tissue: a review[J]. Ultrasound in Medicine and Biology, 1996, 22(8): 959-977.
[17] Eric J Chen, Jan Novakofski, Kenneth Jenkins W, et al. Young’s modulus measurements of soft tissues with application to elasticity imaging[J]. IEEE Trans. on Uffc, 1996, 43(1):191-194.
[18] Vappou J. Magnetic resonance-and ultrasound imaging-based elasticity imaging methods: a review[J]. Crit. Rev. Biomed, Eng, 2012, 40: 121-134.
[19] Philippe Garteiser, Sabrina Doblas, Jean-Luc Daire, et al. MR elastography of liver tumours: value of viscoelastic properties for tumour characterization[J]. European Radiology, 2012, 22(10): 2169-2177.
[20] Kiaran P McGee, Yogesh K Mariappan, Rolf D Hubmayr, et al. Magnetic resonance assessment of parenchymal elasticity in normal and edematous, ventilator-injured lung[J]. Journal of Applied Physiology, 2012, 113(4): 666-676.
[21] Kathy Nightingale. Acoustic radiation force impulse (arfi) imaging: a review[J]. Current Medical Imaging Reviews, 2011, 7(4): 328-339.
[22] Palmeri M L, Wang M H, Dahl J J, et al. Quantifying hepatic shear modulus in vivo using acoustic radiation force[J]. Ultrasound Med. Biol, 2008, 34(4): 546-558.
[23] Jacot J G, Dianis S, Schnall J, et al. A simple microindentation technique for mapping the microscale compliance of soft hydrated materials and tissue[J]. J Biomed Mater Res A, 2006, 79(3): 485-94.
[24] Georgios Constantinides, Ilke Kalcioglu Z, Meredith McFarland, et al. Probing mechanical properties of fully hydrated gels and biological tissues[J]. Journal of Biomechanics, 2008, 41(15): 3285-3289.
[25] Carter F J, Frank T G, Davies P J, et al. Measurements and modelling of the compliance of human and porcine organs[J]. Medical Image Analysis, 2001, 5(4): 231-236.
Measurement of the reduced elastic modulus of biological soft tissues with mm-indentation elastometer
YANG Hong-sui1, GAO Qi2, LIU Xiao-yi1, ZHOU Hong-sheng1
(1. Shanghai Acoustics Laboratory, Chinese Academy of Science, Shanghai 200032, China2. Changchun University of Science and Technology, Changchun 130022, Jilin, China)
The elasticity of biological tissue is the major basis to determine if any disease occurs within the tissue. Young’s modulus is a key parameter that represents the elasticity of the tissue. This paper mainly deals with the set-up of an mm-indention elastometer using Labview software platform and some hardware like data acquisition card and motion control card etc. And by using the mm-indention elastometer, the experiments are conducted for purchased cold-fresh beef, pork, pig liver & kidney samples from the market. During the experiments the data of load force and indentation depth on tissue samples acted by a spherical indenter are directly obtained by the system itself. Then the reduced elastic modulus of tested samples can be deducted according to the analytic relationship between indenter radius R, load force F, indentation depth and sample’s equivalent Young’s modulus E* after the measured data are calibrated. The experimental results are coincident with that in reported papers. It shows that that the designed indentation device in millimeter scale can be adapted to measure the equivalent Young’s modulus of biological tissue.
biological tissues; equivalent Young’s modulus; indentation; mm-indentation elastometer
TB551
A
1000-3630(2016)-04-0336-05
10.16300/j.cnki.1000-3630.2016.04.010
2015-09-20;
2015-12-10
国家自然科学基金资助项目(11274342、11474042、11304353、11574348)
杨红穗(1974-), 女, 河南南阳人, 硕士, 研究方向为超声应用。
周红生, E-mail: zhs999@126.com

