米糠酚类物质的大孔树脂分离纯化工艺
童 鑫,张瑞芬,邓媛元,肖 娟,刘 磊,张 雁,魏振承,张名位
米糠酚类物质的大孔树脂分离纯化工艺
童 鑫1,2,张瑞芬1,邓媛元1,肖 娟1,刘 磊1,张 雁1,魏振承1,张名位1
(1广东省农业科学院蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广州 510610;2华南农业大学食品学院,广州 510642)
【目的】建立米糠中酚类物质的大孔树脂分离纯化工艺,比较米糠提取物纯化前后总酚、总黄酮含量及抗氧化能力,为米糠的深加工利用提供参考。【方法】比较9种不同类型大孔吸附树脂(HPD-100、HPD-200A、HPD-300、HPD-700、D101、HPD-722、AB-8、ADS17和HPD-826)对米糠提取物中总酚的静态吸附和解吸性能,筛选出对脱脂米糠酚类物质纯化效果最佳的大孔吸附树脂类型;通过考察其静态吸附动力学曲线,比较不同上样液浓度、上样流速和上样体积下的动态吸附曲线以及采用不同浓度乙醇洗脱的解吸效果,建立米糠多酚的大孔吸附树脂吸附和解吸工艺条件;比较HPD-300型大孔吸附树脂纯化前后总酚、总黄酮含量,采用高效液相色谱法结合应用酚类标准品分析米糠提取物经大孔吸附树脂纯化前后其各单体酚类物质种类与含量,并通过氧自由基吸收能力(oxygen radical absorption capacity,ORAC)和细胞抗氧化分析法(cellular antioxidant activity,CAA)比较其纯化前后的抗氧化活性。【结果】9种类型大孔吸附树脂对脱脂米糠提取物酚类物质均有一定的吸附能力,其中HPD-300型大孔吸附树脂对脱脂米糠总酚静态吸附和解吸效果明显优于其他类型树脂,其饱和吸附量为9.04 mg GAE·g-1,解吸率为82.62%,同时米糠总酚静态吸附在6 h时达到饱和值。HPD-300型大孔吸附树脂最佳吸附和解吸工艺条件为:米糠酚类提取液上样浓度为1.0 mg GAE·mL-1,上样流速为3.0 BV·h-1,上样体积为3.5 BV,洗脱剂为70%乙醇溶液,洗脱流速为3.0 BV·h-1。经HPD-300型大孔吸附树脂纯化后,米糠酚类提取物的总酚和总黄酮含量分别从纯化前的88.07 µg GAE·mg-1和30.04 µg CE·mg-1提高到320.72 µg GAE·mg-1和133.67 µg CE·mg-1,分别提高了2.6和3.4倍。经高效液相色谱分析,米糠酚类提取物经HPD-300型大孔吸附树脂纯化后,其中的没食子酸、原儿茶酸、香草酸、对羟基苯甲酸、咖啡酸、丁香酸、表儿茶素、香草醛、对香豆酸和阿魏酸等10种酚类单体组成未见明显变化和损失,且上述酚类单体在提取物中的含量较纯化前分别提高0.4—2.4倍。纯化后提取物的ORAC和CAA值分别为3 248.21 µmol TE·g-1和95.24 µmol QE·g-1,较纯化前的1 327.51 µmol TE·g-1和29.19 µmolQE·g-1,分别提高了1.4和2.2倍。【结论】HPD-300型大孔吸附树脂适合米糠酚类物质的分离纯化,经其纯化后的米糠提取物中总酚、总黄酮含量及抗氧化活性提高1—3倍,且不会造成单体酚的明显损失。
米糠;酚类物质;大孔树脂;纯化;细胞抗氧化;氧自由基吸收能力
0 引言
【研究意义】随着营养知识的普及和人们健康意识的增强,全谷物膳食越来越受到人们的重视。流行病学调查结果显示:增加膳食中全谷物的比例有利于高脂血症等许多慢性疾病的防治[1]。全谷物是指除去外壳等不可食用部分后的完整、碾碎、破碎或压片的颖果,包括淀粉质胚乳、胚芽与麸皮(糠层)。与精谷物相比,全谷物因为保留了其糠层而含有更多的维生素、膳食纤维等营养成分,同时其酚类物质等非营养素植物活性物质含量也远高于精谷物。大量研究表明植物多酚具有抗氧化、抗病毒、抗癌、免疫、护肝和保护心血管等生物活性[2-3]。项目组研究发现,占全谷物糙米重量约10%的米糠层含有整粒糙米中超过50%的酚类物质[4]。另有研究表明全谷物不同部位的酚类物质组成及其抗氧化活性不同,米糠层的抗氧化活性大于胚乳部分[5]。因此,探明米糠中酚类物质组成、含量及其生物活性对于揭示全谷物膳食的健康效应,指导米糠的综合加工利用和引导稻米加工产业的可持续发展具有重要意义。【前人研究进展】目前已有关于米糠酚类物质的相关研究,JUNG等[6]测得脱脂米糠中总酚含量为41.65 mg GAE·100g-1DW,通过高效液相色谱法从米糠提取物中检测到阿魏酸、芥子酸、苯甲酸、香豆酸等酚类物质,其中阿魏酸含量最高。SUKHONTHA等[7]在脱脂米糠水提物中检测到原儿茶酸、香草酸、香豆酸、阿魏酸和芥子酸等酚类物质。体内外试验证实米糠中酚类物质具有抗氧化[8]、抗炎[9]、抗癌[10]等活性。尽管已经有学者对米糠中酚类物质组成、含量及其生物活性开展了研究,但目前关于米糠酚类物质生物活性研究采用的试验材料多为米糠经水或乙醇等溶剂浸提后得到的粗提物,含有较多的粗蛋白、可溶性糖类等杂质,对其酚类物质含量及其活性的测定结果都会造成干扰。为探明米糠中酚类物质组成,也有学者利用硅胶柱、聚酰胺柱等柱层析方法对橄榄酚类提取物进行分离纯化[11],但这些方法是以分离制备到单个化合物为目标,不适用于以去除杂质同时保留提取物中各酚类成分为目标的分离纯化。目前常用的酚类物质纯化方法有大孔树脂吸附纯化、硅胶柱层析法、聚酰胺层析法、膜分离法、高效液相色谱半制备色谱分离法、高速逆流色谱法等方法,其中大孔树脂吸附纯化具有吸附容量大,物理化学稳定性高,富集效果好,解吸条件温和,再生处理方便和成本低等的优点。不同极性大孔树脂对酚类物质的分离效果比较已有研究[12-13]。【本研究切入点】不同来源的酚类物质因其所含多酚的种类及结构不同,适于分离纯化的大孔树脂类型及其纯化工艺条件会存在明显差别。研究表明米糠中的酚类物质组成以酚酸为主,与苹果等的多酚以黄酮类为主有明显的不同[14-15]。目前关于苹果、茶叶等来源的多酚的大孔树脂分离纯化工艺已有大量的研究报道,但关于米糠酚类物质分离纯化的研究未见报道。【拟解决的关键问题】以脱脂米糠丙酮/水提取物为材料,通过比较9种不同极性大孔吸附树脂对米糠酚类物质的吸附和解吸特性,筛选出对米糠酚类物质具有良好纯化效果的树脂类型,并优化其纯化工艺参数,旨在为建立米糠酚类物质分离纯化工艺提供技术支撑,指导稻米加工副产物的综合开发利用。
1 材料与方法
试验于2015年3—8月在广东省农业科学院蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室进行。
1.1 试验材料与主要仪器
1.1.1 原料 供试米糠品种为天优998水稻米糠层部位,由广州荔泉食品有限公司提供,将新鲜制备的米糠采用CO2超临界萃取萃取技术进行脱脂处理,得到脱脂米糠后(脱脂后米糠油脂含量为0.1%),参照文献报道方法制备其酚类物质提取物[16]。
1.1.2 大孔树脂 HPD-100、HPD-200A、HPD-300、HPD-700、D101、HPD-722、AB-8、ADS17、HPD-826购自沧州宝恩吸附材料科技有限公司;黑壁透明底96孔板购自美国Corning公司。
1.1.3 试剂 没食子酸、原儿茶酸、香草酸、对羟基苯甲酸、咖啡酸、丁香酸、表儿茶素、香草醛、对香豆酸、阿魏酸、福林酚试剂、Trolox、ABAP、DCFH-DA、荧光素二钠盐和二水合槲皮素购于Sigma Aldrich公司;HepG2细胞购自中国科学院上海生科院细胞资源中心;DMEM培养基购于Thermo Fisher Scientific公司;胎牛血清(FBS)购自美国Gibco公司;其他试剂均为国产分析纯。
1.1.4 仪器 IKA T25高速均质机,德国IKA公司;
EYELA N-1100旋转蒸发仪,京东理化器械株式会社;FDU-2100冷冻干燥机,东京理化器械株式会社;TD6冷冻离心机,长沙湘智离心机仪器有限公司;HZQ-QX智能型全温振荡器,哈尔滨东联电子开发有限公司;Vortex Genie 2多用途涡旋混合器,美国Scientific Industries公司;UV-2450紫外可见分光光度计,日本岛津公司;Infinite M200pro 酶标仪,TECAN公司;Agilent1260高效液相色谱仪-Agilent 1260 series DAD检测器,美国Agilent公司;HERAcell 240i CO2培养箱,Thermo Scientific公司;ULT-2586-4-V超低温冰箱,Thermo Scientific公司。
1.2 试验方法
1.2.1 米糠酚类提取物的制备 精确称取脱脂米糠10.00 g,加入50 mL 4℃预冷的80%丙酮溶液,冰浴条件下10 000 r/min均质10 min,均质液在4℃下5 000 r/min离心10 min后,收集上清液。向沉淀中再加50 mL预冷的80%丙酮溶液重复上述过程一次,合并两次上清液;于45℃下真空旋转浓缩得米糠酚类提取液,冷冻干燥得粉末状提取物,用水溶解米糠酚类提取物至所需浓度,备用。
1.2.2 树脂预处理 9种大孔树脂分别用无水乙醇浸泡24 h,待树脂充分溶胀后,用无水乙醇淋洗,直至洗出液加适量水无白色浑浊现象为止,再用蒸馏水洗至无乙醇味,备用。
1.2.3 不同极性大孔树脂静态吸附量及解吸率试验 称取经预处理的湿树脂HPD-100、HPD-200A、HPD-300、HPD-700、HPD-722、HPD-826、AB-8、ADS17和D101各1.00 g,分别加入100 mL具塞三角瓶中,量取50 mL总酚含量调整至0.2 mg GAE·mL-1的米糠酚类提取液于各三角瓶,室温下振荡24 h,取上清液测定总酚含量,将树脂滤出并用去离子水清洗3次,用滤纸吸干表面水分,转入100 mL具塞三角瓶中,加入50 mL 80%乙醇,室温下振荡解吸12 h,取上清液测定总酚含量,按照下式分别计算吸附量和解吸率。
式中:Q为吸附量(mg·g-1);C0为起始浓度(mg·mL-1);C1为平衡浓度(mg·mL-1);V1为吸附溶液体积(mL);W为树脂重量(g);D为解吸率(%);C2为解吸后溶液中总酚含量(mg·mL-1);V2为解吸溶液体积(mL)。
1.2.4 大孔树脂静态吸附动力学曲线 称取1.00 g
经预处理的湿树脂,置于100 mL具塞三角瓶中,加入上述米糠酚类提取液50 mL,放入摇床室温下静置,每隔30 min震荡2 min。分别在0、0.5、1.0、1.5、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0 h时吸取上清液0.5 mL测定总酚含量,绘制大孔树脂静态吸附动力学曲线。
1.2.5 大孔树脂的动态吸附和解吸
1.2.5.1 上样流速的确定 将预处理过的大孔树脂湿法装柱(柱高200 mm,内径6 mm),上样浓度和上样体积分别固定在1.5 mg GAE·mL-1和6.5 BV。室温条件下,依次用3种不同的流速上样(1.5、3.0和4.5 BV·h-1)处理大孔树脂,每流出0.5 BV流出液,收集并测定总酚浓度。其中流出液总酚浓度达到进样浓度的1/10即为泄漏点,此时为吸附终点,根据泄漏点出现快慢及吸附量确定最佳上样流速。
1.2.5.2 上样浓度的确定 将预处理过的大孔树脂湿法装柱,取6.5 BV不同浓度样液(0.5、1.0、1.5和2.0 mg GAE·mL-1),室温条件下,分别在3.0 BV·h-1的上样流速下通过树脂柱,每流出0.5 BV流出液,收集并测定总酚浓度。根据泄漏点出现快慢及吸附量确定最佳上样浓度。
1.2.5.3 上样体积的确定 将预处理过的大孔树脂湿法装柱,上样浓度和上样流速分别固定在1.5 mg GAE·mL-1和3.0 BV·h-1,室温条件下,取不同体积的样液通过树脂柱,每流出0.5 BV流出液,收集并测定总酚浓度。根据泄漏点出现快慢确定最佳上样体积。
1.2.5.4 洗脱液浓度的确定 将预处理过的大孔树脂湿法装柱,上样浓度、上样流速和上样体积分别固定在1.5 mg GAE·mL-1、3.0 BV·h-1和3.5 BV,室温条件下,将样液通过大孔树脂,待吸附平衡后(6 h),用去离子水洗脱,去除水溶性蛋白、还原糖和多糖等杂质,再用不同浓度(50%、60%、70%、80%、90%)的乙醇溶液作为洗脱剂在相同流速下进行洗脱,洗脱液体积均为5 BV,收集全部洗脱液,测定洗脱液中总酚浓度,计算解吸率。
1.2.6 脱脂米糠纯化前后总酚及总黄酮含量及其抗氧化能力测定 样品预处理:按照优化后的HPD-300大孔树脂纯化工艺参数纯化后得到的米糠酚类洗脱液,经45℃真空旋蒸浓缩至无乙醇,冷冻干燥得粉末状提取物,取适量溶于甲醇中待进一步检测。
总酚含量测定:总酚含量的测定参照SINGLETON等[17]的方法略有改动:向试管中分别加入125 μL标准品或待测样品溶液,再加入0.5 mL超纯水和125 μL福林酚试剂。室温下避光静置6 min后加入1.25 mL m﹕v为7%的 Na2CO3溶液和1 mL超纯水,振荡混匀,室温下避光反应90 min,于760 nm下测定其吸光度。以没食子酸为标准品,总酚含量以每克米糠酚类提取物粉末中所含没食子酸当量(mg gallic acid equivalents·g-1)表示,单位为mg GAE·g-1。
总黄酮含量测定:总黄酮含量的测定参照JIA等[18]的方法略有改动:向试管中分别加入300 µL标准品或待测样品溶液,再加入1.5 mL超纯水和90 μL m﹕v为5%的NaNO2溶液,振荡混匀,避光静置6 min后加入180 μL m﹕v为10%的AlCl3·6H2O溶液,避光反应5 min,再加入0.6 mL 1 mol·L-1的NaOH溶液,然后加入330 μL超纯水,于510 nm下测定其吸光度。以儿茶素为标准品,总黄酮含量以每克脱脂米糠提取物粉末中所含儿茶素当量(mg catechin equivalents·g-1)表示,单位为mg CE·g-1。
1.2.7 米糠酚类提取物纯化前后单体酚组成及含量分析 将大孔树脂纯化前、后的米糠酚类提取物采用高效液相色谱法分析其单体酚组成及含量。具体液相色谱条件参考ZHANG等的方法略有改动[19]。色谱柱:Zorbox SB-C18柱(250 mm×4.6 mm,5 μm);柱温:30℃;进样量:10 μL;流速:1.0 mL·min-1。流动相:100%乙腈(A)和0.4%冰乙酸(B)。按照以下梯度洗脱:0—40 min,5%—25% A;40—45 min,25%—35% A,总运行时间45 min。采用DAD检测器,检测波长280 nm。样品色谱峰保留时间与标准品保留时间比较,判定单体酚种类,根据峰面积计算单体酚含量,结果以µg·mg-1米糠提取物计(µg·mg-1)。
1.2.8 米糠酚类提取物纯化前后总酚及总黄酮含量及其抗氧化活性测定 氧自由基清除能力(oxygen radical absorbance capacity,ORAC)测定[20]:将米糠酚类提取物用pH 7.4、浓度为75 mmol·L-1的磷酸缓冲液稀释至不同浓度。向96孔板每孔中分别加入20 μL提取物溶液或Trolox标准品溶液或空白对照,再向每孔加入200 μL预先在37℃孵育过的0.96 μmol·L-1荧光素,此96孔板在37℃条件下孵育20 min。孵育完后,除F孔外,每孔分别加入20 µL用25℃磷酸缓冲液配制的119 mmol·L-1ABAP溶液(现配现用),F孔中加入20 μL磷酸缓冲液。激发波长485 nm,发射波长520 nm条件下测定各孔荧光值,共35个循环,每个循环4.5 min。米糠酚类提取物的ORAC值用Trolox当量(μmol Trolox equivalents·g-1)表示,单位为μmol TE·g-1。
细胞抗氧化活性(cellular antioxidant activity,CAA)测定[21]:将HepG2细胞(生长对数期)转入含有10%的胎牛血清DMEM培养基中,将细胞密度调整至6×105·mL-1。向96孔细胞培养板中加入100 μL细胞悬液,培养24 h后吸出培养液。再向各孔加入100 μL DMEM培养基(含有25 μmol·L-1DCFH-DA和不同浓度槲皮素标准品或米糠酚类提取物),37℃下孵育1 h。孵育完后,除空白对照孔以外,再向各孔加入含有600 μmol·L-1ABAP的PBS 100 μL,空白对照孔加入100 μL 2ABAP的PBS。在37℃下读取该96孔板各孔的荧光值,激发波长485 nm,发射波长520 nm下测定各孔荧光值,共12个循环,每个循环5 min。米糠酚类提取物的CAA值用槲皮素当量(μmol Quercetin equivalents·g-1)表示,单位为μmol QE·g-1。
1.3 结果统计分析
实验重复3次,结果用均值±标准差表示,不同极性大孔树脂静态吸附量及解吸率实验结果采用SPSS 13.0进行单因素方差分析以及SNK检验。纯化前后酚类物质含量和抗氧化活性比较采用独立样本检验,<0.05时差异有统计学意义。
2 结果
2.1 不同大孔树脂的静态吸附与解吸能力
不同极性的9种大孔树脂在相同条件下,经24 h静态吸附后对米糠多酚提取物总酚的吸附量和解吸率如图1和2所示。结果表明,HPD-300大孔树脂的吸附量最高(9.59 mg GAE·g-1),其次是HPD-100(8.84 mg GAE·g-1),两者间差异显著(<0.05)。HPD-200A、HPD-700、HPD-722、D101和AB-8五种树脂对米糠多酚的吸附效果相当,以ADS-17的吸附效果最差。HPD-100、HPD-200A、HPD-300、HPD-700和HPD-722 的解吸率相当,均在80%以上(>0.05),高于受试的其他几种大孔树脂。综合考虑大孔树脂对米糠提取物中总酚的吸附量和解吸率结果,选取吸附和解吸性能均最好的大孔树脂HPD-300进行吸附动力学研究。
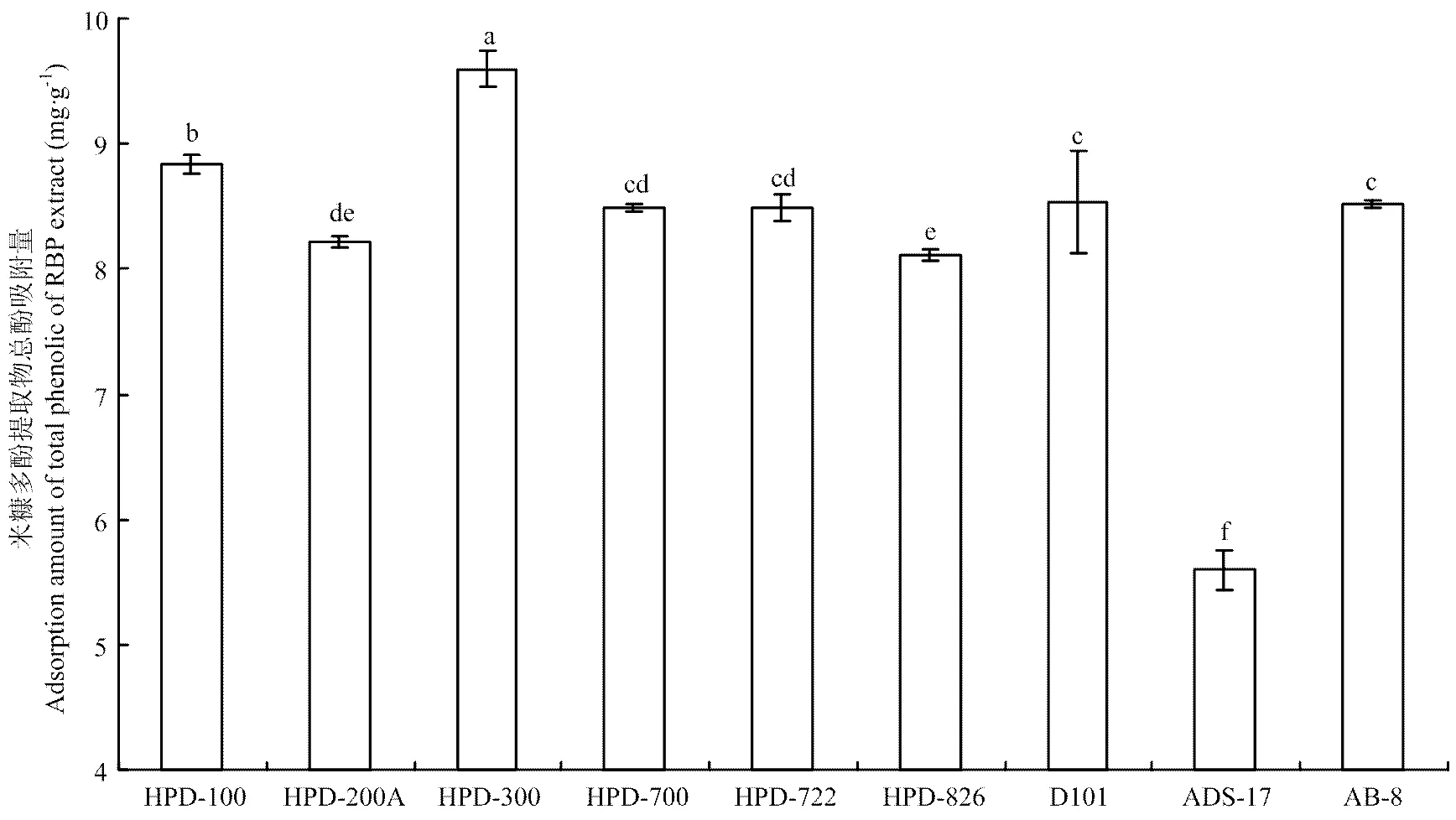
不同小写字母表示差异显著(P<0.05)。下同 Different small letters indicate significant difference (P<0.05). The same as below

图2 不同极性大孔树脂对米糠酚类提取物的静态解吸率比较
2.2 HPD-300型大孔树脂的吸附动力学
HPD-300大孔树脂吸附米糠酚类物质动力学结果见图3。静态吸附起始阶段HPD-300大孔树脂对米糠总酚的吸附量快速上升,属于快速平衡型。随着时间的延长,吸附曲线逐渐变得平缓,树脂对米糠多酚的吸附量变化缓慢,HPD-300大孔树脂吸附脱脂米糠总酚的量在6 h后达到吸附平衡。

图3 HPD-300树脂吸附米糠酚类物质的动力学曲线
2.3 上样流速
米糠酚类提取物上样流速对HPD-300大孔树脂吸附性能的影响见图4。上样流速为1.5、3.0和 4.5 BV·h-1时,泄漏点分别在上样体积为6.0、3.5和2.0 BV附近出现。在上样流速为1.5、3.0和4.5 BV·h-1时,HPD-300大孔吸附树脂对米糠酚类提取物总酚的吸附量分别是168、113和81 mg GAE。当上样流速为1.5 BV·h-1时,泄漏点尽管最晚出现,但上样时间较长,工作效率低。上样流速为4.5 BV·h-1时,虽然较快达到泄露点,但大孔树脂对总酚的吸附量较低,可能是因为上样流速过快,导致样液与树脂表面接触时间过短,酚类物质来不及扩散到树脂的内表面充分吸附,从而降低吸附率。当上样速度为3.0 BV·h-1时,泄漏点出现相对较早,同时树脂吸附量较高。综合考虑纯化效率和成本,选择3.0 BV·h-1为最适宜上样流速。

图4 上样流速对HPD-300树脂吸附性能的影响
2.4 上样浓度
米糠酚类提取物上样浓度对HPD-300大孔树脂吸附性能的影响见图5。米糠多酚提取物样品浓度为2 mg GAE·mL-1时,上样体积在2 BV时即开始泄漏,泄露点出现太早,样品处理量少,且在此浓度下样液黏度较大,且含有沉淀物,容易对树脂造成堵塞,降低其吸附性能;样品浓度为0.5 mg GAE·mL-1时,在上样体积达5.5 BV时才达到泄漏点,此时上样时间过长,不适于实际应用;当样品浓度为1.5 mg GAE·mL-1和1.0 mg GAE·mL-1时,泄漏点均在3.5 BV附近出现。样品浓度为1.0、1.5和2.0 mg GAE·mL-1时,树脂吸附量分别为141、113和85 mg GAE。样品浓度为1.0 mg GAE·mL-1时,HPD-300大孔树脂对米糠酚类物质的吸附量最大,因此,将米糠酚类物质的上样浓度确定为1.0 mg GAE·mL-1。

图5 上样浓度对HPD-300树脂吸附性能的影响
2.5 上样体积
米糠酚类提取物上样体积对HPD-300树脂吸附性能的影响见图6。随着上样体积的增加,流出液中总酚浓度随之增加,在3.5 BV时,流出液中总酚浓度为150 µg GAE·mL-1,达到泄漏点,上样量继续增加,流出液中总酚含量继续升高,因此选择上样量为3.5 BV。
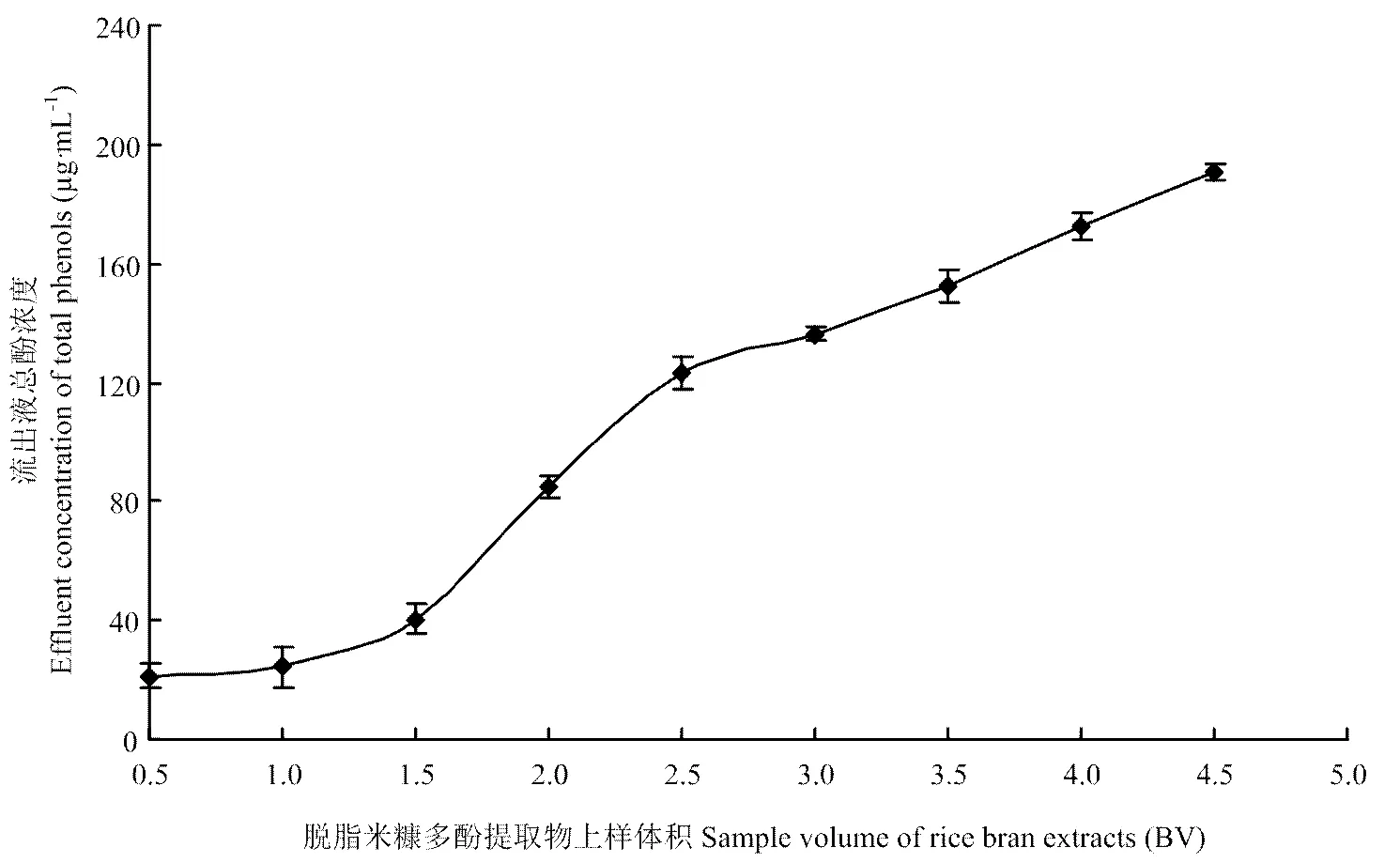
图6 上样体积对HPD-300树脂吸附性能的影响
2.6 洗脱液的浓度
洗脱液乙醇体积分数对HPD-300大孔树脂吸附的米糠酚类物质的解析性能见图7。HPD-300大孔树脂的解吸性能随着洗脱液乙醇浓度的增加呈先上升后降低的趋势,当洗脱液乙醇体积分数为50%时,解吸率最低,为70.8%;随着洗脱液乙醇体积分数的提高,在70%时,解吸率达到最大,为86.41%;当乙醇体积分数提高到80%和90%时,解吸率有所下降,分别为80.24%和77.35%。因此,选择70%乙醇为洗脱溶剂。
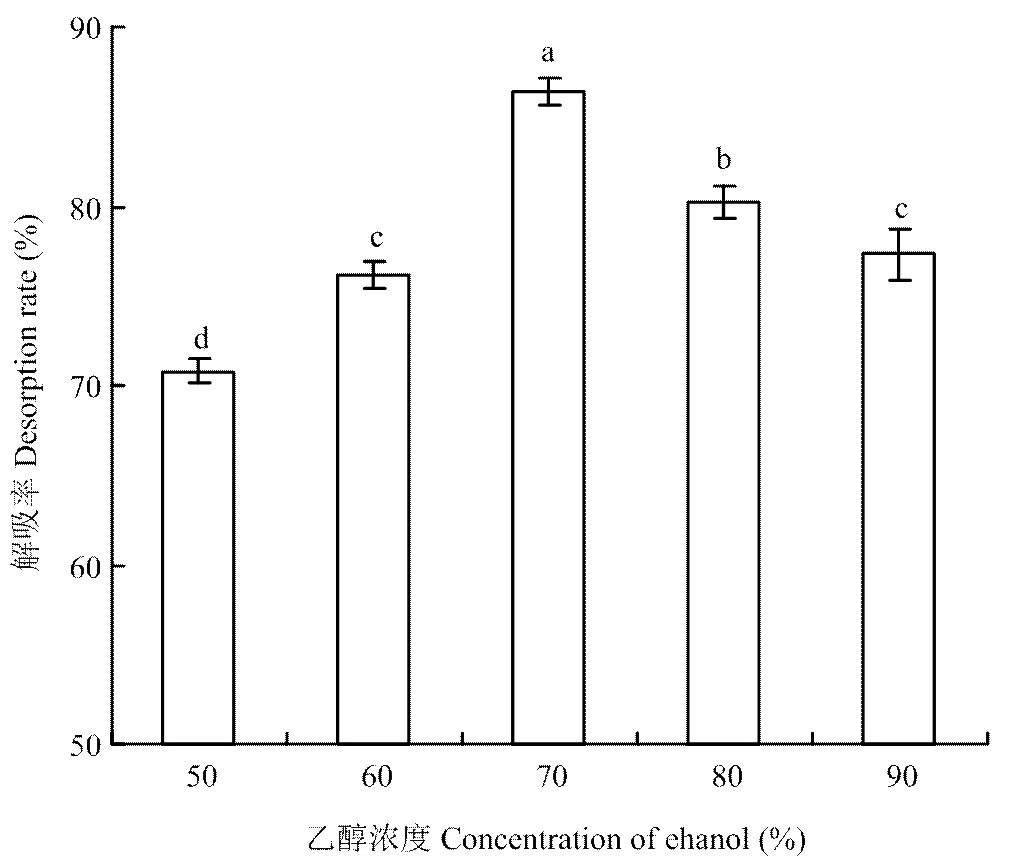
图7 不同乙醇浓度洗脱液对HPD-300树脂吸附的米糠酚类物质解吸率的影响
2.7 纯化前后米糠提取物中单体酚类的组成与含量
大孔树脂HPD-300纯化前后的米糠酚类提取物HPLC谱见图8。由图可见,米糠酚类提取物纯化前在2—5 min有较多杂峰,纯化后杂峰有所减少,且后面主要的酚类物质均被很好地保留,说明HPD-300大孔树脂适用于米糠多酚的分离纯化。从脱脂米糠中共检测到10种单体酚类物质,经树脂纯化前后的含量见表1。米糠酚类提取物中含量最高的酚类物质是阿魏酸、没食子酸、对香豆酸。经HPD-300大孔树脂处理后,酚类物质有所损失,是由于在上样后洗脱除杂过程中,少部分酚类物质被洗脱下来而损失掉,同时在解析过程中洗脱液对吸附到树脂上的米糠酚类物质的解析能力无法达到100%,会有少量酚类物质吸附在树脂上造成纯化过程中的损失。经过HPD-300大孔树脂吸附脱脂米糠中单体酚构成谱并未发生明显改变,由表1可以看出,各单体酚组分含量均有明显增加。综上所述,HPD-300树脂能较好地分离纯化脱脂米糠提取物中酚类物质。
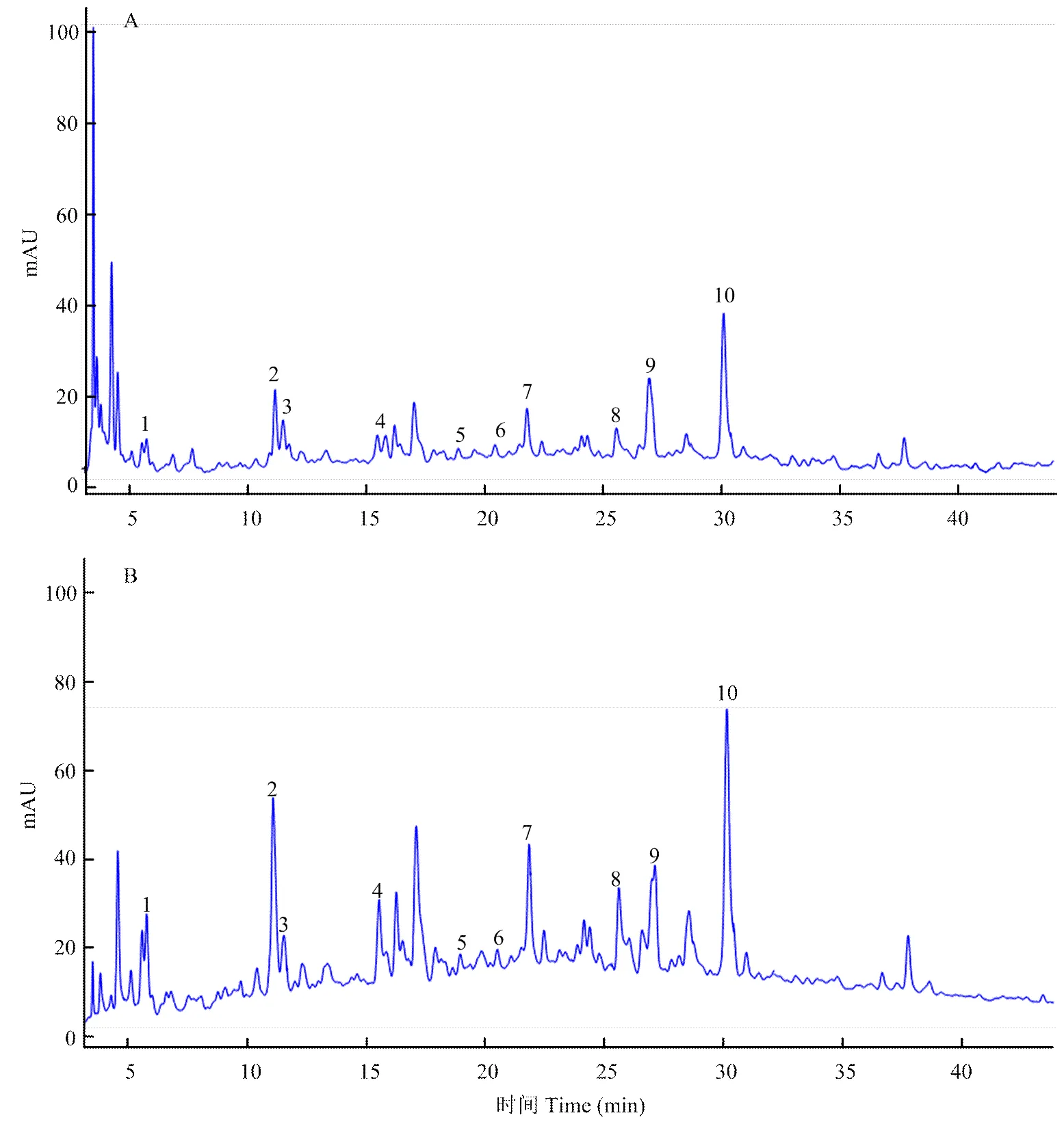
A:纯化前;B:纯化后 A: Before purification; B: After purification。1:没食子酸 Gallic acid;2:原儿茶酸Protocatechuic acid;3:香草酸Vanillic acid;4:对羟基苯甲酸4-Hydroxybenzoic acid;5:咖啡酸Caffeic acid;6:丁香酸Syringic acid;7:表儿茶素Epicatechin;8:香草醛Vanillin;9:对香豆酸p-coumaric acid;10:阿魏酸Ferulic acid
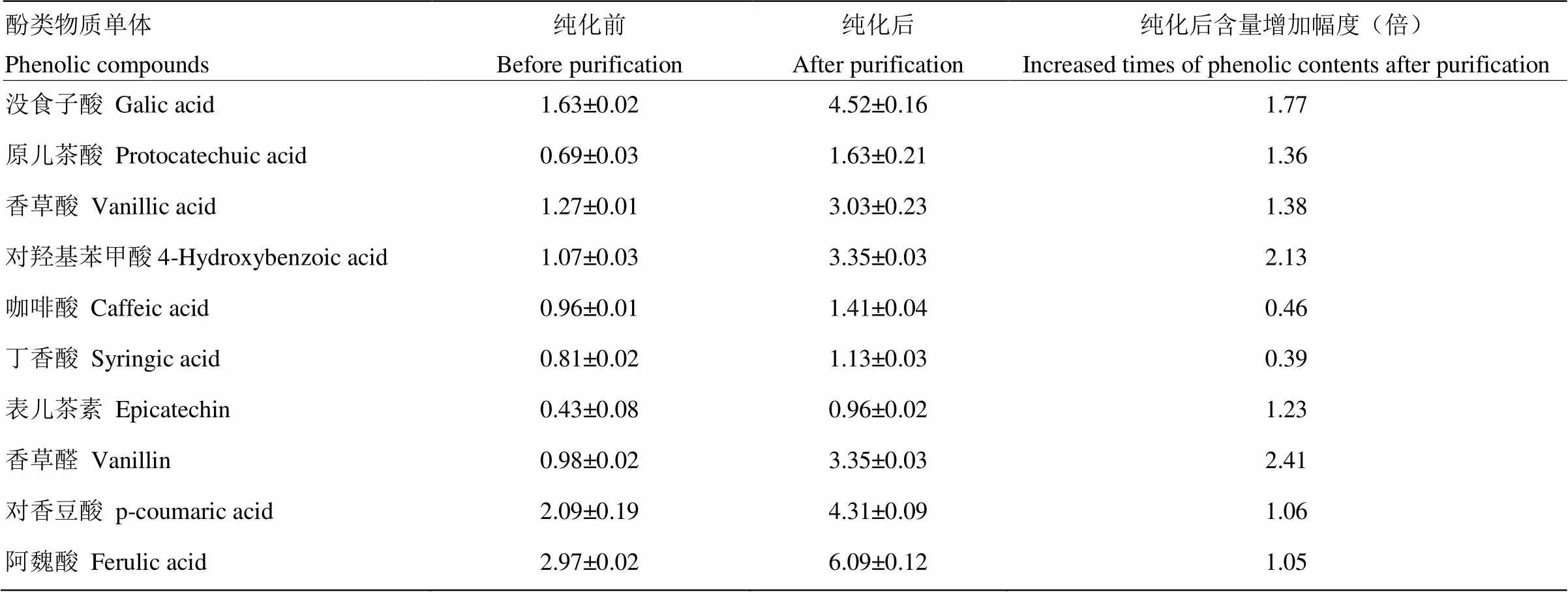
表1 HPD-300大孔树脂纯化前后米糠酚类提取物中单体酚种类及含量比较
2.8 纯化前后米糠提取物总酚、总黄酮含量及抗氧化能力
米糠酚类提取物经大孔树脂纯化前后的总酚、总黄酮含量及抗氧化能力见表2。纯化后米糠酚类提取物中总酚和总黄酮含量分别为320.72 µg GAE·mg-1和133.67 µg CE·mg-1,较纯化前的88.07 µg GAE·mg-1和30.04 µg CE·mg-1分别提高了2.6和3.4倍。纯化前的脱脂米糠酚类提取物CAA和ORAC值分别为29.19 µmol QE·g-1和1 327.51 μmol TE·g-1,而纯化后的CAA和ORAC值分别为95.24 µmol QE·g-1和3248.21μmol TE·g-1,较纯化前分别提高了2.2和1.4倍。

表2 HPD-300大孔树脂纯化前后米糠酚类提取物总酚总黄酮含量和抗氧化能力比较
3 讨论
3.1 大孔树脂极性对米糠酚类物质吸附性能的影响
大孔树脂是一种包含网状孔穴结构、不含交换基团的高分子吸附材料,由于其较多的网状孔穴结构、较大的颗粒比表面积以及一定的极性基团,因而具有较大的吸附能力。有机化合物根据其分子体积的大小及吸附力的强弱,可吸附在一定规格的大孔吸附树脂上,采取适当的溶剂洗脱可达到分离的目的[22]。不同极性和含不同官能团的树脂对各类化合物的吸附能力不同,因此,对于分离纯化植物中的有效成分,选择适合的树脂型号非常重要。已有大量文献报道不同植物来源的酚类物质的分离纯化适用不同大孔树脂类型。凌庆枝等[23]比较了7种不同极性的大孔吸附树脂(AB-8、D-101、HPD-450 、HPD-500、HPD-600、HPD-750、NKA-9)对芦根总酚酸的分离纯化作用,结果显示HPD-500型大孔树脂对芦根总酚酸成分具有较好的吸附和解吸性能,精制纯化后,芦根提取物中总酚酸含量较纯化前提高了10倍,说明HPD-500型大孔树脂对酚酸类化合物的富集具有高选择性。李文兰等[24]比较了4种大孔吸附树脂(AB-8、D-101、X-5和NKA-9)对川穹中阿魏酸及总酚酸的分离纯化效果,发现D-101型大孔树脂对川穹中阿魏酸及总酚酸具有较好的吸附效果。冯进等[25]通过比较8种大孔树脂(AB-8、D-101、DM-130、HPD-100、HPD-400、HPD-400A、HPD-750和HPD-826)对蓝莓叶多酚的静态吸附与解吸效果,发现HPD-400大孔树脂对富含咖啡酰奎宁酸与槲皮素甙的蓝莓叶多酚的吸附解吸效果最好。非极性和弱极性的大孔吸附树脂对于极性溶剂(水)提取物中的芳香族化合物具有较好的吸附性能[26]。由高效液相色谱分析结果可以看出,米糠提取物中所含酚类物质是一类水溶性的具有苯环结构的芳香族化合物,因而非极性(HPD-100、HPD-300、HPD-700和D101)及弱极性(HPD-722和AB-8)的大孔吸附树脂对米糠多酚的吸附量均较好,其中HPD-300树脂的比表面积最大(800—870 m2·g-1),孔径最小(50—55A°),更有利于小分子物质的吸附,因而表现出较好的吸附性能。
3.2 大孔树脂吸附和解吸性能对米糠酚类物质吸附性能的影响
大孔树脂的分离效果不仅与树脂极性相关,上样及洗脱条件也会影响树脂的吸附性能。目前已有大量关于上样流速、上样浓度等因素影响大孔树脂吸附性能的研究报道。杨芙莲等[27]比较了不同上样浓度(0.16、0.24、0.32、0.40和0.48 mg·mL-1)及上样流速(1.0、2.0和3.0 mL·min-1)对AB-8大孔树脂吸附甜荞麦壳黄酮性能的影响,结果发现树脂的吸附率随上样浓度的增大而减小,随上样流速增大则泄漏率呈增大趋势,综合考虑吸附率,确定最佳吸附工艺条件为吸附液浓度0.24 mg·mL-1、吸附流速2.0 mg·mL-1。王雅等[28]采用动态吸附分离法,研究沙枣多酚提取物不同上样浓度(0.25、0.5、1.0、1.5和2.0 mg·mL-1)和上样流速(0.5、1.0、1.5、2.0和2.5 mL·min-1)下NKA-9大孔树脂的泄漏曲线,发现上样浓度为1.0 mg·mL-1,上样流速为1.0 mL·min-1时树脂对沙枣多酚的吸附性能较好。以上研究结果均说明,在高浓度样品和较高上样速度时,尽管上样时间缩短,但泄漏点出现较早,树脂对总酚的吸附量较低。其原因可能是上样浓度过高导致过多的多酚分子停留在树脂表面,阻碍其他酚类物质进入树脂内部,使得酚类物质无法在树脂内扩散吸附,从而降低树脂的吸附率;当较高上样流速时,酚类物质和树脂接触时间很短,酚类物质尚未被吸附到树脂的内表面就被流出,使得树脂吸附率下降。而在过低的样品浓度和较慢的上样流速时,泄漏点虽然出现较晚但作业周期延长,不利于实际生产应用。中等样品浓度和上样流速增加了酚类物质与树脂的接触,有利于提高树脂对酚类物质的吸附量,延迟泄漏点出现时间。本研究与以上文献报道一致,中等样品浓度和上样流速更有利于米糠提取物酚类物质的分离纯化。
上样体积也是影响树脂吸附性能的重要因素。当上样体积过大时树脂容易发生吸附过饱和,酚类物质无法再扩散到树脂内部进行吸附,且上样体积过大,树脂柱上部容易发生多层吸附,或是树脂孔隙深处吸附的样液溶质分子过多,二者结合作用力增强,树脂对溶质分子的吸附量超过了其饱和吸附量,发生树脂局部中毒现象,造成大孔树脂再生困难,影响树脂的重复利用。本研究显示,上样体积为3.5 BV时,流出液中总酚浓度达到泄漏点,树脂吸附饱和。
乙醇水溶液是大孔树脂分离纯化过程中常使用的洗脱溶液,不同的乙醇浓度对树脂解吸活性成分的解吸效果明显不同。吴彩娥等[29]研究青钱柳叶总黄酮大孔树脂纯化工艺,比较3种不同浓度乙醇洗脱液(50%、70%、90%)对AB-8树脂解吸性能的影响,发现树脂的解吸率随洗脱液浓度的增加呈先上升后下降的趋势,70%的乙醇洗脱率最佳。冀德富等[30]比较了5种不同浓度乙醇洗脱液(5%、30%、50%、70%、90%)对HPD-100大孔树脂吸附的叶下珠总多酚的解吸效果,发现50%乙醇洗脱所得固形物中总酚含量最高。可见,因树脂类型和纯化酚类物质的不同,适宜的洗脱液浓度会有差别。本研究结果显示,70%乙醇对米糠多酚有较好的洗脱效果,一方面可能是由于米糠中的多酚多为水溶性物质,其解吸需要一定的含水量,当乙醇浓度过高时,洗脱剂中含水量较少,米糠酚类物质难以溶出,导致解吸率较低;另一方面,当乙醇体积分数过低时,因解吸溶剂极性过大而不利于多酚物质的洗脱。
3.3 大孔树脂吸附对米糠酚类物质的组成及抗氧化活性的影响
米糠中含有的酚类物质组成较为复杂,本研究从大孔树脂纯化前的米糠酚类提取物中检测到没食子酸、阿魏酸、儿茶素、表儿茶素、绿原酸等10种单体酚类成分。为探明经大孔树脂纯化后上述不同种类的酚类物质含量变化,对纯化后的酚类提取物进行HPLC分析,发现经过大孔树脂吸附后脱脂米糠多酚不会造成峰丢失,即单体酚组成未发生改变,各单体酚含量均有明显增加。因此,HPD-300型大孔树脂适于分离纯化脱脂米糠多酚。纯化后的米糠酚类提取物总酚和总黄酮含量明显提高,因此其抗氧化活性也较纯化前明显增强。通过ORAC方法和更接近生理环境的细胞抗氧化分析方法进行测定,发现纯化后的米糠酚类提取物细胞抗氧化活性较纯化前提高了3.2倍,ORAC抗氧化活性提高了2.4倍,表明经大孔树脂纯化也明显提高了米糠酚类提取物的生物活性。
4 结论
通过静态吸附和解吸试验筛选出适用于脱脂米糠多酚分离纯化的大孔吸附树脂为HPD-300,其分离纯化米糠酚类提取物的最佳工艺条件为:米糠酚类提取物上样浓度为1.0 mg GAE·mL-1,上样流速为3.0 BV·h-1,上样体积为3.5 BV,70%乙醇溶液作为洗脱剂,洗脱流速为3.0 BV·h-1。纯化后的脱脂米糠多酚提取物总酚和总黄酮含量较纯化前分别提高了2.6和3.4倍,氧自由基吸收能力和细胞抗氧化活性分别提高了1.4和2.2倍,且不会造成其10种主要单体酚组成变化,其含量较纯化前提高0.4—2.4倍。
References
[1] LIU R H. Whole grain phytochemicals and health.2007, 46: 207-219.
[2] PANDEY K B, RIZVI S I. Plant polyphenols as dietary antioxidants in human health and disease., 2009, 2(5): 270-278.
[3] GHARRAS H E. Polyphenols: food sources, properties and applications–a review. International, 2009, 44: 2512-2518.
[4] TI H H, LI Q, ZHANG R F, ZHANG M W, DENG Y Y, WEI Z C, CHI J W, ZHANG Y. Free and bound phenolic profiles and antioxidant activity of milled fractions of different indica rice varieties cultivated in southern China., 2014, 159(13): 166-174.
[5] HUNG P V, MAEDA T, MIYATAKE K, MORITA N. Total phenolic compounds and antioxidant capacity of wheat graded flours by polishing method., 2009, 42(1): 185-190.
[6] JUNG E H, KIM S R, HWANG I K, HA T Y. Hypoglycemic effects of a phenolic acid fraction of rice bran and ferulic acid in C57BL/ KsJ-db/db mice., 2007, 55(24): 9800-9804.
[7] SUKHONTHARA S, KAEWKA K, THEERAKULKAIT C. Inhibitory effect of rice bran extracts and its phenolic compounds on polyphenol oxidase activity and browning in potato and apple puree., 2015, 190: 922-927.
[8] JUN H, SONG G, YANG E, YOUN Y, KIM Y. Antioxidant activities and phenolic compounds of pigmented rice bran extracts., 2012, 77(7): C759-C764.
[9] AKIHISA T, YASUKAWA K, YAMAURA M, UKIYA M, KIMURA Y, SHIMIZU N, ARAI K. Triterpene alcohol and sterol ferulates from rice bran and their anti-inflammatory effects., 2000, 48(6): 2313-2319.
[10] KONG C K, LAM W S, CHIU L C, OOI V E, SUN S S, WONG Y S. A rice bran polyphenol, cycloartenyl ferulate, elicits apoptosis in human colorectal adenocarcinoma SW480 and sensitizes metastatic SW620 cells to TRAIL-induced apoptosis., 2009, 77(9): 1487-1496.
[11] HE Z Y, XIA W S, CHEN J. Isolation and stucture elucidation of phenolic compounds in Chinese olive (L.) fruit., 2008, 226(5): 1191-1196.
[12] 李臻, 吴晖, 赖富饶. 大孔树脂对溪黄草多酚吸附分离的工艺优化.食品科技, 2012, 37(9): 192-196.
LI Z, WU H, LAI F R. Macroporous resin adsorption for seperation of polyphenols from(Maxim.) Hara., 2012, 37(9): 192-196. (in Chinese)
[13] 安晓婷, 周涛, 李春阳, 王兴娜. 大孔树脂纯化蓝莓果渣多酚及其组成分析. 食品科学, 2013, 34(20): 1-6.
AN X T, ZHOU T, LI C Y, WANG X N. Macroporous resin purification of polyphenols from blueberry pomace and its composition analysis., 2013, 34(20): 1-6. (in Chinese)
[14] SHAO Y F, BAO J S. Polyphenols in whole rice grain: Genetic diversity and health benefits., 2015, 180: 86-97.
[15] ALONSO-SALCES R M, NDJOKO K, QUEIROZ E F, IOSET J R, HOSTETTMANN K, BERRUETA L A, GALLO B, VICENTE F. On-line characterisation of apple polyphenols by liquid chromatography coupled with mass spectrometry and ultraviolet absorbance detection., 2004, 1046: 89-100.
[16] ZHAO H F, DONG J J, LU J, CHEN J, LI Y, SHAN L J, LIN Y, FAN W, GU G X. Effects of extraction solvent mixtures on antioxidant activity evaluation and their extraction capacity and selectivity for free phenolic compounds in barley (L.)., 2006, 54: 7277-7286.
[17] SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTOS R M. Analysis of total phenols and other oxidation substrates and antioxidants by means ofreagent., 1999, 299: 152-178.
[18] JIA Z S, TANG M C, WU J M. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals., 1999, 64: 555-559.
[19] ZHANG R F, ZENG Q S, DENG Y Y, ZHANG M W, WEI Z C, TANG X J. Phenolic profiles and antioxidant activity of litchi pulp of different cultivars cultivated in southern China., 2013, 136(3): 1169-1176.
[20] PRIOR R L, HOANG H, GU L, WU X, BACCHIOCCA M, Howard L, HAMPSCH-WOODIL M, HUANG D, OU B, JACOB R. Assays for hydrophilic and lipophilic antioxidant capacity (oxygen radical absorbance capacity (ORAC(FL) of plasma and other biological and food samples., 2003, 51: 3273-3279.
[21] WOLFE K L, LIU R H. Cellular antioxidant activity (CAA) assay for assessing antioxidants foods, and dietary supplements., 2007, 55: 8896-8907.
[22] 屠鹏飞, 贾存勤, 张洪全. 大孔吸附树脂在中药新药研究和生产中的应用. 世界科学技术, 2004, 6(3): 22-28.
TU P F, JIA C Q, ZHANG H Q. Application of macroporous adsorption resins to study and production of TCM new drugs., 2004, 6(3): 22-28. (in Chinese)
[23] 凌庆枝, 袁怀波. 大孔树脂分离纯化芦根中总酚酸的研究.食品科学, 2008, 29(8): 310-313.
LI Q Z, YUAN H B. Study on separation and purification of total phenolic acid from rhizome ofTrin. by macroporous resin., 2008, 29(8): 310-313. (in Chinese)
[24] 李文兰, 范玉奇, 季宇彬, 王艳萍, 赵瑛. 大孔吸附树脂对川穹中阿魏酸及总酚酸的分离纯化. 中国新药杂志, 2007, 16(9): 701-705.
LI W L, FAN Y Q, JI Y B, WANG Y P, ZHAO Y. Separation and purification of forulic acid and total phenolic acid fromHort by macroporous resins., 2007, 16(9): 701-705. (in Chinese)
[25] 冯进, 李敏, 曾晓雄, 李春阳. 大孔树脂纯化蓝莓叶多酚及其组成分析. 食品科学, 2013, 34(10): 86-91.
FENG J, LI M, ZENG X F, LI C Y. Macroporous resin purification and composition analysis of polyphenols from blueberry leaves., 2013,34(10): 86-91. (in Chinese)
[26] 苏东晓, 张瑞芬, 张名位, 黄菲, 魏振承, 张雁, 遆慧慧, 邓媛元, 唐小俊. 荔枝果肉酚类物质大孔树脂分离纯化工艺优化. 中国农业科学, 2014, 47(14): 2897-2906.
SU D X, ZHANG R F, ZHANG M W, HUANG F, WEI Z C, ZHANG Y, TI H H, DENG Y Y, TANG X J. Separation and purification of polyphenol in litchi pulp by macroporous resins., 2014, 47(14): 2897-2906. (in Chinese)
[27] 杨芙莲, 夏银, 任蓓蕾. 大孔树脂对甜荞麦壳类黄酮的纯化研究. 食品科技, 2009(1): 135-139.
YANG F L, XIA Y, RENG B L. Study on purification of general flavonoids from buckwheat hulls with macroporous resin., 2009(1): 135-139. (in Chinese)
[28] 王雅, 樊明涛, 赵萍, 曾贤菲, 李占娟. 大孔树脂对沙枣多酚的动态吸附解析性能研究. 西北农林科技大学学报(自然科学版), 2010, 38(12): 215-220.
WANG Y, FAN M T, ZHAO P, ZENG X F, LI Z J. Dynamic absorption and desorption of polyphenols fromL. by macroporous absorbent resins., 2010, 38(12): 215-220. (in Chinese)
[29] 吴彩娥, 方升佐, 冯宗帅, 杨万霞, 李婷婷, 贾韶千. 青钱柳叶总黄酮大孔树脂纯化工艺. 农业机械学报, 2009, 40(6): 133-137.
WU C E, FANG S Z, FENG Z S, YANG W X, LI T T, JIA S Q. Purification process of total flavonoids in cyclocarya paliurus leaves with macroporous resins., 2009, 40(6): 133-137. (in Chinese)
[30] 冀德富, 郭东艳. HPD100大孔树脂纯化叶下珠总多酚的工艺研究.中华中医药杂志, 2013, 28(1): 240-242.
JI D F, GUO D Y. Study on purification of total polyphenols inL. by HPD100 macroporous resin., 2013, 28(1): 240-242. (in Chinese)
(责任编辑 赵伶俐)
Separation and Purification of Polyphenols in Rice Bran by Macroporous Resins
TONG Xin1,2, ZHANG Rui-fen1, DENG Yuan-yuan1, XIAO Juan1, LIU Lei1, ZHANG Yan1, WEI Zhen-cheng1, ZHANG Ming-wei1
(1Sericultural & Agri-food Research Institute, Guangdong Academy of Agricultural Sciences/Key Laboratory of Functional Foods, Ministry of Agriculture/Guangdong Key Laboratory of Agricultural Products Processing, Guangzhou 510610;2College of Food Science, South China Agricultural University, Guangzhou 510642)
【Objective】The objective of this study is to screen a resin with a good adsorption and desorption performance to rice bran polyphenols (RBP) and optimize the purification technique, to compare the total phenols, total flavonoids content and antioxidant activity before and after purification, thus providing a theoretical basis for the deep processing and utilization of rice bran.【Method】The behavior of static adsorption and desorption, dynamic adsorption and desorption of 9 macroporous resins (HPD-100, HPD-200A, HPD-300, HPD-700, D101, HPD-722, AB-8, ADS17, and HPD-826) with different polarities to RBP was determined. Kinetic characteristics of static adsorption of the preferred resin were analyzed. The purification technique of macroporous resin to RBP was developed through the dynamic adsorption and desorption curves under different loading and elution conditions, including phenolic concentrations in loading samples, sampling rates, sampling volumes and ethanol concentrations in eluent. The phenolic profiles in RBP before and after resin purification were analyzed by HPLC analysis. Their total phenolic and flavonoid contents, oxygen radical absorption capacity (ORAC) and cellular antioxidant activity (CAA) were also estimated. 【Result】HPD-300 exhibited the best capability of adsorption and desorption to RBP among the 9 selected macroporous resins. The saturated absorption quantity of HPD-300 resin to RBP was 9.04 mg GAE·g-1, and the desorption rate was 82.62%. It took 6 h for HPD-300 resin to reach absorption equilibrium. The optimized purification parameters were as follows: the phenolic concentration of loading sample is 1 mg GAE·mL-1, sampling rate is 3.0 BV·h-1, sampling volume is 3.5 BV, eluent is 70% ethanol, flow velocity is 3.0 B V·h-1. After HPD-300 resin purification, the total phenolic content increased by 2.6 times from 88.07 µg GAE·mg-1to 320.72 µg GAE·mg-1, and the total flavonoids content increased by 3.4 times from 30.04 µg CE·mg-1to 133.67 µg CE·mg-1. Ten phenolic compounds were identified from rice bran phenolic extract, which were gallic acid, protocatechuic acid, vanillic acid,-hydroxy benzoic acid, caffeic acid, clove acid, epicatechin, catechins, vanillic aldehyde,-coumaric acid and ferulic acid by HPLC analysis. The phenolic profiles of the extract were not changed after HPD-300 resin purification, but the concentrations of 10 phenolic compounds increased by 0.4-2.4 times. The ORAC and CAA antioxidant activity of the extract changed from 1 327.51 µmol TE·g-1and 29.19 µmol QE·g-1before purification to 3 248.21 µmol TE·g-1and 95.24 µmol QE·g-1after purification, and increased by 1.4 and 2.2 times, respectively.【Conclusion】The total phenolic and flavonoid contents and antioxidant activity increased by 1-3 times after HPD-300 resin purification. The individual phenolic compounds in the extract were not lost significantly during purification. Therefore, HPD-300 macroporous resin was suitable to purify rice bran phenolic extract.
rice bran; phenolics; macroporous resin; purification; CAA; ORAC
2016-03-09;接受日期:2016-07-12
国家自然科学基金(31501478)、广东省自然科学基金团队项目(2016A030312001)、广东省科技计划项目(2015A020209072,2016B070701012)
童鑫,E-mail:tongxin322@126.com。通信作者张名位,E-mail:mwzhh@vip.tom.com

