中华蜜蜂气味结合蛋白基因AcerOBP14的克隆及时空表达
杜亚丽,张中印,潘建芳,王树杰,杨 爽, 3,赵慧婷,姜玉锁
中华蜜蜂气味结合蛋白基因的克隆及时空表达
杜亚丽1,张中印2,潘建芳1,王树杰1,杨 爽1, 3,赵慧婷4,姜玉锁1
(1山西农业大学动物科技学院,山西太谷 030801;2河南科技学院资源与环境学院,河南新乡 453003;3云南省农业科学院蚕桑蜜蜂研究所,云南蒙自 661101;4山西农业大学生命科学学院,山西太谷 030801)
【目的】克隆获得中华蜜蜂()基因序列,并对其蛋白结构进行预测,分析其在不同组织和发育阶段的时空表达差异,为该基因的功能研究提供参考。【方法】以中华蜜蜂全组织cDNA为模板利用RT-PCR技术扩增和克隆获得cDNA全长序列,并提交至GenBank数据库;利用多种生物信息学软件预测分析其编码蛋白的理化特性和结构特征;采用MEGA5.2软件中的邻位相连法(neighbor-joining,NJ)构建AcerOBP14及其同源膜翅目昆虫OBPs的系统发育树;通过实时荧光定量PCR技术分析在1、5、10、15、20、25和30日龄中华蜜蜂不同组织(触角、头、胸、腹、足和翅)中mRNA的表达情况。【结果】克隆获得了中华蜜蜂气味结合蛋白基因的cDNA序列(GenBank登录号为KT24648)。的开放阅读框(ORF)长度为408 bp,编码135个氨基酸,预测其蛋白分子量为15.08 kD,理论等电点为5.44,有信号肽,无跨膜结构,且第18—127位氨基酸之间存在一个昆虫气味结合蛋白家族PBP-GOBP superfamily保守结构域;存在多个比较明显的疏水区域,可能是脂溶性气味分子的结合位点;含有4个保守的半胱氨酸位点,属于Minus-C OBP亚家族。亚细胞定位分析表明,AcerOBP14属于分泌型蛋白,主要集中在内质网-高尔基体-质膜分泌途径上。AcerOBP14蛋白具有7个螺旋,1—6属于典型OBPs核心螺旋,7位于C端且暴露在蛋白表面。氨基酸同源序列比对结果显示,AcerOBP14与西方蜜蜂AmelOBP14的氨基酸序列一致性最高,达到86%;其次是大蜜蜂AdorGOBP56a-like,一致性为55%。系统进化树分析表明,同为蜜蜂属的中华蜜蜂AcerOBP14、西方蜜蜂AmelOBP14、大蜜蜂AdorGOBP56a-like、中华蜜蜂AcerOBP21和小蜜蜂AfloGOBP56d-like聚为一个分支,切叶蜂属的苜蓿切叶蜂MrotGOBP56a-like、侧沟茧蜂属的毁侧沟茧蜂MdemGOBP83a-like、壁蜂属的角额壁蜂OcorOBP3和熊蜂属的BterGOBP56d-like和BimpGOBP56d-like聚为另一大分支。荧光定量PCR结果显示,在成蜂不同发育期的触角、头、胸、腹、足和翅中均有表达,其表达程度有差异。1日龄工蜂的胸部表达量最高,触角次之,且两者均极显著高于头、腹、足和翅(<0.01);其他日龄工蜂触角表达量均极显著高于其他组织(<0.01),其中20日龄工蜂的触角表达量最高。从各组织在不同发育阶段的表达量来看,触角的表达量在1日龄最低,极显著地低于其他日龄(<0.01);5、10日龄逐渐增加,15日龄突然下降,20日龄达到最高,极显著高于其他日龄(<0.01);之后又呈逐渐下降趋势。头、胸、腹、足和翅膀表达量总体上随日龄增加而呈下降趋势,5日龄之后大幅下降,之后趋于平稳且呈低丰度表达。【结论】AcerOBP14属于Minus-C OBP亚家族,具有PBP-GOBP家族的典型结构;组织表达谱结果暗示,AcerOBP14属普通气味结合蛋白GOBP,在中华蜜蜂中除嗅觉识别之外还参与其他生理功能。
中华蜜蜂;;基因克隆;生物信息学;时空表达
0 引言
【研究意义】昆虫生存与繁殖的相关行为在很大程度上依赖于自身的嗅觉系统。昆虫嗅觉系统是一个高度复杂和极其灵敏的感受系统,能够探测数以万计的挥发性气味分子,即使在浓度很低的情况下,也可以辨别仅有一个或几个原子不同的气味物质[1]。嗅觉识别过程中,气味结合蛋白(odorant binding proteins,OBPs)最先与外界脂溶性气味物质发生生化反应,在昆虫与外界进行信息交流的过程中发挥着重要作用[2-3]。中华蜜蜂()作为中国原有的蜜蜂当家品种,有嗅觉灵敏、采集力强、善于利用零星蜜源植物、抗逆抗病能力强等意大利蜜蜂无法比拟的优点,非常适合在中国的山林地区定地饲养。对中华蜜蜂OBPs的研究,不仅可以明确其嗅觉识别机制,还能够为科学饲养管理、蜜蜂病害防治提供理论指导。【前人研究进展】OBPs是一类以极高的浓度存在于嗅觉受体周围淋巴液中的水溶性蛋白,一般由130—220个氨基酸组成,分子量介于10—30 kD,等电点多在4.4—5.2[4]。OBPs在N末端有一段20多个氨基酸残基的信号肽序列,典型的特征是含有6个保守的半胱氨酸(Cys)位点,两两配对形成3对二硫键[5-7]。自1981年在鳞翅目昆虫中发现第一个昆虫气味结合蛋白以来,已在11个目的50多种昆虫中鉴定出了800多个OBPs。OBPs的数量在不同种类昆虫中差异较大,如在黑腹果蝇()、西方蜜蜂()、赤拟谷盗()、家蚕()、椰甲截脉姬小蜂()中已分别鉴定出51、21、46、44、8个OBPs[8-12]。根据保守半胱氨酸的数目分为Classical OBPs、Plus-C OBPs(8个保守的Cys和1个Pro位点)、Minus-C OBPs(只有4个保守的Cys)、Atypical OBPs(9—10个Cys位点和长的C末端)和Dimer OBPs(由两组6个保守的半胱氨酸形成二聚体)[13-16]。据报道,Minus-C OBPs可能是Classical OBPs、Plus-C OBPs等的祖先基因[17]。早期研究认为OBPs特异地表达于昆虫触角中,特别是性信息素结合蛋白PBPs主要表达于雄性昆虫的触角[18-20]。近年来大量研究发现OBPs并非只表达和分布于昆虫的触角中,如苜蓿盲蝽()特异性表达于足中[21];埃及伊蚊()在触角、喙、精囊和气门中均有表达[22];棉铃虫()在雌虫翅膀中表达量较高[23];松墨天牛()和高表达于雄虫头部,触角表达量最低[24];中华蜜蜂低丰度表达于头、胸、腹、足和翅膀中[25],在足中表达量最高[26],在采集蜂的触角、足和翅膀中均有表达[27]。【本研究切入点】目前中华蜜蜂气味结合蛋白的研究主要集中在典型OBP上,但有关Minus-C OBPs表达及功能尚无报道。【拟解决的关键问题】在中华蜜蜂触角转录组测序的基础上,克隆得到中华蜜蜂的一个Minus-C OBP基因(),并对其蛋白结构特征进行预测,利用real-time PCR技术进一步对其时空表达情况进行分析,以期为该蛋白的深入研究提供理论依据。
1 材料与方法
试验于2015年3—9月在山西农业大学完成。
1.1 供试昆虫
试验用中华蜜蜂样本于2015年5—6月份采自山西农业大学动物科技学院中华蜜蜂试验场。选取群势较强、健康无病的正常蜂群,从中抽出一张新蜂将要出房的成熟封盖子脾于人工培养箱恒温培养(34℃),待其羽化出房后用无味无毒的油漆在背部进行标记(约2 500只),再放回原来的蜂巢,分别在成蜂1、5、10、15、20、25、30日龄时进行采样。每个日龄采300只,随机分为3组,按触角、头(去除触角)、胸、腹、足和翅6个组织进行分离。每100只工蜂各组织的混合样作为一个生物学重复,迅速投入盛有液氮的研钵中研磨至粉末状,倒入装有1 mL RNAiso Plus的1.5 mL离心管中,-80℃保存。
1.2 主要试剂和仪器
Total RNA提取试剂盒RNAiso Plus、第一链cDNA合成试剂盒PrimeScriptTMRT Reagent Kit with gDNA Eraser(perfect real time)、克隆载体pMDTM19-T Vector Cloning Kit、荧光定量试剂盒SYBR®TMII (Tli RNaseH Plus)、DNA Marker DL 1000、氨苄青霉素、IPTG、X-Gal、50×TAE Buffer等试剂均购自大连宝生物公司;感受态细胞Trans5、琼脂糖凝胶DNA纯化试剂盒E.Z.D.ATMGel Extraction Kit(OMEGA,USA)购自北京全式金生物技术有限公司;PCR反应试剂2×Es Taq MasterMix(含染料)购自北京康为世纪生物科技有限公司,异丙醇、氯仿、无水乙醇等分析纯购自北京化工厂。
ABI梯度PCR仪由美国应用生物系统公司生产,实时荧光定量PCR仪Mx3000P由美国Stratagene公司生产,紫外凝胶成像分析系统由美国BIO-RAD公司生产,5430R小型台式高速冷冻离心机由德国艾本德Eppendorf股份公司生产,ND-1000核酸蛋白浓度测定仪由美国NanoDrop科技有限责任公司制造。
1.3 总RNA的提取及cDNA第一链的合成
各组织样本总RNA的提取按照RNAiso Plus试剂盒说明书进行。在测定浓度和纯度之后,再根据PrimeScriptTMRT Reagent Kit with gDNA Eraser(perfect real time)试剂盒反转录合成cDNA第一链,-20℃保存备用或直接进行下一步试验。其中,不同日龄的不同组织cDNA模板用于荧光定量PCR反应;整只蜜蜂全组织cDNA模板用于目的基因的克隆。
1.4 引物设计
以笔者课题组前期所获得的中华蜜蜂触角转录组测序结果和NCBI数据库为基础,通过BLASTN比对得到目的基因片段。使用Primer Premier 5.0软件在相似性较高的区域设计引物扩增的cDNA序列。根据克隆得到的序列预测该基因的开放阅读框(ORF),并在此区域设计特异性引物用于荧光定量PCR。本试验选择西方蜜蜂的(actin releated protein 1)序列(GenBank登录号:NM_001185145.1)作为内参基因,引物信息详见表1。所用引物由北京华大基因科技有限公司合成。
1.5的cDNA克隆
以中华蜜蜂全组织cDNA为模板,使用2×Es Taq MasterMix试剂盒在PCR扩增仪上进行扩增。PCR反应体系:cDNA模板2 μL,2×Es Taq MasterMix 10 μL,上、下游引物(10 μmol∙L-1)各1 μL,RNase-Free Water 6 μL,总体系为20 μL。反应程序:94℃预变性4 min;94℃变性30 s,51℃退火30 s,72℃延伸30 s,35个循环;72℃终延伸8 min。PCR扩增产物经1.2%琼脂糖凝胶电泳检测,将目的片段进行切胶,并根据E.Z.D.ATMGel Extraction Kit试剂盒使用说明进行DNA回收,将回收产物连接到pMDTM19-T克隆载体,转化至Trans5感受态细胞,经蓝白斑筛选鉴定,翌日挑取单一白色菌落至含Amp(1﹕1 000)的LB液体培养基中扩大培养。菌液经PCR鉴定,将阳性克隆产物送北京华大基因科技有限公司进行双向测序。
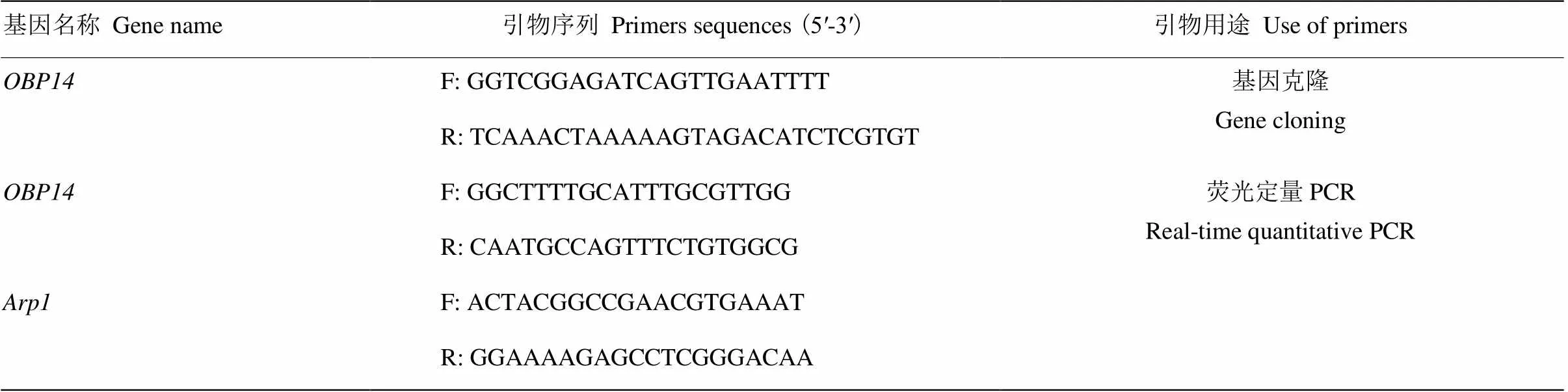
表1 本研究所用引物
1.6序列的生物信息学分析
将测序所得序列在NCBI中用Blastn(http://blast.ncbi.nlm.nih.gov/Blast.cgi)工具进行核酸序列的同源性分析,利用在线软件ORF Finder(http://www.ncbi. nlm.nih.gov/gorf/gorf.html)查找序列的开放阅读框,使用Lasergene软件中的EditSeq工具预测其编码的氨基酸序列。运用在线工具NCBI Conserved Domains(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析保守结构域;ProtParam(http://web.expasy.org/cgi-bin/protparam/protparam)预测蛋白的分子量、等电点等理化性质;ProtScale(http://web.expasy.org/cgi-bin/protscale/protscale.pl)进行疏水性分析;SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽序列;TMHMM-2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析跨膜结构;SMART(http://smart.embl-heidelberg.de/)分析功能结构域;PSORT II(http://psort.hgc.jp/form2.html)和LocTree 3(https://rostlab.org/services/loctree3/)进行亚细胞定位[28];PredictProtein(https://www.predictprotein.org/)预测氨基酸序列中二硫键的位置。将去除信号肽的氨基酸序列导入在线软件PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)、Swiss-Model(http://swissmodel.expasy.org/)分别进行蛋白二级结构和三级结构的预测。利用DNAMAN软件进行氨基酸的多序列比对,采用MEGA5.2软件中的邻接法(neighbor-joining,NJ)构建系统发育树,Bootrap为1 000次。
1.7 荧光定量PCR反应
以各日龄的成蜂cDNA(反转录之后进行4倍稀释)为模板,使用SYBR®TMII(Tli RNaseH Plus)试剂盒进行荧光定量PCR。反应体系为20 μL:SYBR®TMII(2×)10 μL,ROX Reference Dye II(2×)0.4 μL,上、下游引物(10 μmol∙L-1)各0.8 μL,cDNA模板2 μL,灭菌超纯水6 μL。反应条件:95℃预变性30 s;接着进行45个循环:95℃ 30 s,60℃ 34 s。测定熔解曲线的反应条件:以0.5℃的升温速度从60℃升至95℃。每个样品进行3次平行重复。
1.8 数据统计与分析
荧光定量结果应用MXPro-MX3000P软件(Stratagene,美国)进行分析处理。根据标准曲线及荧光曲线的Ct值,采用2-△△Ct法进行数据分析。采用SPSS17.0软件中的ANOVA法进行单因素方差分析,并选用Duncan’s法进行显著性差异分析。所得结果均以平均数±标准误(mean±SE)表示,并利用GraphPad Prism 5.2软件进行图形分析。
2 结果
2.1
以中华蜜蜂全组织cDNA为模板进行PCR扩增,得到与预期长度一致的目的片段,克隆获得菌液PCR结果显示为阳性,送至测序公司进行测序,结果表明该片段大小为497 bp。将该序列在NCBI中进行BLASTN比对,与西方蜜蜂(GenBank登录号:NM_001040223.1)核苷酸序列相似性为92%,因此命名为。该基因已在GenBank中注册,登录号为KT246483。
利用ORF Finder对所获得的序列分析表明,cDNA序列包括37 bp的5′非编码区(5′UTR)、408 bp的完整开放阅读框(ORF)和52 bp的3′非编码区(3′UTR),共编码135个氨基酸(图1)。AcerOBP14蛋白分子式为C673H1101N167O204S9,预测分子量为15.08 kD,理论等电点为5.44。在组成AcerOBP14蛋白的18种氨基酸中,赖氨酸(Lys)所占的比例最高,达到11.9%;带正电荷氨基酸总数(Arg+Lys)为16,带负电荷氨基酸总数(Asp+Glu)为18,表明该蛋白不带电荷;总平均疏水系数(GRAVY)为0.105,不稳定系数为25.36,脂溶系数为107.48,说明该蛋白比较稳定。AcerOBP14的氨基酸序列中含有4个保守的半胱氨酸位点,缺失第2个和第5个保守的半胱氨酸,属于Minus-C OBP亚家族。

小写字母为非编码区,大写字母为开放阅读框;起始密码子和终止密码子用粗体标识,信号肽序列用下划线标注,保守半胱氨酸位点用红色方框标注Non-coding region was showed by lowercase letters, ORF was showed by uppercase letters, the start and stop codons were indicated by bold, signal peptide was underlined, conversed cysteine residues were boxed in red
2.2 AcerOBP14蛋白的结构预测
在线NCBI结构域分析结果表明,编码产物的第18—127位氨基酸之间存在一个昆虫气味结合蛋白家族的保守结构区域PBP-GOBP superfamily(图2)。AcerOBP14蛋白的信号肽位于1—16位氨基酸,剪切位点位于16和17位氨基酸之间,无跨膜结构。疏水性分析显示,AcerOBP14的氨基酸序列中,第27位氨基酸Score值最低为-1.822,第8位氨基酸最高为3.244,平均疏水性为0.105;存在多个比较明显的疏水区域(Score为正值的区域),它们可能是脂溶性气味分子的结合位点。亚细胞定位结果表明,AcerOBP14蛋白可能存在于细胞外(66.7%)、液泡(11.1%)、内质网(11.1%)和线粒体(11.1%)中,主要集中在分泌途径上,说明该蛋白属于分泌型蛋白。该蛋白的第29—127位氨基酸之间存在一个PhBP功能结构域,可能与其特异性结合气味分子、调控嗅觉机制有关。蛋白二级结构预测表明,-螺旋(helix)、折叠股(strand)和卷曲环(loop)的比例分别为54.81%、41.48%和3.7%。以西方蜜蜂OBP14(PDB登录号:3S0A)为模板对其进行3-D结构的预测(图3),结构相似度为84.03%。从图3可以看出,该蛋白包含7个螺旋,其中1(19—37)、2(41—49)、3(57—70)、4(82—89)、5(94—105)和6(112—126)为典型OBP的核心螺旋区域。7在C端的130—133位氨基酸之间,暴露于蛋白表面[17]。两对二硫键的半胱氨酸残基对Cys33-Cys65连接着1和2螺旋,Cys104-Cys122连接着5和6,这些结构可能形成一个与气味物质结合的空腔。

图2 AcerOBP14的保守结构区域预测
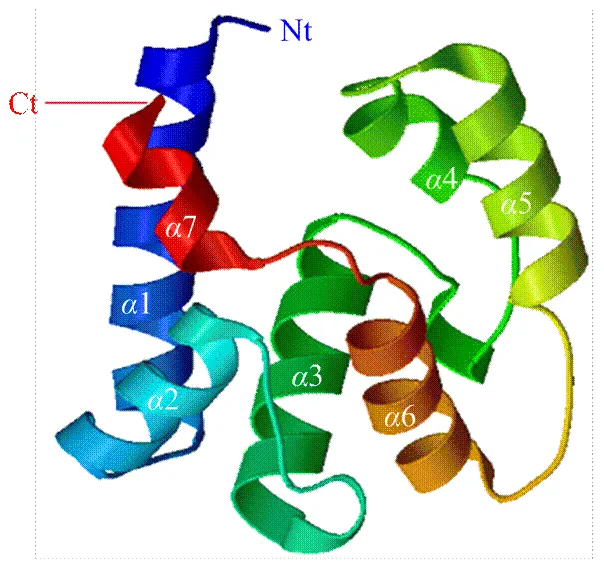
图3 中华蜜蜂AcerOBP14蛋白的3-D结构预测模型
2.3 AcerOBP14的序列比对和系统进化分析
将克隆所得核酸序列在NCBI核酸数据库中进行BlastX分析,找到与目的基因有同源性的膜翅目其他昆虫的氨基酸序列。序列比对结果显示,中华蜜蜂AcerOBP14与其他昆虫OBPs的氨基酸序列一致性差别较大(图4)。中华蜜蜂AcerOBP14与西方蜜蜂AmelOBP14的氨基酸序列一致性最高,达到86%,其次是大蜜蜂AdorGOBP56a-like,一致性为55%。此外,AcerOBP14与同属Minus-C OBP亚家族的AcerOBP21氨基酸序列一致性只有46%,同源性较低,这可能与不同气味结合蛋白在中华蜜蜂嗅觉识别及产生行为反应的过程中发挥的功能不同有关。使用MEGA5.2软件邻位相连法进行1 000次重复计算后构建系统进化树(图5)。由图5可以看出,所有选用的膜翅目昆虫OBPs形成两个大的分支:同为蜜蜂科蜜蜂属的中华蜜蜂AcerOBP14、西方蜜蜂AmelOBP14、大蜜蜂AdorGOBP56a-like、中华蜜蜂AcerOBP21和小蜜蜂AfloGOBP56d-like聚为一个分支,其中AcerOBP14与AmelOBP14亲缘关系最近;切叶蜂属的苜蓿切叶蜂MrotGOBP56a-like、侧沟茧蜂属的毁侧沟茧蜂MdemGOBP83a-like、壁蜂属的角额壁蜂OcorOBP3和熊蜂属的BterGOBP56d-like和BimpGOBP56d-like聚为另一大分支。
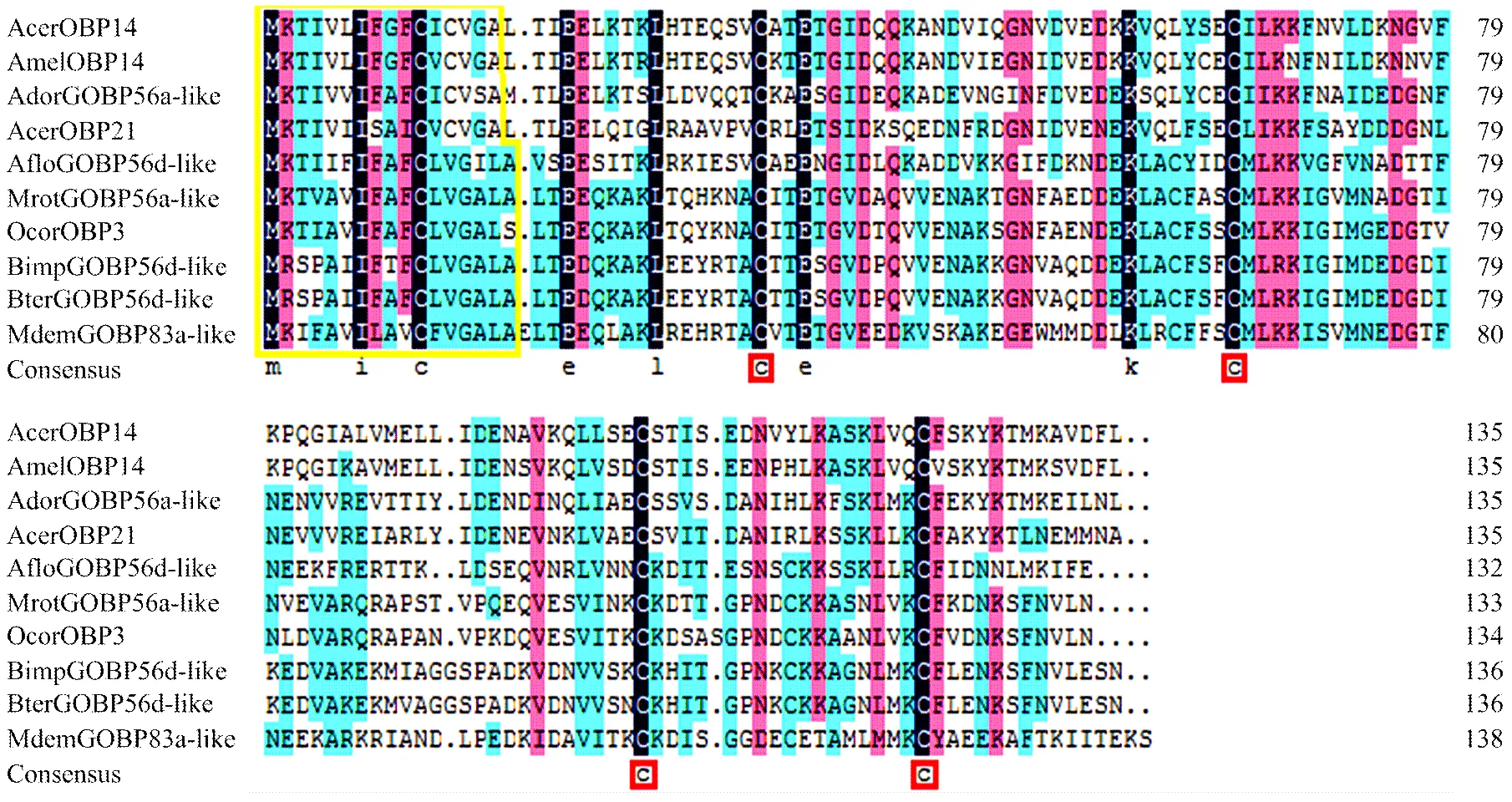
信号肽序列用黄色方框标注,保守半胱氨酸位点用红色方框标注 The amino acids in yellow frame were the signal peptide. Conversed cysteine residues were boxed in red。OBP蛋白来源及GenBank登录号 Origin of OBP proteins and their GenBank accession numbers: AmelOBP14, Apis mellifera (NP_001035313.1); AdorGOBP56a-like, Apis dorsata (XP_006609098.1); AcerOBP21, Apis cerana cerana (AKQ98509.1); AfloGOBP56d-like, Apis florae (XP_003695876.1); MrotGOBP56a-like, Megachile rotundata (XP_003708550.1); OcorOBP3, Osmia cornuta (AGI05202.1); BimpGOBP56d-like, Bombus impatiens (XP_003494618.1); BterGOBP56d-like, Bombus terrestris (XP_003402792.1); MdemGOBP83a-like, Microplitis demolitor (XP_008548247.1)
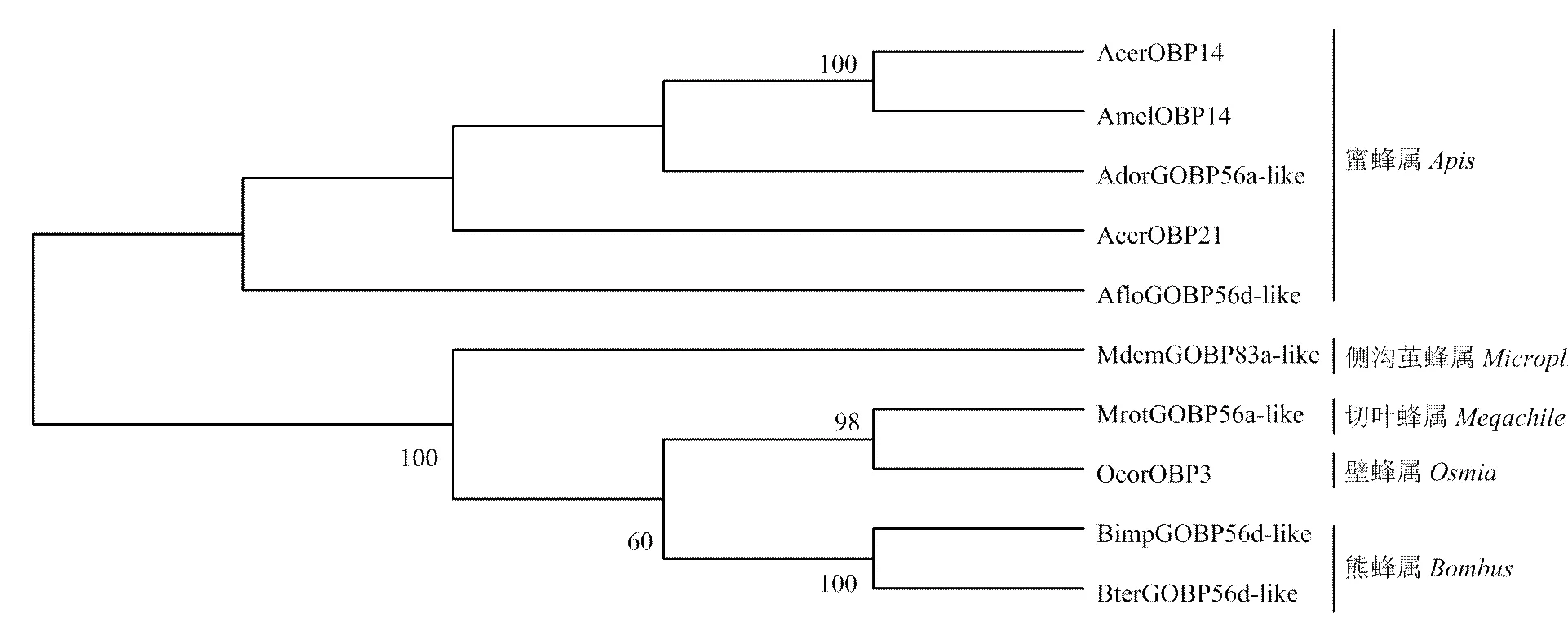
图5 基于氨基酸序列构建的膜翅目昆虫OBPs的系统发育树
2.4mRNA时空表达分析
以10日龄头部表达量为基准,通过实时荧光定量PCR技术分析在1、5、10、15、20、25和30日龄中华蜜蜂不同组织中mRNA的表达差异(图6)。由图6可以看出,在中华蜜蜂不同发育期的触角、头、胸、腹、足和翅中均有表达,但其表达程度有差异。1日龄新生蜂胸部表达量最高,触角次之,均极显著高于其他组织(<0.01),足中表达量极显著高于腹、头和翅(<0.01)。5日龄内勤蜂触角中的表达量极显著高于其他组织(<0.01),头、胸、足和翅中表达量极显著高于腹部(<0.01)。25日龄采集蜂触角中的表达量极显著高于其他组织(<0.01),头部表达量极显著高于除触角外的其他组织(<0.01),胸、腹、足和翅之间差异不显著(>0.05),胸部表达量最低。10、15、20和30日龄成蜂触角中的表达量极显著高于其他组织(<0.01),其他组织之间差异不显著(>0.05);其中,15日龄胸部表达量最低,其他3个日龄腹部表达量最低。从各组织在不同发育阶段的表达量来看,触角的表达量在1日龄最低,极显著地低于其他日龄(<0.01);5、10日龄逐渐增加,15日龄突然下降,20日龄达到最高,极显著高于其他日龄(<0.01),约为1日龄的7.5倍;之后又呈逐渐下降趋势。头、胸、腹、足和翅表达量总体上随日龄增加而呈下降趋势,5日龄之后大幅下降,之后趋于平稳且呈低丰度表达。
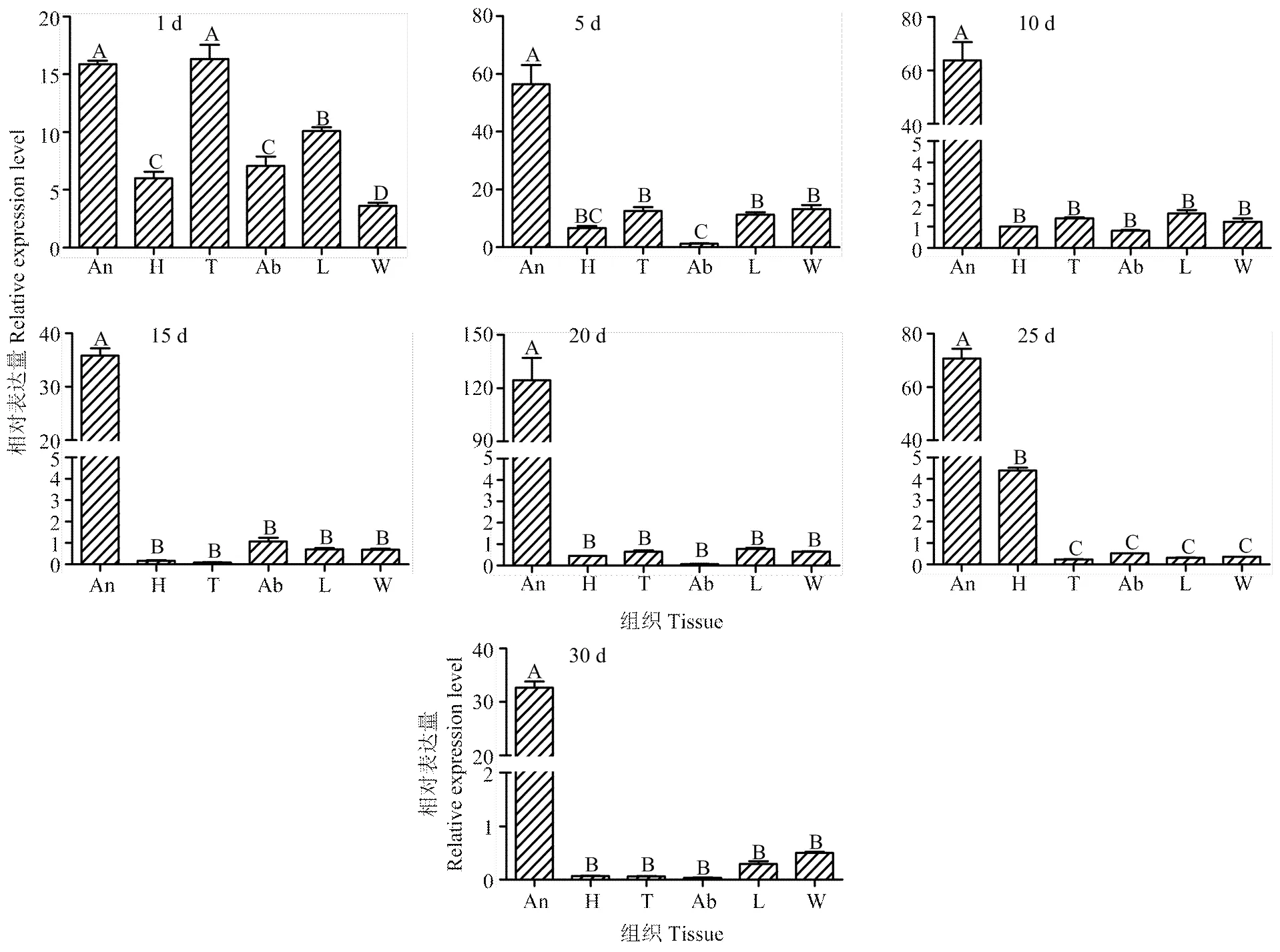
图中数据是以10日龄工蜂的头部表达量作为基准Data in graph were based on the expression in the head of 10-day-old workers。An:触角Antenna;H:头Head;T:胸Thorax;Ab:腹Abdomen;L:足Legs;W:翅Wings;1—30 d:成年工蜂的日龄Days of adult worker bees。柱上不同大写字母表示成蜂同一日龄不同组织间的表达量差异极显著(P<0.01)Different uppercase letters above bars indicated significant differences in the expression levels in different tissues (P<0.01)
3 讨论
气味结合蛋白在昆虫识别和结合外界气味分子的生化反应过程中具有重要意义[29-31]。本研究通过RT-PCR技术成功克隆了中华蜜蜂cDNA序列,ORF长为408 bp,编码135个氨基酸,预测分子量为15.08 kD,序列中含有保守的半胱氨酸位点,具有气味结合蛋白的典型结构特征,并且N-末端包含一个由16个氨基酸组成的信号肽,与报道的昆虫气味结合蛋白特征基本一致。AcerOBP14只编码4个保守的Cys位点,形成两个二硫键,相比典型OBP亚家族缺少Cys2和Cys5两个保守半胱氨酸位点,属于Minus-C OBP亚家族。OBPs可以传导性信息素信号,称为性信息素结合蛋白(PBPs);也可以传导一般气味信号,称为普通气味结合蛋白(GOBPs)。氨基酸同源序列和系统进化树分析表明,AcerOBP14与西方蜜蜂AmelOBP14和大蜜蜂AdorGOBP56a-like同源性较高,亲缘关系较近,因此推测AcerOBP14可能是与普通气味分子结合的蛋白[27]。
分泌蛋白是指在细胞质的核糖体上合成、分泌到细胞外起作用的一类蛋白质。几乎所有的分泌蛋白都具有信号肽[32],为N端的15—35个氨基酸的疏水性序列,在蛋白的内质网-高尔基体-质膜分泌过程中具有重要作用。信号肽是检测蛋白质是否为分泌蛋白的一个重要指标[33]。AcerOBP14的N-末端包含一个由16个氨基酸组成的信号肽,剪切位点位于16和17位氨基酸之间,这说明AcerOBP14具有分泌蛋白的特征。亚细胞定位软件LocTree 3预测结果显示,AcerOBP14蛋白主要集中在分泌途径上,与上述推断一致。
一般认为在触角中特异性表达的OBPs与昆虫信息素的识别相关,而同时在其他部位也有表达的OBPs与识别普通气味物质有关[34]。本研究荧光定量结果表明,在成年工蜂不同日龄的各个组织中均有表达,这说明AcerOBP14可能属于普通气味结合蛋白,能够有效感受不同的气味物质,这与本研究系统进化树分析的结果相一致。在各组织中的表达量随着日龄的变化而变化,暗示不同日龄的中华蜜蜂对巢内化学物质及外界气味物质的感受和识别是有差异的,在嗅觉系统和社会劳动分工过程中起着重要调节作用。Forêt等[9]研究发现,在意大利蜜蜂幼虫期和成蜂中均有表达,且出房后各日龄的表达量无明显差异,这与表达情况明显不同,笔者认为中华蜜蜂嗅觉灵敏度、抗逆抗螨能力等方面优于西方蜜蜂是引起这种差异的可能原因之一,但也不排除采样时期、巢内外环境等因素的影响[35]。
触角是昆虫嗅觉感器的主要部位[36]。在各组织中均有表达,但在触角中表达量相对较高,推测可能主要行使嗅觉相关功能,但也涉及到更广泛的生理功能。20日龄触角中的表达量极显著高于其他日龄,可能与中华蜜蜂的外出采集行为有关,这时高表达的能更有效地识别和结合外界的气味物质,有助于由内勤蜂转变为外勤蜂后寻找蜜粉源或躲避天敌。蜜蜂的行为是受到某种刺激的结果,一旦某种行为启动,就会相对固定地重复进行[37]。随着日龄的增加和机体的内在变化,在触角中的表达量虽然逐渐减少,但仍能以采集花粉、花蜜和水等活动为主。为了进一步验证在中华蜜蜂嗅觉识别中的作用,尚需获得大量的AcerOBP14蛋白并对其生物学功能做深入的研究。
4 结论
成功克隆了中华蜜蜂气味结合蛋白基因cDNA序列。序列分析表明,AcerOBP14具有PBP-GOBP家族的典型结构,属于Minus-C OBP亚家族,与西方蜜蜂AmelOBP14的亲缘关系最近。时空表达结果显示,在不同日龄工蜂的触角、头、胸、腹、足和翅中均有表达,暗示该蛋白属普通气味结合蛋白GOBP,其在中华蜜蜂中不仅仅局限于嗅觉识别功能,可能还涉及更广泛的生理机制。
References
[1] Carey A F, Carlson J R. Insect olfaction from model systems to disease control., 2011, 108(32): 12987-12995.
[2] Forstner M, Breer H, Krieger J. A receptor and binding protein interplay in the detection of a distinct pheromone component in the silkmoth., 2009, 5(7): 745-757.
[3] Laughlin J D, Ha T S, Jones D N, Smith D P. Activation of pheromone-sensitive neurons is mediated by conformational activation of pheromone-binding protein., 2008, 133(7): 1255-1265.
[4] Zhao H T, Zhao W M, Gao P F, Zhang G X, Jiang Y S. Sequence and expression characterization of an OBP1 gene in the Asian honeybee,(Hymenoptera: Apidae)., 2014, 49(1): 189-196.
[5] Field L M, Pickett J A, Wadhams L J. Molecular studies in insect olfaction., 2000, 9(6): 545-551.
[6] 赵慧婷, 高鹏飞, 张桂贤, 姜玉锁. 蜜蜂嗅觉相关蛋白的研究进展. 应用昆虫学报, 2012, 49(5): 1366-1371.
Zhao H T, Gao P F, Zhang G X, Jiang Y S. Advances in research on honeybee olfactory proteins., 2012, 49(5): 1366-1371. (in Chinese)
[7] 胡颖颖, 徐书法, WUBIE A J, 李薇, 国占宝, 周婷. 昆虫嗅觉相关蛋白及嗅觉识别机理研究概述. 基因组学与应用生物学, 2013, 32(5): 667-676.
Hu Y Y, Xu S F, WUBIE A J, Li W, Guo Z B, Zhou T. Research advance of olfactory proteins and olfactory mechanism in insects., 2013, 32(5): 667-676. (in Chinese)
[8] Hekmat-Scafe D S, Scafe C R, McKinney A J, Tanouye M A. Genome-wide analysis of the odorant-binding protein gene family in., 2002, 12(9): 1357-1369.
[9] Forêt S, Maleszka R. Function and evolution of a gene family encoding odorant binding-like proteins in a social insect, the honey bee ().,2006,16(11): 1404-1413.
[10] Richards S, Gibbs R A, Weinstock G M, Brown S J, Denell R, Beeman R W, Gibbs R, Beeman R W, Brown S J,Bucher G, Friedrich M, Grimmelikhuijzen C J, Klingler M. The genome of the model beetle and pest., 2008, 452(7190): 949-955.
[11] Gong D P, Zhang H J, Zhao P, Xia Q Y, Xiang Z H. The odorant binding protein gene family from the genome of silkworm,., 2009, 10: 332.
[12] Li K M, Yang X B, Xu G Y, Cao Y, Lu B Q, Peng Z Q. Identification of putative odorant binding protein genes in, a parasitoid of coconut leaf beetle () by antennal RNA-Seq analysis., 2015, 467(3): 514-520.
[13] Zhou J J, Huang W, Zhang G A, Pickett J A, Field L M. “Plus-C” odorant-binding protein genes in twospecies and the malaria mosquito., 2004, 327(1): 117-129.
[14] Xu P X, Zwiebel L J, Smith D P. Identification of a distinct family of genes encoding atypical odorant-binding proteins in the malaria vector mosquito,., 2003, 12(6): 549-560.
[15] Zhou J J, Vieira F G, He X L, Smadja C, Liu R, Rozas J, Field L M.Genome annotation and comparative analyses of the odorant-binding proteins and chemosensory proteins in the pea aphid., 2010, 19(Suppl. 2): 113-122.
[16] Vieira F G, Rozas J. Comparative genomics of the odorant-binding and chemosensory protein gene families across the Arthropoda: origin and evolutionary history of the chemosensory system., 2011, 3: 476-490.
[17] Spinelli S, Lagarde A, Iovinella I, Legrand P, Tegoni M, Pelosi P, Cambillau C. Crystal structure ofOBP14, a C-minus odorant-binding protein, and its complexes with odorant molecules., 2012, 42(1): 41-50.
[18] Gong Z J, Zhou W W, Yu H Z, Mao C G, Zhang C X, Cheng J A, Zhu Z R. Cloning, expression and functional analysis of a general odorant-binding protein 2 gene of the rice striped stem borer,(Walker) (Lepidoptera: Pyralidae)., 2009, 18(3): 405-417.
[19] Wang G R, Wu K M, Guo Y Y. Molecular cloning and bacterial expressional of pheromone binding protein in the antennae of(Hübner)., 2004, 57(1): 15-27.
[20] Xu P X, Atkinson R, Jones D N, Smith D P.OBP LUSH is required for activity of pheromone sensitive neurons., 2005, 45(2): 193-200.
[21] Gu S H, Wang S P, Zhang X Y, Wu K M, Guo Y Y, Zhou J J, Zhang Y J. Identification and tissue distribution of odorant binding protein genes in the lucerne plant bug(Goeze)., 2011, 41(4): 254-263.
[22] Li S, Picimbon J F, Ji S D, Kan Y C, Qiao C L, Zhou J J, Pelosi P. Multiple functions of an odorant-binding protein in the mosquito, 2008, 372(3): 464-468.
[23] Li Z Q, Zhang S, Luo J Y, Cui J J, Ma Y, Dong S L. Two minus-C odorant binding proteins fromdisplay higher ligand binding affinity at acidic pH than neutral pH., 2013, 59(3): 263-272.
[24] 钱凯, 冯波, 巫诩亮, 劳冲, 沈幼莲, 杜永钧. 松墨天牛OBP基因和的克隆、序列分析及组织表达谱和原核表达研究. 昆虫学报, 2015, 58(5): 496-506.
Qian K, Feng B, Wu X L, Lao C, Shen Y L, Du Y J. Cloning, sequence analysis, tissue expression profiling and prokaryotic expression of odorant binding protein genesandfrom(Coleoptera: Cerambycidae)., 2015, 58(5): 496-506. (in Chinese)
[25] 李红亮, 高其康, 程家安. 中华蜜蜂信息素结合蛋白ASP1 cDNA的克隆及时空表达. 昆虫学报, 2008, 51(7): 689-693.
Li H L, Gao Q K, Cheng J A. Cloning and spatio-temporal expression of cDNA encoding pheromone binding protein ASP1 in(Hymenoptera: Apidae)., 2008, 51(7): 689-693. (in Chinese)
[26] 吉挺, 沈芳, 梁勤, 吴黎明, 刘振国, 罗岳雄. 中华蜜蜂OBP3基因的克隆、原核表达及组织表达谱. 昆虫学报, 2014, 57(8): 897-904.
Ji T, Shen F, Liang Q, Wu L M, Liu Z G, Luo Y X. Cloning, prokaryotic expression and tissue expression profiling of an OBP3 gene in the Chinese honeybee,(Hymenoptera: Apidae)., 2014, 57(8): 897-904. (in Chinese)
[27] 张林雅. 中华蜜蜂两种嗅觉相关蛋白的基因克隆与功能研究[D]. 杭州: 中国计量学院, 2013.
Zhang L Y. Molecular cloning and functional analysis of two kinds of olfactory related genes in the Chinese honeybee,[D]Hangzhou: China Jiliang University, 2013. (in Chinese)
[28] Goldberg T, Hecht M, Hamp T, Karl T, Yachdav G, Ahmed N, Altermann U, Angerer P, Ansorge S, Balasz K. LocTree3 prediction of localization., 2014, 42: W350-W355.
[29] Park D, Jung J W, Choi B S, Jayakodi M, Lee J, Lim J, Yu Y, Choi Y S, Lee M Y, Park Y, Choi I Y, Yang T J, Edwards O R, Nah G, Kwon H W. Uncovering the novel characteristics of Asian honey bee,, by whole genome sequencing, 2015, 16(1): 1.
[30] Robertson H M, Gadau J, Wanner K W. The insect chemoreceptor superfamily of the parasitoid jewel wasp., 2010, 19(Suppl. 1): 121-136.
[31] Croset V, Rytz R, Cummins S F, Budd A, Brawand D, Kaessmann H, Gibson T J, Benton R. Ancient protostome origin of chemosensory ionotropic glutamate receptors and the evolution of insect taste and olfaction., 2010, 6(8): e1001064.
[32] 赵亚华. 基础分子生物学教程. 2版. 北京: 科学出版社, 2006: 351-355.
Zhao Y H.. Beijing: Science Press, 2006: 351-355. (in Chinese)
[33] 彭佳师, 龚继明. 信号肽与蛋白质的分选转运. 植物生理学报, 2011, 47(1): 9-17.
Peng J S, Gong J M. The mechanisms of protein sorting and translocation regulated by signal peptides., 2011, 47(1): 9-17. (in Chinese)
[34] 谷少华, 张雪莹, 张永军, 吴孔明, 郭予元. 苜蓿盲蝽气味结合蛋白基因的克隆及表达谱分析. 昆虫学报, 2010, 53(5): 487-496.
Gu S H, Zhang X Y, Zhang Y J, Wu K M, Guo Y Y. Cloning and expression pattern analysis of an odorant binding protein gene(Goeze) (Hemiptera: Miridae)., 2010, 53(5): 487-496. (in Chinese)
[35] Tsuruda J M, Harris J W, Bourgeois L, Danka R G, Hunt G J. High-resolution linkage analyses to identify genes that influencesensitive hygiene behavior in honey bees., 2012, 7(11): e48276.
[36] 赵红霞, 曾鑫年, 梁勤, 张学锋, 黄文忠, 陈华生, 罗岳雄. 蜜蜂气味结合蛋白的生化特性、系统进化、表达部位和生理功能研究. 环境昆虫学报, 2015, 37(2): 420-425.
Zhao H X, Zeng X N, Liang Q, Zhang X F, Huang W Z, Chen H S, Luo Y X. Research on honeybee odorant-binding proteins biochemical characteristics, phyletic evolution, expression location and physiological function., 2015, 37(2): 420-425. (in Chinese)
[37] 匡邦郁, 匡海鸥. 蜜蜂生物学. 昆明: 云南科技出版社, 2002: 101-105.
Kuang B Y, Kuang H O.. Kunming: Yunnan Science and Technology Press, 2002: 101-105. (in Chinese)
(责任编辑 岳梅)
Cloning and Expression Analysis of Odorant Binding Protein Genefrom
DU Ya-li1, ZHANG Zhong-yin2, PAN Jian-fang1, WANG Shu-jie1, YANG Shuang1,3, ZHAO Hui-ting4, JIANG Yu-suo1
(1College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, Shanxi;2College of Resources and Environment, Henan Institute of Science and Technology, Xinxiang 453003, Henan;3Sericultural and Apicultural Institute, Yunnan Academy of Agricultural Sciences, Mengzi 661101, Yunnan;4College of Life Science, Shanxi Agricultural University, Taigu 030801, Shanxi)
【Objective】The objective of this study is to clone the cDNA sequence offrom, predict the protein structure, explore its expression profiles in different tissues and at different developmental stages of.., and to provide a fundamental evidence for the future study of the physiological function of this gene.【Method】The full-length cDNA sequence ofwas cloned from the entire tissues ofby RT-PCR and submitted to the GenBank database. Physiochemical properties and structure characteristics of the deduced amino acid sequence were analyzed by multiple bioinformatics methods. Phylogenetic tree between AcerOBP14 and its homologous OBPs from Hymenoptera insects was constructed using neighbor-joining of MEGA5.2.The expression levels ofmRNA in different tissues (antenna, head, thorax, abdomen, legs and wings) at 1, 5, 10, 15, 20, 25 and 30 days were detected by real-time PCR.【Result】The full-length cDNA sequence ofwas obtained (GenBank accession number is KT24648). The open reading frame (ORF) ofis 408 bp, encoding a protein of 135 aa with an estimated molecular weight of 15.08 kD and pI of 5.44. The encoding protein has a signal peptide and no transmembrance structure, possesses a PBP-GOBP superfamily domain between 18-127 residues, exists multiple obviously hydrophobic regions binding liposoluble odorant and contains four conserved cysteins, suggesting that it belongs to the Minus-C OBP subfamily. Subcellular localization results showed that AcerOBP14 was located on the secretory pathway about endoplasmic reticulum, golgi and plasmalemma which belongs to the secretory protein. AcerOBP14 possesses 7-helixs, among which the1-6 belong to the core helixs of classical OBPs and7 is exposed to the surface of protein at the C-terminus. The results of amino acid sequence alignment showed that AcerOBP14 was homologous to AmelOBP14 with 86% amino acid sequence identity, and then had 55% sequence identity with AdorGOBP56a-like. Phylogenetic analysis revealed that AcerOBP14, AmelOBP14, AdorGOBP56a-like, AcerOBP21 and AfloGOBP56d-like belonging to thewere clustered into one group, MrotGOBP56a-like (), MdemGOBP83a-like (), OcorOBP3 (), BterGOBP56d-like () and BimpGOBP56d-like () were clustered into the other group. Besides, the results of real-time PCR showed that thetranscripts were differentially expressed in the antenna, head, thorax, abdomen, legs and wings of the adult workers. The thorax of 1-day-old workers had the highest expression level of, the antenna had the second highest expression level, and both of them were significantly higher than the head, abdomen, legs and wings (<0.01). Moreover, the expression profiles in worker bees at other days were significantly higher in antenna than that in other tissues (<0.01), of which the antenna of 20-day-old workers had the highest expression level. According to the expression profiles ofat different developmental stages, the antenna of workers had the lowest expression level at 1-day-old which was significantly lower than other days (<0.01), increased gradually at 5-day-old and 10-day-old, then decreased suddenly at 15-day-old. The expression level at 20-day-old was significantly higher than other days (<0.01), afterwards, the expression level gradually reduced. Generally, the expression profiles of the head, thorax, abdomen, legs and wings appeared a downward trend with the days of age increasing, and maintained a lower level after decreasing remarkably at 5-day-old.【Conclusion】AcerOBP14 belongs to the Minus-C OBP subfamily with a PBP-GOBP superfamily domain. The results of expression profiling suggested that AcerOBP14 belongs to general odorant binding protein (GOBP) and is involved in not only the olfactory recognition, but also other physiological functions.
;; gene cloning; bioinformatics analysis; temporal-spacial expression
2016-01-30;接受日期:2016-03-11
国家自然科学基金(31272513,31502021)、国家现代农业蜂产业技术体系建设专项资金(cars-45-syz10)
杜亚丽,E-mail:duyali2000@yeah.net。通信作者姜玉锁,Tel:0354-6285990;E-mail:jiangys-001@163.com

