慢性阻塞性肺疾病急性加重期血浆脂联素的变化
朱燕亭 刘璐 蒋昊翔 兀小娟 宋旸 杨岚 李满祥
·论著·
慢性阻塞性肺疾病急性加重期血浆脂联素的变化
朱燕亭刘璐蒋昊翔兀小娟宋旸杨岚李满祥
目的探讨血浆脂联素(ADPN)在慢性阻塞性肺疾病急性加重期和临床缓解期的变化及其临床意义。方法选择西安交通大学第一附属医院呼吸与危重症医学科2012年12月至2014年4月期间收治的慢性阻塞性肺疾病急性加重期患者44例,入院后予以吸氧、抗感染、化痰及平喘等常规治疗。比较治疗前后血浆ADPN的变化,并探讨其与体重指数、肺功能、吸烟状态的相关性。结果慢性阻塞性肺疾病急性加重期患者血浆ADPN水平较临床缓解期显著增高(P=0.005);血浆ADPN水平与体重指数显著负相关(P<0.01);与肺功能指标FEV1/FVC及FEV1%无显著相关性(P>0.05);与吸烟状态密切相关,长期持续吸烟患者血浆ADPN水平高于非吸烟组患者(P<0.05)。结论ADPN在慢性阻塞性肺疾病急性加重期的发生、发展中起重要作用,且可作为评价慢性阻塞性肺疾病患者系统炎症程度的血清学指标;可在一定程度上反映慢性阻塞性肺疾病患者的营养状况。
肺疾病,慢性阻塞性;急性加重;脂联素;血清学指标
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是以不完全可逆性气流受限为特征的慢性炎症性疾病,且其发病率和致死率均较高[1-2]。COPD病因目前认为与香烟烟雾等有害气体或有害颗粒刺激肺部引起异常炎症反应有关[3]。香烟烟雾等刺激引起肺部氧化应激增加,促进白介素(interleukin, IL-8)、肿瘤坏死因子(tumour necrosisfactor, TNF-α)等细胞因子的释放,导致气道慢性炎症的产生;此外中性粒细胞、T淋巴细胞、B淋巴细胞等炎性细胞的活化和聚集亦参与了COPD的发生与发展[4-6]。
慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease, AECOPD)是指在疾病的过程中,短期内咳嗽、咳痰、气短等临床症状突然出现或加重。反复急性加重可使疾病的病死率及经济负担明显增加,并可使肺功能加速下降[7-8]。有研究证实AECOPD患者全身及气道炎症反应增加,多种炎性标记物的表达如IL-6、C反应蛋白(C reactive protein, CRP)等也较稳定期明显增加[8]。
脂联素(adiponectin, ADPN)是具有多种生物学效应的细胞因子,主要由脂肪细胞分泌,参与调节物质代谢、胰岛素抵抗、炎症反应等[10-12]。有研究显示ADPN通过减少炎性细胞因子如白介素-6(interleukin, IL-6)、肿瘤坏死因子α(tumor necrosis factor, TNF-α)的分泌及增加抗炎物质的表达来发挥抗炎症反应和免疫调节作用[13-15]。此外,多项研究证实ADPN与COPD的发生、发展密切相关[16-21]。但该血清学指标在AECOPD时的表达水平、其与COPD患者营养状况、COPD严重程度的关系及吸烟等危险因素对该指标的影响尚未明确。本研究通过检测AECOPD治疗前后血浆ADPN的水平,并探讨其与体重指数(body mass index, BMI)、肺功能指标、吸烟状态的关系,旨在为评估COPD病情发展、严重程度提供新线索。
对象与方法
一、研究对象
选取2012年12月至2014年4月期间我院呼吸与危重症医学科收治的AECOPD患者44例,其中男性35例,平均年龄(66.74±8.37)岁,女性9例,平均年龄(70.00±5.64)岁。诊断均符合2007年中华医学会呼吸病学分会慢性阻塞性肺疾病学组制定的COPD诊断标准。慢性阻塞性肺疾病诊治指南(2007年修订版)中AECOPD定义为患者呼吸系统症状(咳嗽、咳痰、气短等)恶化(超出日常变化范围),并需改变日常基础用药。经住院予以常规对症支持治疗,上述症状较前明显好转,肺部阳性体征基本消失,血常规等检查指标大致恢复正常定义为COPD临床缓解期。本实验遵循西安交通大学医学院伦理学委员会的标准并得到该委员会的批准。所有研究对象均知情同意,相互之间均无血缘关系,排除严重的脑、肾、内分泌、肿瘤以及自身免疫系统疾病,近期均无外科手术史且未使用各种免疫调节剂、糖皮质激素等。
二、 研究方法
1. 标本采集: 所有研究对象共采血2次,分别为入院后24 h内及临床缓解后(即对症治疗10 d后),均抽取晨起空腹静脉血样本,加入乙二胺四乙酸(EDTA)抗凝试管,采血后60 min内离心(以离心半径8 cm,1 000 r/min 离心 15 min),取上清置于-80 ℃冰箱内保存待测。
2. 脂联素测定: 采用酶联免疫双抗体夹心Elisa法测定血清脂联素水平(Human ADPN),试剂盒由上海朗卡生物技术有限公司提供,最低检测浓度小于 0.1 μg/ml,试验过程严格按照说明书操作。
3. 血气分析: 所有研究对象均于入院当天在桡动脉抽取动脉血行血气分析检查,部分病情严重者在吸氧条件下抽取,用RADIOMETER ABL800多参数血气分析仪进行检测。
4. 肺功能测定: 所有研究对象均于临床缓解后(即对症治疗10 d后)行肺功能检查(仪型号:MasterScreen,德国),测定第1 s用力呼气量占预计值百分比(FEV1/预计值%)、肺活量占预计值百分比(FVC/预计值%)、FEV1/FVC%等。
三、统计学方法
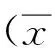
结 果
一、研究对象基线资料
44例AECOPD患者中男性35例,女性9例,平均年龄(67.3±8.1)岁。所有患者基线资料见表1。

表1 研究对象基线资料
注:BMI:体重指数;FEV1:第1秒用力呼气容积;FVC:用力肺活量;PaO2:动脉血氧分压;1 mmHg=0.133 kPa
二、AECOPD治疗前后的ADPN水平
AECOPD患者治疗前血浆ADPN水平为(11.17±4.40)μg/ml,其中女性(13.53±1.00)μg/ml,男性(10.61±4.70)μg/ml(P=0.029)。住院平均治疗(10.42±4.21)d后临床症状缓解,血浆ADPN水平降至(8.58±3.76)μg/ml(P=0.005),其中女性(10.15±2.32)μg/ml,男性(7.98±4.15)μg/ml(P=0.085),见表2。

表2 AECOPD患者治疗前后血浆ADPN水平
注:ADPN:脂联素;Acute exacerbation:急性加重期;Convalescence:临床缓解期
三、AECOPD患者血浆ADPN与BMI的关系
AECOPD患者血浆ADPN与反应机体营养状况指标 BMI呈负相关(r=-0.469,P=0.003),见图1。

图1AECOPD患者血浆ADPN与BMI的相关分析
四、COPD患者ADPN与肺功能的关系
患者临床缓解后,进行肺功能检查,相关性分析显示血浆ADPN水平与肺功能指标FEV1/FVC、FEV1%及RV/TLC无显著相关性(P>0.05),见表3。根据肺功能检测结果,对COPD患者病情进行分度,其中轻度: FEV1/预计值( %)≥80%;中度:50%≤FEV1/预计值(%)<80%;重度:30%≤FEV1/预计值(%)<50%;极重度:FEV1/预计值(%)<30%。ADPN水平与COPD严重程度的比较,各组间ADPN水平差异有统计学意义(P=0.034),见表4。其中轻度、中度COPD组的ADPN水平明显低于极重度组,差异有统计学意义(P=0.007;0.039)。

表3 血浆ADPN水平与COPD患者BMI和肺功能指标的
注:FEV1/FVC:第一秒用力呼气量占肺活量百分比;FEV1%:第一秒用力呼气量占预计值百分比;RV/TLC:残气量占肺总量的百分比

表4 COPD严重程度对ADPN水平的影响
注:ADPN:脂联素
五、AECOPD患者ADPN水平与吸烟状态的关系
按照吸烟史将研究对象分为三组:非吸烟患者15例,已戒烟(戒烟至少1年)9例,持续吸烟20例。三组患者治疗前后血浆ADPN水平无显著差异(P>0.05),见表5,但非吸烟组患者经治疗临床缓解后血浆ADPN水平低于持续吸烟组,差异有统计学意义(P=0.036)。
讨 论
AECOPD时大量炎性细胞在气道聚集,释放多种炎性介质导致气道炎症进一步加重,大量炎性介质释放入血引起系统性炎症恶化[22-25]。本研究发现AECOPD患者血浆ADPN水平较临床缓解期升高(P<0.05),与Xie和Krommidas的研究结果一致[21,26]。Xie等[26]的研究发现AECOPD患者血浆ADPN水平是痰液中的2.85倍,稳定期COPD患者其血浆浓度为痰液的3.03倍。因此,ADPN可作为一种新型血清学指标,反映COPD系统炎症反应的程度。 AECOPD患者血浆ADPN水平增高可能是由于炎症因子刺激脂肪细胞合成并释放大量ADPN。此外,本研究还发现女性AECOPD患者血浆ADPN水平高于男性,这可能与女性患者体脂水平较高有关。

表5 吸烟对血浆ADPN水平的影响
注:Acute exacerbation急性加重期;Convalescence 临床缓解期
ADPN作为一种细胞因子,参与了COPD的炎症反应网络。COPD患者血浆ADPN水平较正常人显著增高[18,20,27]。研究证实ADPN具有抗炎和抑制肺气肿发生的生物学功能[28-30],本研究进一步证实AECOPD患者血浆ADPN较临床缓解期增高。提示ADPN在COPD及AECOPD的发生、发展中发挥着一定的作用。AECOPD时,炎症反应进一步增强、炎性细胞及炎性介质增多,导致反应性血浆ADPN增高,发挥抗炎及保护肺功能的作用,然而其保护性作用仍不足以抵抗炎性介质的致炎作用,其确切作用机理尚待进一步研究。
COPD患者24%~60%合并有营养不良[25]。COPD伴营养不良使患者的免疫功能和呼吸肌力量减低,肺功能和生活质量下降,急性加重次数、呼吸衰竭发生率和病死率增加[31-32]。BMI是反映机体营养状况的主要指标。本研究显示AECOPD患者血浆ADPN水平与BMI呈负相关,与Tomoda和Yazdani的研究结果一致[18,33]。提示COPD患者血浆ADPN水平可能与机体的营养状况存在密切关系。临床可依据血浆ADPN水平,并结合其他营养指标如皮脂厚度、血浆白蛋白和转铁蛋白、外周血淋巴细胞等来衡量COPD患者的营养状况。
AECOPD经治疗临床缓解后行肺功能检查,发现血浆ADPN水平与肺功能指标FEV1/FVC、FEV1%预计值及RV/TLC等之间无明显的相关性,但亚组研究发现极重度COPD患者血浆ADPN水平高于轻度及中度患者,差异有统计学意义,故尚不能完全明确ADPN与COPD病情严重程度的关系。有研究发现ADPN基因缺陷型小鼠更易产生肺气肿[28];另一研究也显示血浆ADPN水平与RV%预计值呈显著正相关[18],提示血浆ADPN水平可能与肺过度充气有关。
吸烟是COPD的首要危险因素,香烟烟雾刺激引起肺部氧化应激增加,导致气道慢性炎症,是COPD发生、发展的重要病理生理机制。本研究发现在临床缓解期持续吸烟的COPD患者血浆ADPN水平高于非吸烟组患者。提示吸烟可能加重气道炎症反应,促进机体ADPN的合成与释放。但其具体的作用机制有待进一步研究。
本研究因条件所限仅检测了AECOPD治疗前后血浆ADPN水平,未检测AECOPD治疗后4周趋于稳定期的水平;此外,本研究仅分析了血浆ADPN与BMI的相关性,未与其他营养指标进行相关性的分析,故血浆ADPN评估COPD患者营养状况的依据尚待进一步研究。
综上所述,本研究发现AECOPD患者血浆ADPN水平较临床缓解期显著增高;血浆ADPN水平与BMI显著负相关;并与吸烟状态存在密切关系,长期持续吸烟患者血浆ADPN水平增高。这些结果提示,ADPN可作为COPD急性发作的炎性标志物,且可评价COPD患者系统炎症的程度;亦可在一定程度上反映COPD患者的营养状况。
1Murray CJ, Atkinson C, Bhalla K, et al. The state of US health, 1990-2010: burden of diseases, injuries, and risk factors[J]. JAMA, 2013, 310(6): 591-608.
2任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志:电子版,2009, 2(2):104-115.
3中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013年修订版)[J]. 中华结核和呼吸杂志,2013, 36(4):255-264.
4Barmes PJ. Emerging pharmacotherapies for COPD [J]. Chest, 2008,134(6): 1278-1286.
5John G, Kohse K, Orasche J, et al. The composition of cigarette smoke determines inflammatory cell recruitment to the lung in COPD mouse models[J]. Clin Sci(Lond), 2014, 126(3): 207-221.
6钱频, 钱桂生. 老年人慢性阻塞性肺疾病的诊断与治疗[J/CD]. 中华肺部疾病杂志:电子版, 2013, 6(2):103-105.
7John-Schuster G, Hager K, Conlon TM, et al. Cigarette smoke-induced iBALT mediates macrophage activation in a B cell-dependent manner in COPD[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 307(9): L692-L706.
8Celli BR, Barnes PJ. Exacerbations of chronic obstructive pulmonary disease[J]. Eur Respir J, 2007, 29(6): 1224-1238.
9Hurst JR, Vestbo J, Anzueto A, et al. Susceptibility to exacerbation in chronic obstructive pulmonary disease[J]. N Engl J Med, 2010, 363(12): 1128-1138.
10Tilg H, Moschen AR. Adipocytokines: mediators linking adipose tissue, in ammation and immunity [J]. Nat Rev Immunol, 2006, 6(10): 772-783.
11Matsuzawa Y, Funahashi T, Kihara S, et al. Adiponectin and metabolic syndrome [J]. Arterioscler Thromb Vasc Biol , 2004, 24(1): 29-33.
12Sethi JK, Vidal-puig AJ. Adipose tissue function and plasticity orchestrate nutritional adaptation [J]. J Lipid Res, 2007, 48(6): 1253-1262.
13Schäffler A, Müller-Ladner U, Schölmerich J, et al. Role of adipose tissue as an inflammatory organ in human diseases[J]. Endocr Rev, 2006, 27(5): 449-467.
14Tsuchihashi H, Yamamoto H, Maeda K, et al. Circulating concentrations of adiponectin, an endogenous lipopolysaccharide neutralizing protein, decrease in rats with polymicrobial sepsis [J]. J Surg Res, 2006, 134(2): 348-353.
15Ouchi N, Walsh K. Adiponectin Adiponectin as an anti-inflammatory
factor [J]. Clin Chim Acta, 2007, 380(1-2): 24-30.
16Kirdar S, Serter M, Ceylan E, et al. Adiponectin as a biomarker of systemic inflammatory response in smoker patients with stable and exacerbation phases of chronic obstructive pulmonary disease [J]. Scand J Clin Lab Invest, 2009, 69 (2): 219-224.
17Miller M, Pham A, Cho JY, et al. Adiponectin-deficient mice are protected against tobacco induced inflammation and increased emphysema [J]. Am J Physiol Lung Cell Mol Physiol, 2010, 299 (6): L834- L842.
18Tomoda K, Yoshikawa M, Itoh T, et al. Elevated circulating plasma adiponectin in underweight patients with COPD [J]. Chest, 2007, 132 (1): 135-140.
19Miller M, Cho JY, Pham A, et al. Adiponectin and functional adiponectin receptor 1 are expressed by airway epithelial cells in chronic obstructivepulmonary disease[J]. J Immunol, 2009, 182(1): 684-691.
20Chan KH, Yeung SC, Yao TJ, et al. Elevated plasma adiponectin levels in patients with chronic obstructive pulmonary disease[J]. Int J Tuberc Lung Dis, 2010, 14(9): 1193-1200.
21Krommidas G, Kostikas K, Papatheodorou G, et al. Plasma leptin and adiponectin in COPD exacerbations: associations with inflammatory biomarkers[J]. Respir Med, 2010, 104(1): 40-46.
22Barnes PJ. Cellular and molecular mechanisms of chronic obstructive pulmonary disease[J]. Clin Chest Med, 2014, 35(1): 71-86.
23Kersul AL, Iglesias A, Ríos, et al. Molecular mechanisms of inflammation during exacerbations of chronic obstructive pulmonary disease [J]. Arch Bronconeumol, 2011, 47(4): 176-183.
24Macnee W. Pathogenesis of chronic obstructive pulmonary disease[J]. Clin Chest Med, 2007, 28(3): 479-513.
25Sevenoaks MJ, Stockley RA. Chronic Obstructive Pulmoary Disease, inflammation and co-morbidity a common inflammatory phenotype? [J] . Respir Res, 2006, 7: 70.
26Xie J, Yang XY, Shi JD, et al. A new inflammation marker of chronic obstructive pulmonary disease-adiponectin [J]. World J Emerg Med, 2010, 1(3): 190-195.
27Uzum AK, Aydin MM, Tutuncu Y, et al. Serum ghrelin and adiponectin
levels are increased but serum leptin level is unchanged in low weight COPD patients[J]. Eur J Intern Med, 2014, 25(4): 364-369.
28Ohashi K, Parker JL, Ouchi N, et al. Adiponectin promotes macrophage polarization toward an anti-inflammatory phenotype[J]. J Biol Chem, 2010, 285(9): 6153-6160.
29Nakanishi K, Takeda Y, Tetsumoto S, et al. Involvement of endothelial apoptosis underlying chronic obstructive pulmonary disease-like phenotype in adiponectin-null mice: implications for therapy[J]. Am J Respir Crit Care Med, 2011, 183(9): 1164-1175.
30Summer R, Little FF, Ouchi N, et al. Alveolar macrophage activation and an emphysema-like phenotype in adiponectin-deficient mice[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(6): L1035-L1042.
31熊曙光, 王慧, 周玲, 等. 不同营养状态下慢性阻塞性肺疾病患者临床特征分析[J/CD]. 中华肺部疾病杂志:电子版, 2012, 5(1): 11-16.
32郭韶梅, 王爱平, 蔡金莲, 等. 老年COPD急性加重期患者免疫及营养状况临床分析[J]. 实用临床医学, 2006, 12(7): 75-76.
33Yazdani R, Gholamrezapour M, Hassanaghaei T, et al. Adiponectin Level in Serum and BAL Sample of Patients with Chronic Obstructive Pulmonary Disease[J]. Tanaffos, 2013, 12 (3): 53-57.
(本文编辑:黄红稷)
朱燕亭,刘璐,蒋昊翔,等. 慢性阻塞性肺疾病急性加重期血浆脂联素的变化[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(4): 386-390.
Changes of plasma adiponectin and its clinical significance during acute exacerbation of chronic obstructive pulmonary disease
ZhuYanting,LiuLu,JiangHaoxiang,WuXiaojuan,SongYang,YangLan,LiManxiang.
InstitutionofRespiratoryandCriticalCareMedicine,theFirstAffiliatedHospital,Xi'anJiaotongUniversity,Xi′an710061,China
LiManxiang,Email:manxiangli@hotmail.com
ObjectiveTo examine the changes of plasma levels of adiponectin (ADPN) in patients with acute exacerbation of chronic obstructive pulmonary disease (AECOPD) before and after effective treatment, and to explore the correlation between ADPN level and clinical characteristics. MethodsA total of 44 patients with AECOPD were enrolled in the study from December 2012 to April 2014 and given effective treatments including continuous low flow oxygen, antibiotics, antitussive, expectorant, antiasthma and other conventional treatments. Plasma level of ADPN was measured in patients with AECOPD and convalescence phase of COPD. The correlations were determined between ADPN level and body mass index, pulmonary function, smoking status. ResultsThe plasma concentrations of ADPN in AECOPD was significantly higher than that in its convalescence phase (P=0.005), and was significantly negatively correlated with BMI(P<0.01). However, the correlation between plasma ADPN level and pulmonary function (FEV1/FVC and FEV1%) was not significant (P>0.05). The plasma concentration of ADPN in COPD patients with continued smoking was higher than that of COPD patients with non-smoking (P<0.05). Conclusionsadiponectin, a new serum biomarker, plays an important role in the pathogenesis of AECOPD, which could estimate the extent of systemic inflammation of COPD, and also may reflect the nutritional status of COPD patients.
Chronic obstructive pulmonary disease;Acute exacerbations;Adiponectin;Serum biomarker
10.3877/cma.j.issn.1674-6902.2016.04.007
国家自然科学基金资助项目(81330002)
710061 西安,西安交通大学第一附属医院
呼吸与危重症医学科
李满祥,Email: manxiangli@hotmail.com
R563
A
2015-06-23)

