血清肿瘤标志物在慢性阻塞性肺病中的临床意义
刘源源 方申存
·论著·
血清肿瘤标志物在慢性阻塞性肺病中的临床意义
刘源源1方申存2
目的探讨血清中肿瘤标志物在慢性阻塞性肺疾病(COPD)中的含量及临床意义。方法选取COPD患者和健康志愿者各60例,采用化学免疫发光法检测血清和肺泡灌洗液中癌胚抗原(CEA), 细胞角蛋白19(CYFRA21-1),神经元特异性烯醇化酶(NSE),癌抗原125(CA125)和糖类抗原199(CA19-9)的含量;ELISA法检测血清中C反应蛋白(CRP)含量;并分析血清中增高的肿瘤标志物与COPD分级、肺功能、血气分析及CRP的相关性;比较抗炎治疗前后COPD患者血清肿瘤标志物的变化。结果血清CA125和CA19-9水平在COPD组中明显高于健康对照组(P<0.05);血清CA125和CA19-9的水平随着COPD严重程度分级的增加而增高(P<0.05);抗炎治疗后血清CA125较治疗前明显下降(P<0.05)。COPD患者血清中CA125和CA19-9的水平与肺功能参数(FEV1,%pre和FEV1/FVC)和氧分压呈负相关,血清中CA125与血清CRP呈正相关(P<0.05)。COPD患者肺泡灌洗液中CA125和CA19-9的含量明显高于血清中的含量(P<0.05)。结论COPD患者血清中CA125 和CA19-9的水平明显增高,通过检测血清CA125 和CA19-9的水平可以预测COPD病情的严重程度。
肺疾病,慢性阻塞性;肿瘤标志物;糖类抗原125;糖类抗原19-9
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种以气流受限为特征的可以预防和治疗的疾病,气流受限不完全可逆、呈进行性发展[1-2]。慢性炎症是造成COPD经久不愈和进行性加重的重要因素[3]。近年研究发现,多种血清肿瘤标志物如糖类抗原19-9(carbohydrate antigen-19-9, CA19-9)和糖类抗原125(carbohydrate antigen-125, CA125)与慢性炎症密切相关[4-6]。但血清肿瘤标志物与慢性阻塞性肺病发生、发展是否具有相关性,目前尚未有文献报道。本研究通过检测60例COPD患者血清中的肿瘤标志物,以探讨血清肿瘤标志物与COPD的关系。
资料与方法
一、临床资料
选取2013年6月至2015年2月期间在南京市胸科医院门诊和住院治疗的COPD患者共60例,其诊断均符合中华医学会呼吸病学分会所制订的《慢性阻塞性肺疾病诊治指南(2013年修订版)》诊断标准,排除恶性肿瘤及其他严重心、肝、肾等脏器重要疾病[7]。其中男35例, 女25例,年龄 50~85岁, 平均年龄(65.2±8.45)岁。同时选取同期在南京市胸科医院体检的健康志愿者60例作为对照组,其纳入标准为:无呼吸道症状和心肺疾病,既往健康,近3个月无感染病史,肺功能检查无气流受限。其中男33例, 女27例,年龄 43~73 岁, 平均年龄(58.9±9.25)岁。两组患者在性别、年龄和吸烟史均无统计学差异。本研究通过南京市胸科医院伦理委员会批准, 入选的所有对象均签署知情同意书。
二、研究方法
1. 血清及肺泡灌洗液的收集: 血清收集,空腹抽取静脉血3 ml,以离心半径8 cm 5 000 r/min离心5 min,分离血清,于-80 ℃冰箱中保存,集中检测。支气管肺泡灌洗液(bronchoalveolarlavage fluid, BALF)收集:随机选择28例COPD患者行纤维支气管镜下肺泡灌洗术。纤维支气管镜进入亚段支气管水平,每次用20 ml生理盐水反复灌洗,灌洗总量低于150 ml,灌洗液回收率在40%~60%,以离心半径8 cm 5 000 r/min离心5 min,分离上清液,取上清1 ml于-80 ℃冰箱中保存备用,集中检测。
2. 血清肿瘤标志物及CRP检测: 所有血清样本恢复至室温后以ELISA方法检测血清C反应蛋白(C reactive protein, CRP)水平;采用化学免疫发光法测定血清和BALF中癌胚抗原(carcino embryonie antigen, CEA), 细胞角蛋白19(cytokeratin 19 fragment, CYFRA21-1), 神经元特异性烯醇化酶(neuron-specific enolase, NSE), CA125和CA19-9肿瘤标志物,用雅培12000仪测定,检测试剂盒均购于上海数康生物科技有限公司。血清中肿瘤标志物的截断值分别为:CEA(0~8 ng/ml), CYFRA21-1(0~3 ng/ml), NSE(0~30 ng/ml),CA125(0~35 U/ml) 和CA19-9(0~37 U/ml)。
3. 肺功能检测: 所有研究者测定前12 h 内停用β受体激动剂、茶碱等支气管扩张药物,用长效制剂者需停用48 h 。使用美国 Sensor-medics 公司的肺功能仪进行肺功能检测,分别检测患者用力肺活量(FVC)、第1 s用力呼出量(FEV1)、第1 s用力呼出量与用力肺活量比(FEV1/FVC)。
4. 血气分析: 静卧不吸氧或停止吸氧30 min后,采集挠动脉或股动脉血l ml。血标本严格隔绝空气并在20 min内送检。用丹麦雷度血气分析仪(BJ05-400)检测PaO2、PaCO2等指标 。
三、统计学方法
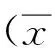
结 果
一、两组临床资料特征的比较
COPD组与健康对照组在性别、年龄及吸烟状况均无明显统计学差异(P>0.05)。COPD组患者血清炎症指标CRP明显高于健康对照组,而肺功能指标(FEV1,%pre和FEV1/FVC)和氧分压显著降低(P<0.05)。两组血清肿瘤标志物的比较,血清CA125和CA19-9水平COPD组明显高于健康对照组(P<0.05),见表1。

表1 COPD组与健康对照组临床资料特征比较
注:CRP: C反应蛋白;CEA: 癌胚抗原;NSE: 神经元特异性烯醇化酶; CYFRA21-1: 细胞角蛋白19; CA125: 糖类抗原125; CA19-9: 糖类抗原19-9
二、不同分级COPD患者血清肿瘤标志物的差异
对不同严重程度分级COPD患者的血清肿瘤标志物进行比较发现,随着严重程度分级的增加,COPD患者血清中CA125和CA19-9的水平也随之增高(P<0.05)。但是血清CEA、NSE和CYFRA21-1的水平与COPD严重程度分级无明显相关性(P>0.05),见表2。
三、 COPD患者血清肿瘤标志物与肺功能、血气分析及CRP相关性分析
为进一步研究COPD患者血清肿瘤标志物是否与COPD疾病严重程度相关,本实验通过相关性分析比较肿瘤标志物与肺功能、血气分析和CRP的相关性。COPD患者血清中CA125和CA19-9的水平与肺功能参数(FEV1,%pre和FEV1/FVC)和氧分压呈负相关。其中血清中CA125与血清CRP呈正相关,而血清中CA19-9与CRP无明显相关性,见表3,图1。

表3 肿瘤标志物与肺功能、血气分析及CRP相关性分析
注:CRP: C反应蛋白; CA125: 糖类抗原125; CA19-9: 糖类抗原19-9
四 COPD患者治疗前后血清CA125和CA19-9的变化
为进一步比较COPD患者抗炎治疗后血清CA125和CA19-9的变化,选择10例COPD急性加重的住院患者,在抗炎治疗10 d前后查血清CA125和CA19-9水平。抗炎治疗后血清CA125较治疗前明显下降(P<0.05),而血清CA19-9水平治疗前后无明显变化(P>0.05),见图2。

图1肿瘤标志物与肺功能及CRP相关性分析
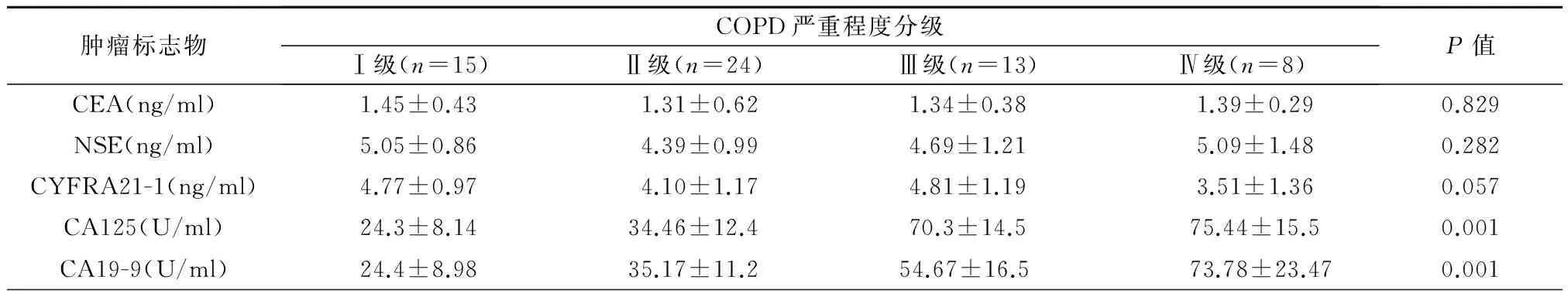
表2 肿瘤标志物与COPD严重程度分级相关性比较
注:CRP: C反应蛋白;CEA: 癌胚抗原;NSE: 神经元特异性烯醇化酶; CYFRA21-1: 细胞角蛋白19; CA125: 糖类抗原125; CA19-9: 糖类抗原19-9


图2COPD患者治疗前后血清CA125和CA19-9的变化
五、COPD患者肺泡灌洗液及血清中CA125及CA19-9含量比较
为了比较COPD患者肺泡灌洗液和血清中CA125及CA19-9含量的差异,本研究选择了28例COPD患者进行纤维支气管镜下肺灌洗。肺泡灌洗液和血清中CA125的含量分别为:94.2±18.3和45.4±15.5,肺泡灌洗液和血清中CA19-9的含量分别为:72.6±10.4和36.3±8.3。肺泡灌洗液中CA125和CA19-9的含量明显高于其在血清中的含量(P<0.05),见图3。

图3COPD患者BALF及血清中的CA125及CA19-9含量
讨 论
血清肿瘤标志物(CEA, CYFRA21-1, NSE,CA125 和CA19-9)是临床上常用来筛查肿瘤或监测肿瘤复发和转移的常用指标。但是近年研究发现,上述血清肿瘤标志物在良性肺部疾病中也显著增高。例如,血清CA125和NSE在矽肺患者中明显增高,而且与矽肺肺纤维化的严重程度明显相关[8]。血清CA125与肺结核发生、发展明显相关,通过抗结核治疗后血清CA125可显著下降[9]。肺泡蛋白沉积症患者血清中CEA和NSE的水平能够预测疾病的严重程度和大容量肺灌洗的治疗效果[10]。但增高的血清肿瘤标志物在COPD中是否具有相关临床意义,目前尚无定论。本项研究发现, CA125 和CA19-9在COPD患者血清中明显增高,且与COPD的分级、肺功能参数及氧分压明显相关。Marechal等[11]研究发现,血清CA125在COPD患者中明显高于健康志愿者,但未进一步分析其增高的临床意义。而 Bulut等[12]研究表明,血清中CA125 和CA19-9水平在重度COPD患者中明显高于轻、中度患者。上述发现均与本项研究结果相一致。可见,通过检测COPD患者血清CA125 和CA19-9的水平对于预测疾病的严重程度具有一定的临床意义。
CA125 和CA19-9在COPD患者血清中含量增高的机制目前尚不清楚。CA125在组织中主要分布于子宫内膜、宫颈黏膜、间皮组织、支气管上皮及支气管黏膜下腺等组织,上述组织合成释放少量的CA125在血清中维持低表达量[13]。当上述组织受到肿瘤或炎症等因素刺激时,其合成和表达CA125功能明显增强,进而释放入血,导至CA125在血清中的含量增加[13]。COPD患者血清中CA125含量增高的可能原因为:①COPD是一个慢性炎症过程,以气道、肺实质和肺血管的慢性炎症为特征,炎症介质可诱导支气管上皮和支气管黏膜下腺增生[14],增生的支气管上皮和支气管黏膜下腺可合成和释放大量CA125;②慢性炎症刺激可导致肺血管内皮细胞通透性增加,致使肺内合成的CA125大量进入循环系统[15];③COPD可引起全身的并发症,其中肺动脉高压和右心衰竭是最为常见。最近研究发现,肺动脉高压和右心衰竭均可刺激内脏间皮细胞大量分泌CA125也可导致血清CA125含量增高[16]。可见,慢性炎症刺激可能是导致COPD患者血清CA125增高的关键原因。本研究结果发现CA125与炎症标志物CRP明显正相关,且抗炎治疗后CA125可显著下降,进一步证实炎症反应在COPD患者血清CA125增高中发挥着重要作用。
CA19-9主要分布于消化道上皮细胞,其中支气管上皮细胞也可少量表达,正常情况下血清中CA19-9含量甚微。近年研究报道,特发性肺纤维化[17]、支气管扩张[18]及间质性肺病[19]等良性肺病患者血清中CA19-9含量明显增高,且与疾病的严重程度明显相关。通过对肺活检组织的免疫组化研究证实,CA19-9主要来源于支气管上皮,其血清含量增高反映了支气管上皮细胞的增殖和分泌功能的增强[17]。COPD患者的支气管上皮细胞长期反复受炎症刺激,出现过度增殖致CA19-9合成和释放增加,这可能是血清中CA19-9的主要来源。本研究发现BALF中CA19-9含量高于血清也进一步佐证了上述推测。
由此可见,COPD患者血清中CA125和CA19-9含量明显高于健康志愿者,其含量的增高与COPD分级、肺功能参数及氧分压明显相关。通过检测COPD患者血清中CA125 和CA19-9的水平可以预测疾病的严重程度。
1任成山, 钱桂生. 慢性阻塞性肺疾病发病机制研究现状与展望[J/CD]. 中华肺部疾病杂志:电子版,2009, 2(2):104-115.
2钱频, 钱桂生. 老年人慢性阻塞性肺疾病的诊断与治疗[J/CD]. 中华肺部疾病杂志:电子版,2013, 6(2):103-105.
3张永红, 谢新明, 李满祥. 慢性阻塞性肺疾病生物学标志物的研究进展[J/CD]. 中华肺病疾病杂志: 电子版, 2013, 6(3): 284-288.
4Gronowitz E, Pitkänen S, Kjellmer I, et al. Association between serum oncofetal antigens CA 19-9 and CA 125 and clinical status in patients with cystic fibrosis[J]. Acta Paediatr, 2003, 92(11): 1267-1271.
5Yang Z, Liang Y, Li C, et al. Serum CA125 elevation is independently associated with serositis in SLE patients[J]. Clin Exp Rheumatol, 2012, 30(1): 93-98.
6冯恩志, 杨生岳, 黄宁侠. 血液生物标志物对慢性阻塞性肺疾病临床应用价值的研究进展[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(3): 334-336.
7中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013年修订版)[J]. 中华结核和呼吸杂志, 2013, 36(4): 255-260.
8Fang SC, Zhang HT, Wang CY, et al. Serum CA125 and NSE: biomarkers of disease severity in patients with silicosis[J]. Clin Chim Acta, 2014, 433(23): 123-127.
9Kim ES, Park KU, Song J, et al. The clinical significance of CA-125 in pulmonary tuberculosis[J]. Tuberculosis (Edinb), 2013, 93(2): 222-226.
10Fang SC, Lu KH, Wang CY, et al. Elevated tumor markers in patients with pulmonary alveolar proteinosis[J]. Clin Chem Lab Med, 2013, 51(7): 1493-1498.
11Marechal F, Berthiot G, Deltour G. Serum levels of CA-50, CA-19.9, CA-125, CA-15.3, enolase and carcino-embryonic antigen in non neoplastic diseases of the lung[J]. Anticancer Res, 1988, 8(4): 677-680.
12Bulut I, Arbak P, Coskun A, et al. Comparison of serum CA 19.9, CA 125 and CEA levels with severity of chronic obstructive pulmonary disease[J]. Med Princ Pract, 2009, 18(4): 289-293.
13Choi WI, Qama D, Lee MY, et al. Pleural cancer antigen-125 levels in benign and malignant pleural effusions[J]. Int J Tuberc Lung Dis, 2013, 17(5): 693-697.
14Herfs M, Hubert P, Poirrier AL, et al. Proinflammatory cytokines induce bronchial hyperplasia and squamous metaplasia in smokers: implications for chronic obstructive pulmonary disease therapy[J]. Am J Respir Cell Mol Biol, 2012, 47(1): 67-79.
15Barouchos N, Papazafiropoulou A, Iacovidou N, et al. Comparison of tumor markers and inflammatory biomarkers in chronic obstructive pulmonary disease (COPD) exacerbations[J]. Scand J Clin Lab Invest, 2015, 75(2): 126-132.
16Rahimi-Rad MH, Rahimi P, Rahimi B, et al. Serum CA-125 level in patients with chronic obstructive pulmonary disease with and without pulmonary hypertension[J]. Pneumologia, 2014, 63(3): 164-166.
17Rusanov V, Kramer MR, Raviv Y, et al. The significance of elevated tumor markers among patients with idiopathic pulmonary fibrosis before and after lung transplantation[J]. Chest, 2012, 141(4): 1047-1054.
18Yango J, Pieters T, Coche E, et al. Increased serum CA 19.9 in bronchiectasis[J]. Rev Mal Respir, 2008, 25(1): 78-81.
19Dai H, Liu J, Liang L, et al. Increased lung cancer risk in patients with interstitial lung disease and elevated CEA and CA125 serum tumour markers[J]. Respirology, 2014, 19(5): 707-713.
(本文编辑:黄红稷)
刘源源,方申存. 血清肿瘤标志物在慢性阻塞性肺病中的临床意义[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(4): 391-395.
Clinical significance of elevated serum tumor markers in patients with chronic obstructive pulmonary disease
LiuYuanyuan,FangShencun.
EmergencyDepartment,NanjingChestHospital,Nanjing210029,China
FangShencun,Email:fang1984@aliyun.com
ObjectiveTo investigate the clinical significance of tumor markers in patients with chronic obstructive pulmonary disease(COPD). MethodsA total of 60 patients with COPD were included in the study, and 60 healthy volunteers were recruited as the control group. Tumor marker levels in BALF and serum, including carcino embryonie antigen(CEA), cytokeratin 19 fragment(CYFRA21-1), neuron-specific enolase(NSE), carbohydrate antigen-125(CA125) and carbohydrate antigen-19-9(CA19-9), were detected by chemical immunization, and CRP was tested by ELISA. Correlation between serum tumor marker levels and severity markers for COPD was analyzed. It was assessed the differences of tumor markers levels before and after anti-inflammatory treatment. ResultsBoth mean serum CA125 and CA19-9 levels were significantly higher in cases compared with controls. Significant positive correlations were found between values of CA125 and CA19-9 and disease severity parameters,including COPD classifications, PaO2, FEV1and FEV1/FVC. Patients with COPD experienced a significant decrease in serum CA125 levels following anti-inflammatory treatment. The CA125 and CA19-9 levels in BALF were significantly higher than those in serum. ConclusionsSerum CA125 and CA19-9 levels would provide valuable clinical information to assess disease severity in COPD.
Chronic obstructive pulmonary disease;Tumor markers;CA125;CA19-9
10.3877/cma.j.issn.1674-6902.2016.04.008
南京市科技计划基金资助项目(201402038)
210029 南京市胸科医院急诊内科1、呼吸内科2
方申存,Email:fang1984@aliyun.com
R734.2
A
2015-07-07)

