葡萄皮多酚的提取、纯化及组成研究
齐 岩,孙金月,程安玮,檀 昕,谢春阳
(1 吉林农业大学食品科学与工程学院,长春 130118; 2 山东省农业科学院农产品研究所,济南 250100;3山东省农产品精深加工技术重点实验室,济南 250100)
葡萄皮多酚的提取、纯化及组成研究
齐岩1,2,孙金月2,3,程安玮2,3,檀昕1,2,谢春阳1
(1吉林农业大学食品科学与工程学院,长春130118;2山东省农业科学院农产品研究所,济南250100;3山东省农产品精深加工技术重点实验室,济南250100)
以巨峰葡萄皮为原料,采用超声波辅助提取法,研究葡萄皮多酚的提取工艺,并用响应面法进行优化,进一步通过HPLC法确定多酚的组成和含量。得出最佳的提取工艺参数为:料液比1∶40、超声时间1.6h、超声功率430W、乙醇浓度33%,提取率为29.16mg/g;AB-8型大孔吸附树脂对葡萄多酚分离效果良好;在葡萄皮酚类物质中确定了10种单体酚,其中主要酚类物质为儿茶素,含量为15.74±0.21μg/mg。
葡萄;多酚;响应面法;HPLC
多酚是植物体内复杂的酚类次生代谢产物,具有多元酚结构,主要存在于植物的皮、根、叶、壳及果肉中[1]。多酚是一种天然抗氧化剂,具有防止慢性炎症、心血管疾病、癌症和糖尿病等功效[2-4]。葡萄是我国种植面积较大的水果,产量约占全世界水果总产量的1/4[5]。葡萄中多酚的含量较高,主要存在于葡萄籽和皮中,果肉中含量很少[6]。葡萄中多酚类物质主要包括花色素、原花色素、黄酮醇类等[7]。目前有关葡萄多酚的研究较多,李凤英等[8]人采用微波辅助提取法对葡萄皮中的酚类物质进行提取;李婷等[9]人采用酶法对葡萄中的白藜芦醇进行了提取;牟京霞[10]对酿酒葡萄中的酚类物质进行了研究,研究表明,表棓儿茶素、儿茶素和表儿茶素均是主要成分。超声波辅助提取法可通过超声波破坏细胞壁,增加溶剂穿透力,从而提高提取率和缩短提取时间。鉴于葡萄在我国产量丰富、使用率高、副产物葡萄皮剩余量大等因素,系统评价其葡萄皮中酚类的生物活性物质对指导其开发利用、实现变废为宝、提高利用率具有重要意义。本文采用超声波辅助萃取法,对葡萄皮中的多酚进行提取纯化,并运用HPLC法测定了多酚的主要组成成分,以期为葡萄皮的利用提供数据支持。
1 材料与方法
1.1试验材料
‘巨峰’葡萄,购买于济南大润发超市,获取其中的葡萄皮,用打浆机打浆,然后冷冻干燥成粉备用。大孔树脂AB-8,购于上海摩速科学有限公司。
1.2试验仪器
AR423CN型电子天平,奥豪斯(上海)仪器有限公司;SB25-12DTD型超声波清洗机,宁波新艺生物科技有限公司;1012503型电热恒温干燥箱,上海精宏实验设备有限公司;RF-5301PC型可见分光光度计,日本岛津公司;DS-1型高速组织捣碎机,上海标本模型厂;FD-1型冷冻干燥机,北京博医康实验仪器有限公司;LXJ-ⅡB型离心机,上海安亭科学仪器厂;SY-2000型旋转蒸发器,上海亚荣生化仪器厂;SHZ-Ⅲ型循环水式多用真空泵,上海亚荣生化仪器厂;SHY-2A型水浴恒温振荡器,江苏金坛市金城国胜实验仪器厂;VORTEX-5型漩涡混合器,海门其林贝尔仪器制造有限公司;1200高效液相色谱仪,美国Agilent;ZORBAXSB-C18色谱柱,美国Agilent。
1.3试验试剂
2N福林试剂(Folinreagent)、标准品没食子酸(gallicacid)Sigma公司;Na2CO3(分析纯)天津市登科化学试剂有限公司;无水乙醇天津市富宇精细化工有限公司。没食子酸、儿茶素、原儿茶酸、绿原酸、咖啡酸、表儿茶素、香豆酸、鞣花酸、芦丁、邻香草酸、槲皮素均来自美国Sigma公司。
1.4葡萄皮多酚提取试验方法
黄浩认为对马克思共产主义的理解存在着价值理性和科学理性两种模式和两个重要维度,其中价值理性是马克思共产主义思想形成的逻辑起点,其核心内容在于对人的本质和价值的揭示;科学理性是马克思共产主义思想的升华,其核心在于揭示社会发展的规律性和共产主义是历史发展的必然过程。马克思共产主义思想的本真内涵是两者的辩证统一。[11]
1.4.1葡萄皮多酚的测定采用Folin-phenol法进行测定[11,12]。取2mL蒸馏水加入200μL福林—酚试剂混匀,加入100μL多酚提取液,吹打均匀后加入20%的Na2CO3溶液900μL,混匀后在暗处放置2h,并在765nm处测定吸光度值A。以没食子酸为标样,在10~500μg/mL范围内制定标准曲线(y=0.0032x+0.0431,R2=0.9924),计算提取液中多酚的含量。
1.4.2葡萄皮多酚提取工艺条件优化称取500mg葡萄皮粉于50mL离心管,每组设置3个平行。设定了提取液浓度、料液比、提取功率、提取时间等4个因素进行单因素试验,以确定最佳提取工艺参数。
1.4.3响应面优化试验在单因素试验的基础上,选取最优的因素和水平进行响应面分析,每组3个平行。应用Box-Behnken中心组合进行三因素三水平的试验设计,以葡萄皮多酚提取量为响应值,进行提取条件的优化。
1.5葡萄皮多酚的纯化
将提取液采用旋转蒸发仪进行浓缩,浓缩到原体积1/7。将树脂进行填充,填充的高度为45cm,将浓缩液上柱进行吸附,流速为6mL/min,上样100mL。上样结束后停止出样,让树脂吸附30min,以便样品能够被树脂完全吸附。吸附结束后用80%的乙醇进行洗脱。将洗脱液再次进行旋蒸浓缩,浓缩到原体积的1/4,冷冻干燥成粉。
1.6葡萄皮多酚的组成分析
多酚组成分析采用HPLC法,按照Amico等的方法进行,并略有改进[13]。检测波长280nm、流速1mL/min、柱温40℃、进样量10μL,以峰面积外标法定量。梯度洗脱:流动相A∶水∶甲酸=9∶1、流动相B∶乙腈∶甲酸=9∶1。梯度洗脱程序:0~5min,95%A;5~45min,95%A-70%A;45~46min,70%A-55%A;46~66min,55%A-45%A;66~67min,45%A-10%A;67~81min,10%A;81~82min,10%A-95%A;82~87min,95%A。
1.7数据统计分析
采用SPSSStatistics17.0对数据进行显著性分析,结果以平均值±标准差表示,P≤0.05为差异有统计学意义,并以Design8.0.5.0进行响应面分析优化。
2 结果与讨论
2.1葡萄皮多酚提取单因素试验
由图1a可以看出,随着乙醇浓度的不断增加,葡萄皮多酚的提取率呈上升趋势;浓度在30%~50%之间,葡萄皮多酚的提取率达最大,并且各组之间没有显著性差异;当浓度达到50%以后,随着乙醇浓度的不断增加,葡萄皮多酚的提取率呈下降趋势,选择20%、30%、40%等3个水平进行响应面分析。
由图1b可以看出,随着料液比的不断增大,在1/20~1/40之间,葡萄皮多酚的提取率不断增加,当达到1/40时,多酚含量基本达到峰值,再随着料液比增大,提取率没有显著的升高。可能是由于溶剂体积的不断增加,使固液两项之间的接粗面积不断增加,有利于多酚化合物的溶出[14]。不会对料液比作为响应面分析因素,并将料液比固定为1/40。
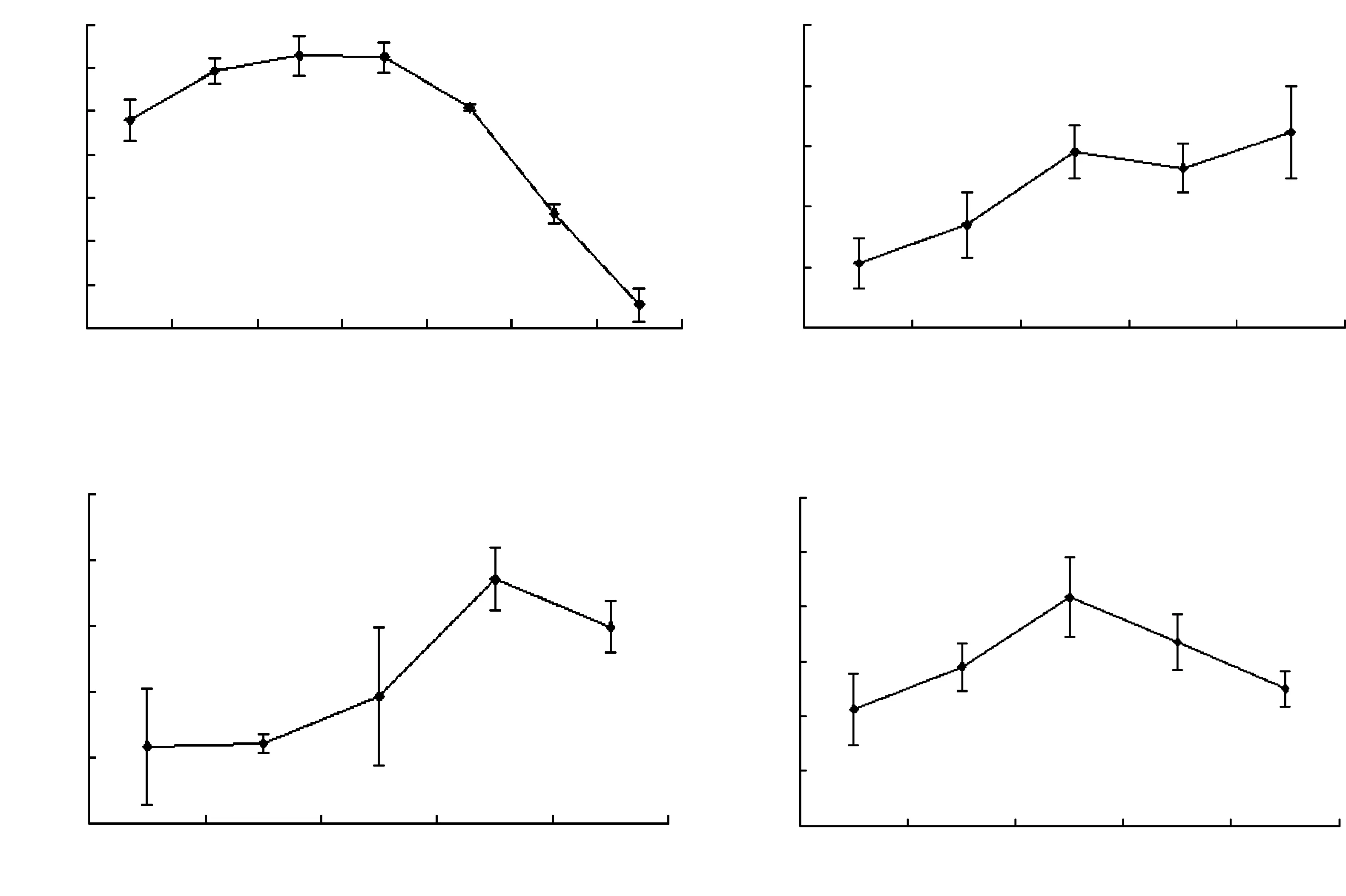
图1 葡萄皮多酚提取单因素试验
由图1c可以看出,在超声功率100~300W范围内,葡萄皮多酚的提取率并没有显著性差异,而后增加超声功率,多酚含量开始增加,当超声功率到达400W时提取率达到了峰值,为27.42±0.96mg/g,选择300、400、500等3个水平进行响应面分析。
由图1d可以看出,随着提取时间的不段增加,葡萄皮多酚的提取含量呈上升趋势,当提取时间为1.5h时到达峰值,为30.33±1.45mg/g;随后随着提取时间的再增加,多酚含量呈下降趋势,选择1、1.5、2等3个水平进行响应面分析。
2.2葡萄皮多酚响应面试验对提取工艺参数优化
2.2.1葡萄皮多酚响应面试验设计
应用Box-Behnken中心组合进行三因素三水平的试验设计,平共17个试验点的响应面分析试验,其中12个为分析试验、5个为中心试验,用来估计试验误差。试验因素及水平安排见表1。根据Design8.0.5.0进行响应面分析优化,结果见表2。并对试验结果进行响应面分析,回归方程和方差分析结果见表3。

表1 响应面分析因素和水平

表2 响应面分析方案与结果

表3 响应面二次模型方差分析结果
注:*P<0.05,影响显著;**P<0.01,影响极显著。
使用Design8.0.5.0进行响应面分析得出葡萄皮多酚提取率回归方程为:
Y=29.36-0.93X1+0.54X2+1.59X3+0.47X1X2+
(1)
(1)式中,X1为超声时间、X2为超声功率、X3为乙醇浓度、Y为葡萄皮多酚提取含量。
由表3可以看出,除了超声时间与超声功率的交互作用不显著外,其他各项之间都具有显著性。回归方差分析显著性检验表明,该模型(P<0.0001)具有高度显著性,该模型的失拟项(P=0.2985>0.05)并不显著,这两者表明该模型的拟合性较好。上述葡萄皮多酚提取率的回归方程的相关系数为R2=0.9834,响应值的变化有96.48%来源于所选因素,即来源于超声时间、超声功率、乙醇浓度,并且3个自变量与响应值(葡萄皮多酚提取率)之间线性关系显著,说明说明模型与实际拟合较好,该实验方法可靠。变异系数C.V.(%)是衡量每个测量平均值偏离真实情况的参数,其值越小,表明重复性越好,该模型的变异系数=2.19,在可接受范围内,说明该模型的重复性良好。通过F值的比较,得出该模型分析得各因素对响应值影响的显著性大小为:乙醇浓度>超声时间>超声功率。
2.2.2葡萄皮多酚响应面结果分析
从图2a中可以看到等高线图呈圆形,图2c、e等高线呈椭圆形,而且图2e椭圆的效果较图2c更为显著,说明超声时间A与超声功率B两者之间的交互作用无显著性,超声时间(A)与乙醇浓度C、超声功率B与C乙醇浓度这两组之间的两两交互作用显著,而且交互作用的显著程度为BC>AC>AB,二次模型方差分析结果一致。并确定最佳的提取工艺为超声时间1.63h、超声功率431.25W、乙醇浓度32.82%、葡萄皮多酚的提取率为30.26mg/g。

图2 三因素的交互作用
从图2b中可以看出,超声时间的曲面较超声功率较陡,说明超声时间与超声功率相比,超声时间对多酚的提取率影响较大,即A>B,这与二次模型方差分析结果一致。从图2d中可以看出,超声时间轴向的等高线较稀疏,说明乙醇浓度较超声时间对多酚的提取率影响较大,即C>A,这与二次模型方差分析结果一致。从图2f中可以看出乙醇浓度的曲面较超声功率较陡,说明乙醇浓度与超声功率相比,乙醇浓度对多酚的提取率影响较大,即C>B;从等高线图中也可以看出,超声功率轴向的等高线较稀疏,说明乙醇浓度较超声功率对多酚的提取率影响较大,即C>B,这与二次模型方差分析结果一致。
2.2.3葡萄皮多酚最佳提取工艺参数验证试验
经响应面分析得,最佳的提取工艺为:料液比1∶40、超声时间1.63h、超声功率431.25W、乙醇浓度32.82%,葡萄皮多酚的提取率为30.26mg/g。在本试验中由于实际条件因素,最终选取超声时间1.6h、超声功率430W、乙醇浓度33%进行验证试验,最终得出葡萄皮多酚的提取率为29.16mg/g,与预测值很接近,所以最终确定以该条件进行葡萄皮多酚的提取。
2.3葡萄多酚HPLC色谱定性及定量分析
葡萄皮多酚的HPLC色谱定性分析见图3,定量分析结果见表4。葡萄皮中含有较多酚类物质,通过和11种标样酚类成分保留时间的对比,确定含有其中的10种,但含量都偏低,除儿茶素含量稍高外其他都在10μg/mg

图3 葡萄皮多酚HPLC色谱分析
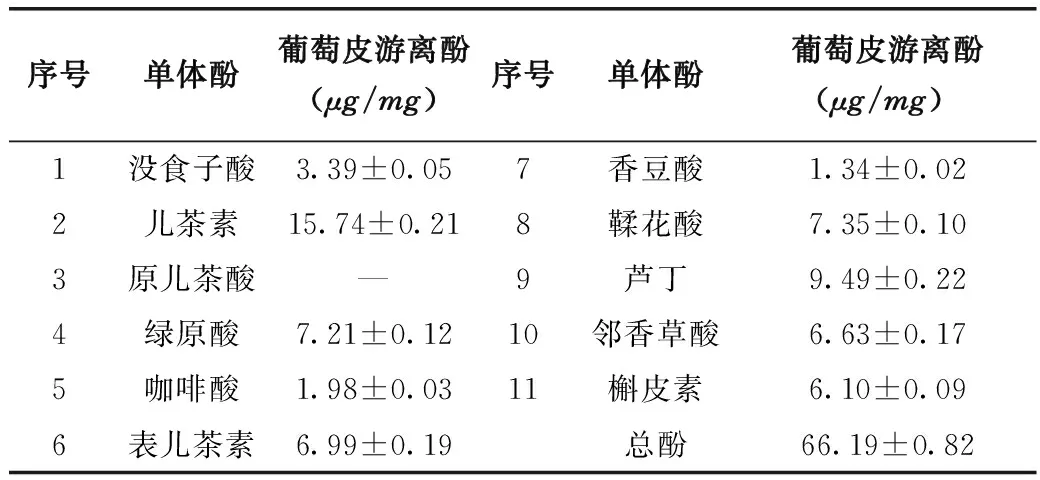
序号单体酚葡萄皮游离酚(μg/mg)序号单体酚葡萄皮游离酚(μg/mg)1没食子酸3.39±0.057香豆酸1.34±0.022儿茶素15.74±0.218鞣花酸7.35±0.103原儿茶酸—9芦丁9.49±0.224绿原酸7.21±0.1210邻香草酸6.63±0.175咖啡酸1.98±0.0311槲皮素6.10±0.096表儿茶素6.99±0.19总酚66.19±0.82
以下。这与程宇峰[14]在对葡萄与葡萄酒中单体酚进行测定时,表明葡萄中主要含有没食子酸、儿茶素、咖啡酸、绿原酸、槲皮素、芦丁等酚类物质相符。同样HernánH和焦中高等[15,16]人在对葡萄皮和梨枣中游离酚类物质进行提取时发现,儿茶素和表儿茶素均是最主要的酚类物质。本文在对葡萄皮游离酚检测中确定的10中单体酚类物质中含量最高的是儿茶素(15.74±0.21μg/mg)。
3 结论
本文主要利用有机溶剂萃取法对葡萄皮多酚进行萃取,通过对乙醇浓度、超声时间、超声功率、料液比等4个单因素对提取条件进行了优化,并通过响应面优化确定料液比为1:40、超声时间1.6h、超声功率430W、乙醇浓度33%,葡萄皮多酚的提取率为29.16mg/g。选取AB-8树脂对提取的葡萄皮多酚进行纯化,并通过HPLC进行了定性以及定量分析,确定了10种单体酚,其中主要酚酸物质为儿茶素。◇
[1]阎海青,等.响应面法优化蓝莓不可萃取多酚的碱法提取工艺[J].食品科技,2013,38(11):203-208.
[2]NardiniM,GhiselliA.Determinationoffreeandboundphenolicacidsinbeer[J].FoodChemistry,2004,84(1):137-143.
[3]PreussHG,etal.Long-termeffectsofchromium,grapeseedextract,andzinconvariousmetabolicparametersofrats[J].MolecularandCellularBiochemistry,2001,223:95-102.
[4]李少伟,等.葡萄籽原花青素对小鼠脂肪肝模型缺血再灌注造成的急性肝损伤的保护作用[J].山东大学学报(医学版),2015,53(9):41-46.
[5]崔鹏,等.南方鲜食葡萄品种遗传多样性的ISSR分析[J].核农学报,2013,27(9):1270-1275.
[6]王颖,等.葡萄皮中多酚类化合物提取工艺的优化[J].湖北农业科学,2013,52(15):3622-3627.
[7]张翠娟,等.葡多酚与阿霉素对H-22肝癌小鼠的协同抗肿瘤作用[J].山东大学学报:医学版,2002,40(5):474-475.
[8]李凤英,等.微波辅助提取葡萄皮多酚的最佳条件[J].河北科技师范学院学报,2009,23(3):33-36.
[9]李婷,等.酶法提取葡萄皮渣中白藜芦醇工艺研究[J].食品科学,2008,29,(12):194-197.
[10]牟京霞.酿酒葡萄成熟过程中黄烷-3-醇类化合物含量变化的研究[D].济南:山东轻工业学院,2011.
[11]LiYP,etal.Microwave-assistanceprovidesveryrapidandefficientextractionofgrapeseedpolyphenols[J].FoodChemistry,2011,129,570-576.
[12]贾荣.山葡萄籽多酚提取物及抗氧化活性的研究[D].长春:吉林大学,2010.
[13]AmicoV,etal.Polyphenol-enrichedfractionsfromSiciliangrapepomace:HPLC-DADanalysisandantioxidantactivity[J].BioresourceTechnology,2008,99:5960-5966.
[14]程宇峰.葡萄与葡萄酒中单体酚分析测定方法研究[D].杨凌:西北农林科技大学,2008.
[15]HernánH.Tournoura,etal.Valorizationofgrapepomace:Extractionofbioactivephenolicswithantioxidantproperties[J].IndustrialCropsandProducts,2015,74:397-406.
[16]焦中高,等.枣果中酚类物质的高效液相色谱分析[J].食品与发酵工程,2008,34(3):133-136.
(责任编辑李燕妮)
Study on Extraction,Purification and Contents of Phenolic in Grape Peel
QI Yan1,2,SUN Jin-yue2,3,CHENG An-wei2,3,TAN Xin1,2,XIE Chun-yang1(1College of Food Science and Technology,Jilin Agricultural University,Changchun 130118,China;2Institute of Agro-food Science and Technology,Shandong Academy of Agricultural Science,Jinan 250100,China;3Key Laboratory of Agro-products Processing Technology of Shandong Province,Jinan 250100,China)
PolyphenolsinKyohograpepeelwereextractedwithultrasonicmethod,andtheextractionconditionswereoptimizedbyResponseSurfaceMethodology.ThecompositionsandcontentsofphenolicsingrapepeelweredeterminedbyHPLC.Theoptimizedextractionconditionsweresolid/liquid1:30,ultrasonictime1.6h,ultrasonicpower430W,ethanolconcentration33%,andyieldofpolyphenolswas29.16mg/g.AB-8resinhadbetteradsorptionanddesorptionpropertiestopurifythegrapepolyphenols.ByHPLCanalysis, 10kindsofphenoliccompoundsingrapepeelwereidentified,andcatechin(15.74 ± 0.21μg/mg)wasthemainlycompound.
grape;polyphenol;ResponseSurfaceMethodology;HPLC
山东省农业重大应用技术创新课题“葡萄全果资源化利用与绿色防腐保鲜关键技术研究”;公益性行业(农业)科研专项经费(项目编号:201303076-06)。
齐岩(1991—),女,在读硕士研究生,研究方向:长白山野生植物资源开发利用。
谢春阳(1965—),男,硕士,硕士生导师,副教授,研究方向:长白山野生植物资源开发利用。
FoodandNutritioninChina

