RNA干扰抑制ST细胞Ⅰ型干扰素受体-2表达的研究
沈海燕,张春红,刘志成,孙俊颖,卢 宇,张建峰*
(1.广东省农业科学院动物卫生研究所/广东省兽医公共卫生公共实验室/广东省畜禽疫病防治研究重点实验,广东广州 510640;2.国家兽用生物制品工程技术研究中心,江苏南京 210014)
RNA干扰抑制ST细胞Ⅰ型干扰素受体-2表达的研究
沈海燕1△,张春红1△,刘志成1,孙俊颖1,卢宇2,张建峰1*
(1.广东省农业科学院动物卫生研究所/广东省兽医公共卫生公共实验室/广东省畜禽疫病防治研究重点实验,广东广州 510640;2.国家兽用生物制品工程技术研究中心,江苏南京 210014)
应用RNA干扰技术建立猪睾丸(ST)细胞Ⅰ型干扰素受体-2(IFNAR-2)基因knock down模型。采用FuGENE HD转染剂将pSiCMVE1、pSiCMVE2和pSiCMVE3干扰载体分别转染ST细胞,经荧光定量PCR和Western blot分别检测IFNAR2 mRNA和蛋白水平表达变化。结果显示,与对照组比,转染干扰载体组均可明显降低IFNAR2 mRNA和蛋白的表达(P<0.05)。RNA干扰技术能够有效抑制IFNAR2基因的表达,为进一步研究IFNAR2基因的生物学功能提供可靠的手段,为研究IFNAR2在病毒感染中的作用奠定基础。
RNA干扰;ST细胞;Ⅰ型干扰素受体-2
干扰素(inteferon,IFN)发挥其抗病毒的生物效应需要与相应的信号受体结合,引发级联信号放大过程,将信号传递到细胞核内,调控一系列基因表达相应抗病毒蛋白,进而发挥抗病毒作用[1-2]。干扰素受体是干扰素连锁反应的初始蛋白[3-4]。根据IFN的分类,IFN受体分为结合Ⅰ型IFN的Ⅰ型IFN受体和结合Ⅱ型IFN的Ⅱ型IFN受体。人Ⅰ型IFN受体(type Ⅰ interferon receptor,IFNAR)分布在细胞表面,由2个亚单位组成,分别为α(IFNAR-1)和β(IFNAR-2)[5]。IFN-α/β通过吸附细胞表面受体IFNAR-1和IFNAR-2发挥作用,蛋白酪氨酸激酶中的Tyk2和Jak1分别与IFNAR-1和IFNAR-2相关[6]。目前对IFNAR的分子结构基本弄清,但IFNAR的研究则处于起步阶段,IFNAR很多问题仍亟待解决,例如IFNAR在信号通路中发挥的作用、如何发生磷酸化、与IFN结合的位点等等,这些问题的解决有利于IFNAR的相关研究。
RNAi(RNA interference,RNAi)是由双链RNA介导的、在转录后mRNA水平关闭相应基因表达的一种基因阻断技术[7]。RNAi诱导的特异性基因沉默现象,具有抗病毒入侵[8-10]、抑制转座子活动[11]、调控基因表达[12]等作用。本研究将筛选得到的靶向IFNAR2基因的siRNA寡核苷酸片段插入到pSilencer4.1载体系统中,构建靶向IFNAR2基因的RNA干扰载体。将干扰载体转染ST细胞均能高效抑制IFNAR2基因的表达,为进一步研究IFNAR2基因的生物学功能提供更加可靠和便捷的研究手段,同时为研究IFNAR2受体在病毒感染中的作用奠定了基础。
1 材料与方法
1.1材料
pSilencerTM 4.1-neo载体,购自Thermo Fisher Scientific公司;猪睾丸(swine testis,ST)细胞,购自中国典型培养物保藏中心(CCTCC,武汉);DMEM培养基,Gibgo公司产品;FuGENE○RHD Transfection Reagent,Promega公司产品;质粒提取试剂盒,Omega公司产品;Rabbit Anti-Human IFNAR2 Polyclonal Antibody,Gene Tex公司产品;猪β-actin抗体,碧云天生物有限公司产品;ECL化学发光试剂盒、PVDF膜,Santa Cruz Biotechnology公司产品;辣根过氧化物酶标记的二抗,北京中杉金桥生物技术有限公司产品。
1.2方法
1.2.1pSilencer4.1-neo-siRNA-IFNAR2重组载体的构建根据siRNA模板设计原则和GenBank中IFNAR2基因的核苷酸序列(№HQ665551),应用Ambion公司siRNATargetFinder软件设计。正义链、反义链中间由9个核苷酸TTCAAGAGA连接,反义链末端加6个T作为转录终止信号。模板链两端加入BamHⅠ和Hind Ⅲ的酶切位点,由上海生工生物工程技术服务有限公司合成。将pSilencer4.1-neo载体进行BamHⅠ 和Hind Ⅲ双酶切,使其线性化,电泳鉴定并切胶回收。
双链的合成:编码链和模板链各取2 μL,TE缓冲液2 μL,无菌双蒸水14 μL,混匀后在90℃水浴加热3 min,再在37℃水浴孵育1 h,反应结束后直接用于连接反应。
连接反应体系为:反应液2 μL,预先已用限制性内切酶BamHⅠ 和Hind Ⅲ双酶切的pSilencer4.1-CMV neo载体6 μL,10×连接酶缓冲液1 μL,T4连接酶1 μL,16℃连接过夜。将连接产物转化Top10感受态细胞,涂布在含氨苄青霉素抗性的平板,挑取阳性克隆抽提质粒(分别命名为pSiCMVE1、pSiCMVE2和pSiCMVE3),送上海生工生物工程技术服务有限公司进行测序验证。
1.2.2细胞培养及转染ST细胞在含100 mL/L新生小牛血清、100 000 单位/L青霉素、100 000 μg/L链霉素的DMEM培养基中,在37℃、体积分数为5%的CO2培养。于转染前1 d将ST细胞接种于24孔细胞培养板中培养,待细胞生长至60%~80%融合的单层细胞时,弃去培养液,为了防止血清对转染效率的干扰,用PBS冲洗细胞3次,以去除培养体系中的血清,按FuGENE HD转染剂说明书进行操作,所用试剂均不含抗生素和血清。具体操作如下:将pSiCMVE1、pSiCMVE2和pSiCMVE3各0.6 μg分别用50 μL DMEM稀释。同时将1.8 μL转染试剂用50 μL DMEM稀释,于室温静置5 min,然后将二者混合,于室温孵育20 min。再将混合液加入24孔板中,37℃孵育4 h后吸掉上清,然后在每个孔中加500 μL含有20 mL/L血清的DMEM培养液继续培养,同时设立未转染重组质粒的正常培养ST细胞组。
1.2.3SYBR Green Ⅰ 实时荧光定量PCR检测将筛选获得的RNA干扰IFNAR2基因阳性的ST细胞和正常ST细胞,分别使用胰酶消化收集,取200 μL细胞液使用RNA抽提试剂盒按照所述方法进行细胞总RNA的提取,并用紫外分光光度计测总RNA的浓度。参照One Step SYBG PrimeScript○RRT-PCR Kit Ⅱ产品说明书,按下列组成配制RT-PCR反应液(20 μL体系):2×One Step SYBG RT-PCR buffer 4 10 μL,IFNAR2-上0.4 μL,IFNAR2-下0.4 μL,酶0.4 μL,RNA 2 μL,ddH2O 6.8 μL。
将上述反应液混匀,稍离心后分装到罗氏96孔板中,每孔20 μL,按以下程序进行扩增:42℃ 5 min,95℃5 min,1个循环;94℃ 5 s,60℃ 30 s,72℃ 30 s,40个循环;95℃ 1 s,65℃ 15 s,95℃ 1 s,1个循环;最后40℃ 30 s,1个循环。反应结束,用LightCycle480软件分析结果。
1.2.4Western blot检测以上3组RNA干扰质粒转染24 h后,用细胞裂解液提取上述各组细胞的总蛋白,加热变性后,100 g/L SDS-PAGE电泳分离,电转移至PVDF膜上,含50 g/L脱脂奶粉的Tris盐溶液封闭2 h,加入IFNAR2抗体(稀释比例1∶500),4℃孵育过夜。用含Tween-20的Tris盐溶液洗膜(3次,每次10 min)后加入辣根过氧化物酶标记的二抗(稀释比例1∶2 000),室温下孵育1 h。化学发光法(ECL)检测条带。以β-actin为内参照,操作过程同上,β-actin抗体稀释比例1∶1 000,二抗稀释比例为1∶2 000。将一抗和二抗孵育完成的膜,经ECL显色液作用后进行显色,然后再进行曝光、显影。
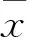
1.2.6稳转细胞系的筛选待转染pSiCMVE1质粒的ST细胞培养24 h后,向培养液中添加G418至终浓度600 μg/mL,每3 d换一次含有600 μg/mL G418的细胞培养液。此时,未转染重组干扰质粒的细胞在G418的作用下逐渐凋亡,换液,去除阴性细胞。当阴性细胞去除后,将筛选获得阳性细胞以一定的稀释度传到96孔中,并继续用含有G418(300 μg/mL)的DMEM培养,适时换液,此细胞记为第1代,并继续传代保存。
2 结果
2.1RNA干扰载体的测序结果
根据IFNAR2基因mRNA序列(№HQ665551),按照siRNA模板设计原则,应用Ambion公司siRNATargetFinder软件筛选出针对IFNAR2基因的特异性RNAi靶位,同时设计阴性对照,shRNAs靶序列见表1。
将合成的双链与经BamHⅠ和Hind Ⅲ线性化的pSIlencer4.1-neo载体连接,连接产物转化大肠埃希菌感受态细胞Top10,挑重组阳性克隆提取质粒后进行测序,测序结果表明构建的RNA干扰载体正确。

表1 IFNAR2基因shRNAs靶序列
2.2实时荧光定量PCR检测
利用实时荧光定量RT-PCR(Roche公司的LightCycler 480型定量PCR仪),比较分析分别转染阴性对照质粒和干扰质粒后,ST细胞中IFNAR2基因mRNA表达量的变化,结果见图1。从图1可以看出,在分别转染pSiCMVE1、pSiCMVE2或pSiCMVE3干扰质粒到ST细胞后,相对于转染了阴性对照质粒pSiCMVNC而言,IFNAR2基因的mRNA表达量均受到了明显的抑制,抑制率在60%~70%,说明这3种干扰质粒载体均能够有效抑制ST细胞中IFNAR2基因的mRNA表达。
2.3Western blot检测
用Western blot检测分别转染阴性对照质粒和干扰质粒后,ST细胞中IFNAR2基因的蛋白产物的表达量变化(图2),在分别转染pSiCMVE1、pSiCMVE2或pSiCMVE3干扰质粒到ST细胞后,相对于转染了阴性对照质粒pSiCMVNC而言,IFNAR2基因的蛋白表达量均受到了明显的抑制,干扰载体pSiCMVE1的抑制效率最明显;而作为内参的β-actin的表达量并不随着是否转染干扰质粒载体而发生变化(图2)。

图1 沉默IFNAR2后mRNA水平的表达Fig.1 The effect of IFNAR2 siRNA on expression of IFNAR2 mRNA
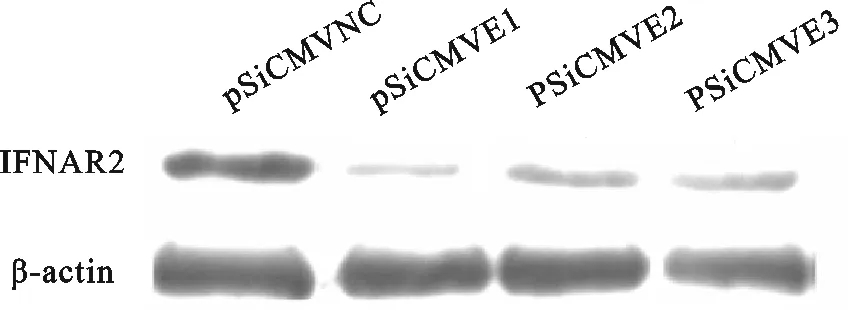
图2 Western blot检测RNA干扰后IFNAR2蛋白的表达Fig.2 The effect of IFNAR2 siRNA on expression of IFNAR2 protein detected by Western blot
2.4稳转细胞系筛选
pSiCMVE1质粒经FuGENE HD转染ST细胞后,加入600 μg/mL G418进行抗性筛选,每3 d换1次培养液,7 d左右阴性对照组细胞开始出现死亡。13 d左右,阴性对照组细胞基本全部死亡,仅有少量细胞存活。将存活的阳性细胞经胰酶消化,分别接种于24孔、12孔和6孔板扩大培养,同时添加300 μg/mL G418进行抗性筛选,待细胞长满后,转至25 cm的培养瓶进行继续培养,所获得的改造细胞系命名为ST-IFNAR2,冻存备用(图3)。

A.光镜下转染后G418筛选的ST细胞;B.光镜下ST-IFNAR2细胞
A.ST cells transfected and G418 selected under light microscope;B.ST-IFNAR2 cells under light microscope
图3转染细胞和筛选的细胞系
Fig.3pSiCMVE1 transfected ST cells and IFNAR2 gene knock-down ST-IFNAR2 cells
3 讨论
IFN的抗病毒作用是通过与IFN受体结合,激活信号转导通路,诱导2,5-腺苷酸合成酶和蛋白激酶被活化,最终抑制病毒蛋白的翻译和病毒RNA的合成[13]。IFNAR是由IFNAR-1和IFNAR-2两个亚单位组成的单链杂合子,IFNAR-2结合能力明显高于IFNAR-1,是研究Ⅰ型IFN受体基因变异以及结构变化的重要靶点[14]。目前关于Ⅰ型IFN受体的功能,例如与配体的相互作用,信号转导机制,以及生物学反应均已阐明。有研究表明,IFNAR在血细胞生成过程、感染过程中内源性和获得性免疫反应中介导Ⅰ型IFN反应的作用[15]。
IFNAR的研究日渐深入,使得IFN在临床上的应用从最初的抗病毒、抗肿瘤,发展到对自身免疫性疾病、抗移植排斥方面的应用。有研究者使用单克隆抗体结合IFNAR,阻断了JAK-STAT信号通路,同时加入环孢素A能明显地延缓同种异体移植的存活时间[16]。另有研究者发现,IFNAR缺陷的NZB小鼠可以减轻狼疮样疾病[17],其机制尚不明确,可能是通过阻断IFN与IFNAR的结合,抑制了IFN的免疫功能。因此,对IFNAR深入的研究,有利于IFN临床应用更具有针对性,还可以预测和评价IFN的临床疗效。
RNAi所诱导的特异性基因沉默现象,普遍存在于真核生物中[7]。RNAi不仅是研究基因表达、调控和功能的有效手段,更为基因功能测定和基因治疗等开辟了新思路[18-19]。目前获得小RNA分子(small interfering RNA,siRNA)的方法主要有化学合成[11]、体外转录、RNase Ⅲ降解dsRNA、siRNA表达载体[12]和PCR表达框方法,其中,siRNA表达载体是可以进行长期研究的方法,利用该方法将合成的双链克隆到带抗生素标记的载体中,添加相应的抗生素在细胞中进行抗性筛选,从而获得稳定细胞系,达到持续抑制靶基因表达的目的。本研究在成功构建了IFNAR2干扰载体的基础上,并选出有效干扰质粒,然后添加G418筛选稳定沉默IFNAR2基因的ST细胞株,为进一步研究IFNAR2在病毒感染中的作用奠定了基础。
[1]Schoggins J W.Interferon-stimulated genes:roles in viral pathogenesis[J].Curr Opin Virol,2014,6:40-46.
[2]刘颖,侯利华,陈薇.干扰素的信号传导和抗病毒效应机制[J].生物技术通讯,2011,23(1):123-126.
[3]Muller U,Steinhoff U,Reis L F,et al.Functional roles of type Ⅰ and type Ⅱ interferons in antiviral defense[J].Science,1994,264(5167):1918-1921.
[4]张玲玲,孟祥伟,迟宝荣.干扰素的基础研究与临床应用[J].中国全科医学,2004,7(22):1715-1716.
[5]Man S M,Kanneganti T D.Type Ⅰ interferon keeps IL-1β in check[J].Cell Host Microbe,2016,19(3):272-274.
[6]Oritani K,Kincade P W,Zhang C,et al.Type Ⅰ interferons and limitin:a comparison of structures,receptors,and functions[J].Cytokine Growth Factor Rev,2001,12(4):337-348.
[7]Elbashir S M,Harborth J,Lendecke l W,et al.Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells[J].Nature,2001,411(6836),494-498.
[8]Shen H,Zhang C,Guo P,et al.Effective inhibition of porcine epidemic diarrhea virus by RNA interferenceinvitro[J].Virus Genes,2015,51(2):252-259.
[9]Liu Y Y,Chen L J,Zhong Y,et al.Specific interference shRNA-expressing plasmids inhibit Hantaan virus infectioninvitroandinvivo[J].Acta Pharmacol Sin,2016,37(4):497-504.
[10]杨亮宇,孙永科,杨玉艾,等.RNA干扰及其在动物传染病方面的研究概况[J].动物医学进展,2013,33(6):130-134.
[11]刘倩,史琳凯,李磊,等.RNA干扰抑制大鼠肺泡巨噬细胞NR8383TGR5受体表达的研究[J].动物医学进展,2014,35(6):6-10.
[12]宋红芹,姜翠翠,张鑫宇,等.非洲猪瘟病毒NP419基因shRNA表达质粒的构建与筛选[J].中国兽医科学,2013,43(1):9-14.
[13]刘运龙,程远国,刘学龙.干扰素研究进展[J].动物医学进展,2008,29(2):85-89.
[14]Domanski P,Colamonici O R.The type- interferon receptor.The long and short of it[J].Cytokine Growth Factor Rev,1996,7(2):143-151.
[15]de Weerd N A,Samarajiwa S A,Hertzog P J.Type Ⅰ interferon receptors: biochemistry and biological funetions[J].J Biol Chem,2007,282(28):20053-200537.
[16]Benizri E,Gugenheim J,Lasfar A,et al.Prolonged allograft survival in cynomolgus monkeys treated with a monoclonal antibody to the human type Ⅰ interferon receptor and low doses of cyclosporine[J].J Interferon Cytokine Res,1998,18(4):273-284.
[17]Santiago-Raber M L,Baccala R,Haraldsson K M,et al.Type-Ⅰ interferon receptor deficiency reduces lupus-like disease in NZB mice[J].J Exp Med,2003,197(6):777-788.
[18]Maduri S.Applicability ofRNA interference in cancer therapy: Current status[J].Indian J Cancer,2015,52(1):11-21.
[19]吕素芳,郭广君,王金良,等.应用RNAi技术防控猪病毒病研究进展[J].动物医学进展,2012,33(10):70-74.
Study on Expression Inhibition of Type Ⅰ Interferon Receptor Gene-2 in ST Cells with RNA Interference
SHEN Hai-yan1,ZHANG Chun-hong1,LIU Zhi-cheng1,SUN Jun-ying1,LU Yu2,ZHANG Jian-feng1
(1.Institude of Animal Health,Guangdong Academy of Agricultural Sciences,Guangdong Open Laboratoryof Veterinary Public Health,GuangdongProvincialKeyLaboratoryofLivestockDiseasePrevention,Guangzhou,Guangdong,510640,China;2.NationalResearchCenterofVeterinaryBiologicalsEngineeringandTechnology,Nanjing,Jiangsu,210014,China)
To establish a type Ⅰ interferon receptor gene-2(IFNAR2) knock down model of ST cells with RNA interference technique,three interfering vectors of pSilencer-4.1,named pSiCMVE1,pSiCMVE2 and pSiCMVE3 were constructed and transfected into ST cells by FuGENE HD.The expression changes of IFNAR2 mRNA and IFNAR2 protein in ST cells were evaluated with qPCR and Western blot respectively.The results showed that compared with normal control,the expressions of IFNAR2 mRNA and protein were significantly reduced by siRNA transfection in ST cells(P<0.05).RNA interference technique can effectively down regulate the expression of IFNAR2 gene in ST cells specifically.This study provided a novel and reliable method for further study on the biological functions and the role of IFNAR2 in virus infection.
RNA interference;ST cell;type Ⅰ interferon receptor gene-2
2016-02-18
国家自然科学青年基金项目(31302101);国家国际科技合作专项(2014DFA31730);广东省科技计划项目(2015B070701015,2016B020212007,2016A040403085,2014B070706011,2014A010107022,2015A020209081,2013B010102012);公益性行业(农业)科研专项(201303046)
沈海燕(1983-),女,河南焦作人,博士,主要从事动物传染病学与免疫学研究。△同等贡献作者。*通讯作者
S852.42;Q789
A
1007-5038(2016)09-0048-05

