BHV-1在牛胚气管细胞中的增殖规律研究
徐丽媛,张志飞,周伟光,呼凤丽
(内蒙古农业大学兽医学院/农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018)
BHV-1在牛胚气管细胞中的增殖规律研究
徐丽媛,张志飞,周伟光*,呼凤丽
(内蒙古农业大学兽医学院/农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018)
为研究牛疱疹病毒Ⅰ型(BHV-1)在牛胚气管细胞(EBTr)中的生长特性和增殖规律,参考文献设计合成特异性引物和探针,建立了TaqMan实时荧光定量PCR方法,检测BHV-1感染EBTr细胞6、12、24、48、72、96、120、144 h后病毒的增殖规律,并观察对应时间点的细胞病变(CPE)。结果显示,用100 TCID50的BHV-1感染EBTr细胞,48 h后开始出现细胞病变,72 h细胞病变明显,120 h细胞大部分变圆,开始脱落,144 h细胞大面积脱落、崩解。实时荧光定量PCR检测结果表明,BHV-1感染EBTr在6 h~24 h内,病毒缓慢增殖,48 h~96 h,病毒增殖速度加快,拷贝数呈对数增长,120 h~144 h,BHV-1的含量仍然呈现升高的趋势,但增长速度变慢。结果证明,BHV-1能够在EBTr中产生CPE,而且CPE程度与病毒DNA增殖规律一致,该结果可以为深入研究BHV-1对EBTr细胞的致病机理提供基础资料。
牛疱疹病毒Ⅰ型;牛胚气管细胞;增殖规律;实时荧光定量PCR
牛疱疹病毒Ⅰ型(Bovine herpesvirus 1,BHV-1)又称牛传染性鼻气管炎病毒(Infections bovine rhinotracheitis virus,IBRV),是牛急性、热性、接触性传染病的一种重要病原。我国于1980年从进口种牛检疫中分离和鉴定了该病毒,目前国内大部分地区的各种牛群中均有此病毒感染。BHV-1具有典型的泛嗜性,在临床上主要表现为呼吸困难、发热、鼻炎、鼻窦炎和气管炎,并能引发生殖道感染、结膜炎、脑膜脑炎、流产、乳房炎等症状,急性呼吸道感染还可继发细菌性肺炎。自然状态下,绝大部分抗体阳性的牛处于潜伏感染状态,在应激条件(运输、分娩等)或免疫抑制剂(类固醇、地塞米松等)作用下,可激活潜伏感染状态的病毒,导致间歇性排毒,成为控制本病的主要障碍,给畜牧业生产造成经济损失[1-3]。
BHV-1主要用牛肾细胞培养,并能产生明显的细胞病变。病毒的增殖是通过囊膜糖蛋白与细胞表面特异性受体分子结合,启动内吞和脱衣壳的机制,随着宿主细胞DNA的复制而完成病毒DNA的复制和转录。本试验利用TaqMan实时荧光定量PCR方法检测BHV-1在牛胚气管细胞(Bovine embryonic tracheal (EBTr) cells )中复制的DNA拷贝数,结合BHV-1在EBTr细胞中产生的CPE,研究BHV-1在EBTr细胞中的生长特性和增殖规律,为深入研究BHV-1在EBTr细胞中的致病机理提供参考。
1 材料与方法
1.1材料
1.1.1细胞和病毒牛肾细胞(MDBK),内蒙古农业大学传染病教研室提供。用含100 mL/L胎牛血清的RPMI-1640培养基在37 ℃培养箱中培养24 h,长成均匀单层备用。EBTr细胞,购自中国科学院上海生命科学研究院细胞资源中心,用100 mL/L胎牛血清的DMEM培养基于37 ℃、体积分数为5%的CO2培养箱中培养,待细胞长成均匀单层进行试验。
BHV-1毒株,购自中国兽医药品监察所。将BHV-1冻干粉稀释后接种单层MDBK细胞,待细胞病变达80%收毒,将收获的细胞毒反复冻融3次彻底释放病毒,离心后收获上清并测定其TCID50,分装后于-80℃保存备用。
1.1.2主要试剂DMEM培养基,Gibco公司产品;胎牛血清,BI公司产品;Easy Pure Viral DNA/RNA Kit,北京全式金生物技术有限公司产品;Premix ExTaqTM(Probe qPCR)和pMD19-T Vector Cloning Kit,宝生物工程(大连)有限公司产品;2×TaqPCR Master MIX,天根生化科技有限公司产品;AxyPrepTMDNA Gel Extraction Kit和AxyPrepTMPlasmid Miniprep Kit,Axygen公司产品。
1.2方法
1.2.1引物和探针的设计与合成根据BHV-1的gB基因特异性核苷酸序列,参照文献[4],由宝生物工程(大连)有限公司合成引物和探针,探针5′端荧光基团为FAM,3′端荧光淬灭基团为TAMRA,扩增片段的长度为97 bp(表1)。

表1 引物和探针
1.2.2PCR扩增BHV-1 DNA取200 μL在MDBK细胞中增殖的BHV-1病毒液,提取病毒DNA,并进行PCR 扩增,反应体系是25 μL:2×TaqPCR Master MIX 12.5 μL,上、下游引物(10 μmol/L)各1 μL,DNA 2 μL,无酶水8.5 μL。反应条件:95℃ 5 min;95℃ 30 s,56℃ 20 s,72℃ 15 s,共35循环;72℃ 10 min。将PCR产物电泳后回收目的条带。
1.2.3阳性标准品的制备将上述纯化好的PCR产物与pMD19-T Vector载体连接,转入E.coliDH5α感受态细胞,经含氨苄青霉素的LB琼脂平板上筛选阳性克隆,接种于含氨苄青霉素的LB液体培养基中过夜培养。提取重组质粒,经质粒PCR、酶切鉴定为阳性后测序。用酶标仪检测重组质粒浓度,并计算质粒DNA的拷贝数,10倍倍比稀释标准质粒,置-20℃储存备用。
1.2.4TaqMan实时荧光定量PCR检测方法的建立1.2.4.1real-time PCR反应条件优化建立20 μL real-time PCR反应体系:Premix ExTaqTM(Probe qPCR)10 μL,上、下游引物(10 μmol/L)各0.5 μL,Probe 0.4 μL,DNA 2 μL,无酶水6.6 μL。反应条件:预变性95℃ 30 s;95℃ 5 s,60 ℃ 30 s,45个循环。设立阴性对照。
1.2.4.2构建real-time PCR标准曲线利用建立的real-time PCR反应条件对1×102~1×109copies/μL的标准阳性质粒进行扩增,反应在ABIViiATM7实时荧光定量PCR仪上完成,建立real-time PCR标准曲线。
1.2.4.3real-time PCR的重复性对1×104~1×106copies/μL的阳性标准品分别设置3个重复进行定量PCR扩增,计算组内变异系数;将3个标准质粒在3次不同时间进行检测,计算组间变异系数,评价real-time PCR方法的重复性。
1.2.5BHV-1的增殖规律用PBS洗净均匀单层的EBTr细胞,加入0.5 mL 100 TCID50的BHV-1病毒液,37℃培养箱吸附约1 h,弃掉毒液,用PBS洗3次,加适量含少许血清的维持液,用未加毒液的正常细胞作0 h对照。取6、12、24、48、72、96、120、144 h不同时间点的细胞培养物,冻融3次后取上清液,提取病毒DNA,与阳性标准品同时进行TaqMan荧光定量PCR检测,每个样品做3个重复。应用绝对定量法计算感染EBTr不同时间点的病毒复制拷贝数,绘制BHV-1生长曲线。
1.2.6EBTr细胞CPE观察观察1.2.5中感染BHV-1不同时间的EBTr细胞形态变化,对各个时间点的细胞进行拍照,采集细胞病变图片。
2 结果
2.1BHV-1的PCR扩增和测序结果
提取在MDBK细胞中培养的BHV-1病毒液DNA,经PCR扩增后产物片段与目的片段大小一致(图1)。将产物片段克隆测序鉴定后用在线Blastn软件对测序结果进行同源性比对,结果显示与试验参考序列的核苷酸同源性为100%,纯化后的质粒OD 260 nm/OD 280 nm值为1.877。

M.DNA标准;1.BHV-1 PCR产物;2.阴性对照
M.DNA Marker;1.PCR products of BHV-1;2.Negative control
图1BHV-1 DNA的PCR电泳图
Fig.1The electrophoresis of BHV-1 DNA by PCR
2.2real-time PCR的标准曲线
将1×102copies/μL~1×109copies/μL的阳性标准品经real-time PCR扩增,得到其扩增曲线和标准曲线(图2和图3)。图2中,浓度为1×102copies/μL~1×109copies/μL的扩增曲线良好,阴性对照为一条水平直线。图3显示,标准曲线在该浓度范围内有很好的线性关系,分析获得扩增相关系数R2为0.999,扩增效率E为93.41%,说明建立的标准曲线能够准确地反映目的基因的扩增。
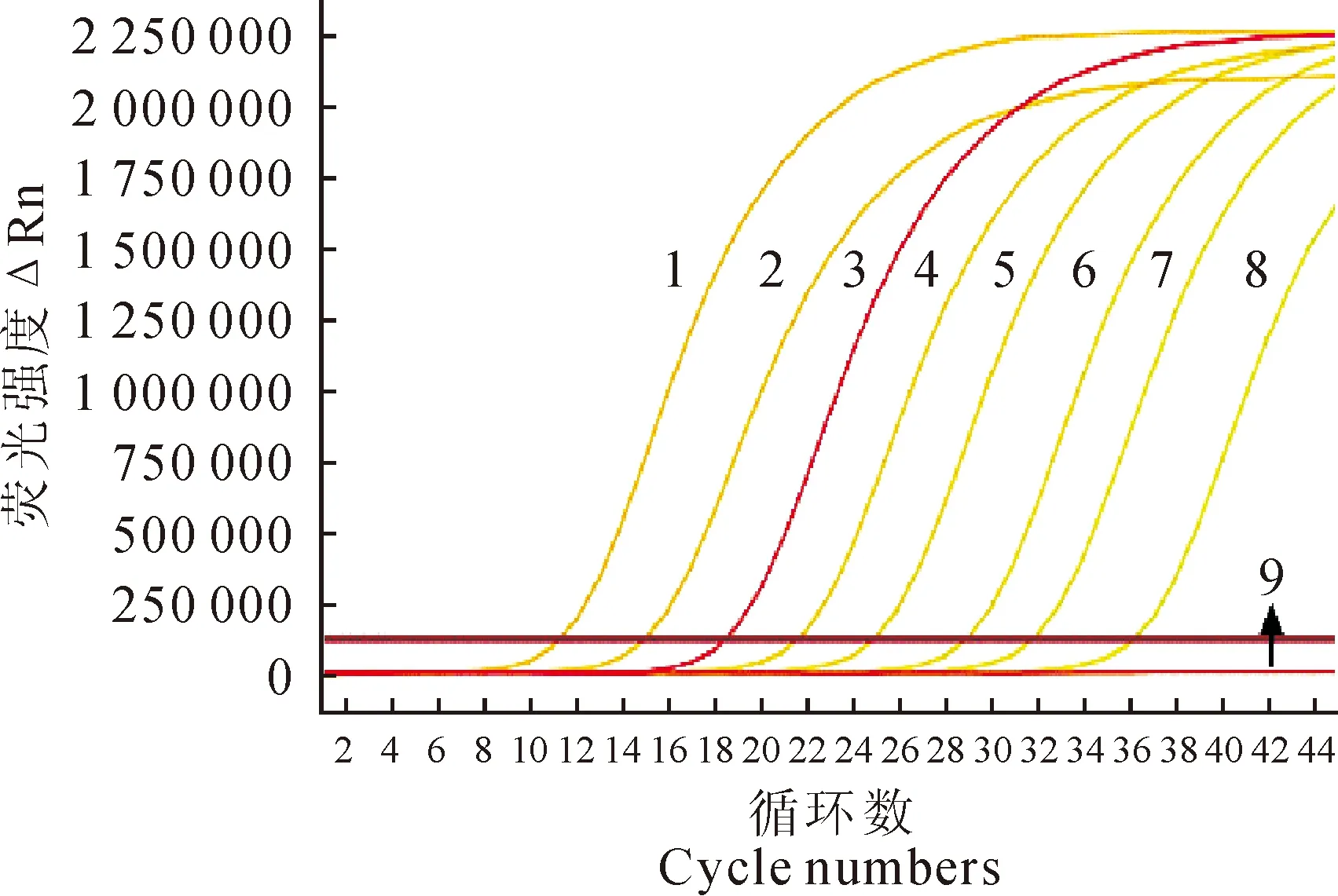
1~8.1×109拷贝/μL~1×102拷贝/μL;9.阴性对照 1-8.1×109 copies/μL~1×102 copies/μL;9.Negative control图2 实时荧光定量PCR扩增曲线Fig.2 The amplification curves of real-time PCR

图3 BHV-1DNA定量PCR标准曲线Fig.3 The standard curve of BHV-1DNA by real-time PCR
2.3real-time PCR重复性结果
将3个标准质粒在3次不同时间做real-time PCR扩增,在同一时间各质粒分别做3个重复进行检测,完成组内、组间重复性试验,计算变异系数(表2)。从表2得知,试验的组内变异系数小于0.6%、组间变异系数小1.8%,说明该方法的重复性好。

表2 实时定量PCR重复性结果
2.4BHV-1的增殖规律
用real-time PCR方法同时扩增阳性标准品和不同时间点的病毒DNA,通过BHV-1的标准曲线计算各时间点复制拷贝数,取各个时间3个重复的平均值作为BHV-1在EBTr中的复制量,绘制BHV-1的生长曲线(图4)。图4中,在感染EBTr的6 h~24 h内病毒缓慢增殖,48 h~96 h,病毒增殖速度加快,拷贝数呈对数增长,120 h~144 h,BHV-1的含量仍然呈现升高的趋势,但增长速度变慢。
2.5BHV-1感染EBTr细胞的CPE
将0.5 mL 100 TCID50的BHV-1病毒液感染EBTr细胞,用正常细胞做对照。观察攻毒后6、12、24、48、72、96、120、144 h细胞的形态变化,并采集细胞病变图片(图5)。图5中,BHV-1感染EBTr后48 h开始出现CPE,但不明显,单层细胞上分散少量小空斑;72 h时CPE明显,细胞皱缩,部分变圆聚集,细胞间隙增大;120 h细胞大部分变圆,开始脱落;到144 h细胞大面积脱落、崩解。

图4 BHV-1在EBTr细胞中的增殖规律Fig.4 The proliferation profile of BHV-1 in EBTr cells

A.正常细胞; B.6 h; C.12 h; D.24 h; E.48 h; F.72 h; G.96 h; H.120 h; I.144 h A.Non infected cells; B.6 h; C.12 h; D.24 h; E.48 h; F.72 h; G.96 h; H.120 h; I.144 h图5 BHV-1感染EBTr细胞不同时间的形态变化Fig.5 Morphological changes of EBTr cells post infection with BHV-1 at different time
3 讨论
BHV-1感染呼吸道和生殖道的黏膜上皮细胞后,通过gC蛋白和硫酸乙酰肝素蛋白多糖结合吸附在细胞表面,接着gD糖蛋白与细胞表面受体稳定结合,在gB和gH/gL复合物的参与下,侵入细胞并到核内进行复制[10]。增殖生产的子代病毒可以直接从感染细胞传播到相邻的健康细胞,或是释放到细胞外基质中的成熟病毒粒子与易感细胞的受体相互作用,继续进行增殖。BHV-1在侵染部位的细胞内大量增殖,释放的子代病毒引起细胞肿胀、核内包涵体增多等细胞病变,导致细胞坏死,加之复制过程中BHV-1吸附靶细胞引发细胞凋亡,最终导致细胞死亡。而且黏膜释放的子代病毒的分泌滴度很高,致使BHV-1在牛群中快速传播[11-13]。大多数国家防控IBR的主要方法是疫苗免疫接种,我国目前还没有自主研发的IBR弱毒活疫苗,灭活疫苗的研制也不成熟[14-15]。
本试验把BHV-1强毒株用MDBK培养,应用100 TCID50接种EBTr后,研究病毒在细胞内的增殖规律,利用real-time PCR检测病毒DNA拷贝数,绘制BHV-1的生长曲线。结果显示,BHV-1感染EBTr后,在6 h~24 h内缓慢增殖,说明经MDBK培养的BHV-1在EBTr中处于适应阶段,细胞未出现病变,病毒的复制缓慢。在48 h~96 h期间,由于BHV-1逐渐适应了EBTr细胞,病毒增殖速度变快,拷贝数呈对数增长,同时细胞变圆聚集,病变明显。从120 h到144 h,BHV-1的含量虽然呈现升高的趋势,但这段时间的增殖速度变得缓慢,这是由于此时的细胞开始部分脱落死亡,病毒复制和转录所需的物质相对减少,因此病毒增殖逐渐变得缓慢。随着细胞死亡的数量不断增多,病毒DNA的含量应到一个平台期,但本试验的BHV-1生长曲线中没有呈现这种变化,说明细胞的大量死亡在144 h后发生。本试验探究了BHV-1在EBTr中的增殖规律和引发的CPE,结果表明,BHV-1不仅能够在EBTr中产生明显的细胞病变,而且BHV-1感染不同时间点的细胞形态变化与病毒生长曲线的走势吻合,试验结果为深入研究BHV-1在EBTr中的致病机理提供参考。
[1]徐晓琴,冷雪,李真光,等.牛传染性鼻气管炎诊断方法研究进展[J].动物医学进展,2010,31(1): 81-86.
[2]Kook I,Henley C,Meyer F,et al.Bovine herpesvirus1 productive infection and immediate early transcription unit1 promoter are stimulated by the synthetic corticosteroid dexamethasone[J].Virology,2015,484:377-385.
[3]Biswas S,Bandyopadhyay S,Dimri U,et al.Bovine herpesvirus-1 (BHV-1)-a re-emerging concern in livestock:a revisit to its biology,epidemiology,diagnosis,and prophylaxis[J].Vet Quarterly,2013,33(2):68-81.
[4]Wang J N,Keefe J O,Orr D,et al.An international inter-laboratory ring trial to evaluate a real-time PCR assay for the detection of bovine herpesvirus 1 in extended bovine semen[J].Vet Microbiol,2008,126:11-19.
[5]敖敦格日勒,温德宝,百溪英一,等.牛白介素10的克隆、测序及其在CHO细胞的表达[J].动物医学进展,2014,35(4):6-9.
[6]乔波,陈楠楠,赵静虎,等.牛传染性鼻气管炎病毒TaqMan-MGB荧光定量PCR方法的建立[J].中国预防兽医学报,2015,37(4):282-285.
[7]王小楠,张焕容.传染性法氏囊病病毒在鸡胚成纤维细胞中的增殖规律[J].动物医学进展,2014,35(6):71-76.
[8]李欢,杨霞,赵军,等.禽支气管炎病毒Jin-13分离株在SPF鸡体内的动态分布[J].病毒学报,2014,30(4):353-358.
[9]付玉志,张洪辉,李传峰,等.Ⅰ型鸭肝炎病毒在鸭胚成纤维细胞系中的增殖特性研究[J].中国预防兽医学报,2013,35(2):110-113.
[10]Muggeridge M I.Characterization of cell-cell fusion mediated by herpes simplex virus 2 glycoproteins gB,gD,gH and gL in transfected cells[J].J Gen Virol,2000,81(8):2017-2027.
[11]Levingsa R L,Rotha J A.Immunity to bovine herpesvirus 1: I.viral lifecycle and innate immunity[J].Anim Health Res Rev,2013,14(1): 88-102.
[12]Nandi S,KumarM ,Manohar M,et al.Bovine herpes virus infections in cattle[J].Anim Health Res Revi,2009,10(1): 85-98.
[13]Jones C.Bovine herpes virus 1 (BHV-1) and herpes simplex virus type 1 (HSV-1) promote survival of latently infected sensory neurons,in part by inhibiting apoptosis[J].J Cell Death,2013,6:1-16.
[14]Ostertag-Hill C,Fang L,Izume S,et al.Differentiation of BHV-1 isolates from vaccine virus by high-resolution melting analysis[J].Virus Res,2015,198: 1-8.
[15]郭利,张淑琴,王炜,等.牛传染性鼻气管炎弱毒活疫苗的安全性和免疫保护效果[J].中国兽医科技,2012,42(4):380-383.
Study on Proliferation Profile of BHV-1 in Bovine Embryonic Tracheal Cells
XU Li-yuan,ZHANG Zhi-fei,ZHOU Wei-guang,HU Feng-li
(Key Laboratory of Clinical Diagnosis and Treatment Technology in Animal Disease,Ministry of Agriculture,CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Hohhot,InnerMongolia,010018,China)
To reveal the proliferation profile of bovine herpesvirus 1 (BHV-1) in bovine embryonic tracheal (EBTr) cells,the specific primers and probe were designed andTaqMan real-time PCR method was developed in this study.The proliferation of the virus in EBTr cells infected with BHV-1 were detected at 6,12,24,48,72,96,120,144 h and cytopathic effect (CPE) was observed in the corresponding time points.The results showed that CPE were observed when the EBTr cells were inoculated by 100 TCID50BHV-1 at 48 h post infection (PI).CPE became clear at 72 h PI,most of the cells became round and began to fall off from flasks at 120 h PI,most of the cells were disintegrated at 144 h PI.The results of real time PCR assay showed that BHV-1 were proliferated slowly when the cells infected within 24 hours,and rapidly during 48 to 96 hours.The load of BHV-1 was still increased,but the growth rate became slowed down during 120 h-144 h.In conclusion,not only BHV-1 can produce CPE in EBTr cells,but also the CPE was consistent with the proliferation profile of viral DNA.The results can provide basic data for further study of the pathogenic mechanism of BHV-1 in EBTr cells.
Bovine herpesvirus 1;EBTr;proliferation profile;real-time PCR
2015-12-23
国家自然科学基金项目(30860202,31260597);内蒙古自治区自然科学基金项目(2015MS0310)
徐丽媛(1991-),女,内蒙古鄂尔多斯人,硕士研究生,主要从事兽医公共卫生学研究。*通讯作者
S852.659.1
A
1007-5038(2016)09-0021-05

