Drp1和Mfn2在棕榈酸诱导大鼠肝细胞损伤中的作用机制及姜黄素衍生物L6H4的干预作用
郑靖宇,吴欢,汤雯,刘成,丁婷婷,戴爽,吴玲,朱再胜,李剑敏
(温州医科大学附属第一医院,浙江 温州 325015,1.病理科;2.老年病科)
・论 著・
Drp1和Mfn2在棕榈酸诱导大鼠肝细胞损伤中的作用机制及姜黄素衍生物L6H4的干预作用
郑靖宇1,吴欢1,汤雯1,刘成1,丁婷婷1,戴爽1,吴玲1,朱再胜2,李剑敏1
(温州医科大学附属第一医院,浙江温州325015,1.病理科;2.老年病科)
目的:研究棕榈酸(PA)诱导肝细胞损伤的体外模拟非酒精性脂肪肝(NAFLD)模型中线粒体发动相关蛋白1(Drp1)和融合蛋白2(Mfn2)的作用机制以及姜黄素衍生物L6H4的保护作用。方法:①分别以不同浓度的PA、油酸(OA)和PA+姜黄素衍生物L6H4的混合培养基培养大鼠BRL-3A正常肝细胞24 h。用MTT法检测细胞活力,以筛选制作体外模拟NAFLD模型的最佳PA浓度及姜黄素衍生物L6H4的干预浓度。②将细胞分为4组:对照组(CON组)、油酸组(OA组)、棕榈酸组(PA组)及姜黄素衍生物L6H4干预组(L6H4组),分别给予正常培养基、含有OA的培养基、含有PA的培养基及含有PA和姜黄素衍生物L6H4的混合培养基进行干预,24 h后收获细胞。分别用羟胺法测定总超氧化物歧化酶(T-SOD)含量、硫代巴比妥酸法测定丙二醛(MDA)含量、Real-time PCR及Western Blot法检测肝细胞Drp1、Mfn2、Bcl-2、Bax、Caspase-3、TNF-α mRNA及蛋白的表达。结果:①不同浓度PA对BRL-3A细胞的生长均具有一定的抑制作用,差异具有统计学意义(P<0.05),并呈明显剂量依赖关系,0.1 mmol/L是分界点,而0.05 mmol/L OA对细胞活力无明显影响。因此选择0.05 mmol/L PA作为最佳造模浓度以建立NAFLD体外模型。②当姜黄素衍生物L6H4干预浓度≤10 μmol/L时,细胞活力均高于75%,浓度>20 μmol/L时,细胞活力降至50%以下,差异具有统计学意义(P<0.05)。10 μmol/L时是分界点,因此选择5 μmol/L作为后续L6H4干预浓度。③与CON组相比,PA组细胞MDA含量、Drp1、Bax、Caspase-3、TNF-α的mRNA及蛋白的表达均显著增加,差异均具有统计学意义(P<0.05);而T-SOD活力、Mfn2、Bcl-2的mRNA及蛋白表达则显著下降,差异均具有统计学意义(P<0.05);与PA组相比,L6H4组的MDA含量、Drp1、Bax、Caspase-3、TNF-α的mRNA及蛋白的表达均显著降低,差异均具有统计学意义(P<0.05),T-SOD活力、Bcl-2 mRNA及蛋白的表达显著提高,差异均具有统计学意义(P<0.05),但Mfn2的表达差异无统计学意义(P>0.05)。结论:姜黄素衍生物L6H4减轻PA诱导的大鼠BRL-3A正常肝细胞的损伤,其机制可能与其减少肝细胞脂质过氧化反应,抑制线粒体的分裂及其下游线粒体凋亡途径及炎症因子信号传导有关。这可能是姜黄素衍生物L6H4防治NAFLD的机制之一。
姜黄素衍生物L6H4;BRL-3A;棕榈酸;线粒体;凋亡
非酒精性脂肪性肝病(nonalcoholic fatty iver disease,NAFLD)发病机制尚未完全明确,目前仍然处于假说阶段,占据主导地位的是Day[1]于1998年提出的“二次打击学说”。氧化应激损伤被认为是其发生的主要病理基础,而线粒体又是氧化应激产生的主要来源,活性氧簇(reacfive oxygen pecies,ROS)的产生累积增多加重线粒体功能障碍和损伤,从而形成恶性循环。目前的研究发现线粒体功能的改变与其线粒体形态变化密切相关,其中线粒体分裂与融合的调节以及对线粒体凋亡通路的调节倍受研究者关注。发动相关蛋白1(dynaminelated protein 1,Drp1)是线粒体分裂的重要执行分子,而线粒体融合蛋白2(mitofusin 2,Mfn2)是线粒体融合的主要执行分子。在正常的生理状态下线粒体的分裂/融合保持着平衡,分裂蛋白表达增加,融合蛋白的表达减少,则促使线粒体分裂,并通过线粒体凋亡途径导致细胞的凋亡[2-3]。最近研究表明,姜黄素能通过减少ROS、调节线粒体膜电位、线粒体生物合成以及线粒体DNA拷贝数,保护线粒体功能及减少细胞凋亡[4]。L6H4是去除了姜黄素β-二酮基团的姜黄素衍生物,具有更好的稳定性及更好的抗炎作用[5-6],但是其作用的机制目前尚未见报道。
本研究通过棕榈酸(palmitate,PA)诱导肝细胞损伤模拟离体的NAFLD模型,研究NAFLD模型肝细胞中线粒体分裂和融合相关的作用及其对下游与线粒体凋亡相关通路的调节机制,并观察姜黄素衍生物L6H4的干预作用,以期阐明NAFLD发病的分子病理机制及姜黄素衍生物L6H4发挥作用的分子机制。
1 材料和方法
1.1主要试剂和药物 正常大鼠肝细胞株BRL-3A(上海基尔顿生物公司);胎牛血清、RPMI-1640培养基(Gibco公司);MTT粉末、二甲基亚砜(DMSO)、棕榈酸粉剂、油酸粉剂(Sigma公司);姜黄素衍生物L6H4粉末(温州医科大学药学院梁广教授所赠);蛋白一抗(CST公司);山羊抗兔二抗(Bioworld公司);ECL发光液(杭州弗德生物科技公司);Trizol、PCR引物合成(Invitrogen公司)反转录试剂盒(Takara公司);real-time PCR试剂盒(ABI公司);蛋白浓度测定试剂盒(碧云天生物公司);超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)测定试剂盒(南京建成生物公司);电泳、转膜系统、成像系统(Biorad公司);7500 real-time PCR仪(ABI公司);ELX800酶标仪(Biotek公司);Image-Pro Plus 6.0图像分析软件(Media Cybe-netics公司)。
1.2方法
1.2.1细胞培养:BRL-3A细胞复苏后在1640完全培养基(含10% FBS、100 U/mL青霉素和100 μg/mL链霉素,简称:培养基)及37 ℃,5% C02,饱和湿度的培养箱中培养,隔天换液1次,当细胞贴壁长满后,用0.25%胰蛋白酶消化,以l∶3传代于培养瓶中,取对数生长期的细胞为实验对象。
1.2.2MTT法检测细胞活力及药物浓度的筛选:收集对数生长期的细胞以每孔2×104接种于96孔板,待细胞贴壁80%以后,换用不含血清的1640培养基培养12 h进行生长同步化后,分别加入终浓度为0.025、0.05、0.1、0.15 mmol/L的PA及0.05 mmol/L的油酸(oleate,OA)进行干预。另设空白组和正常组,分别用等量PBS和含有细胞的培养基孵育细胞。各组均设6个复孔,干预24 h后弃细胞上清液,每孔加MTT溶液(5 mg/mL用PBS配制)20 μL,继续孵育4 h,终止培养,小心吸弃上清,每孔加150 μL DMSO,振荡10 min,使结晶物充分融解。空白对照调零,酶联免疫仪(单波长490 nm)测定各孔的吸光度值(OD值)。计算不同浓度作用下细胞的抑制率。本实验重复3次。细胞的抑制率=[(实验组OD值-空白组OD值)/(正常组OD值-空白组OD值)]×100%。
选择即对细胞生长有抑制作用,又不会使大量细胞裂解死亡的PA浓度作为后续实验造模浓度。在此造模浓度的基础上分别加入终末浓度为1、5、10、20μmol/L的姜黄素衍生物L6H4进行干预24 h后,弃细胞上清液,通过MTT法(具体操作同上述)选择效果最佳的姜黄素衍生物L6H4浓度作为后续实验药物干预浓度。本实验重复3次。
1.2.3MDA含量及总SOD(T-SOD)活力的检测:收集对数生长期的BRL-3A细胞接种于6孔板,待细胞贴壁80%以后,将细胞分4组即CON组、OA组、PA组及L6H4组,分别加入培养基、含0.05 mmol/L OA的培养基、含0.05 mmol/L PA的培养基及含0.05 mmol/L PA+5 μmol/L姜黄素衍生物L6H4的培养基干预。各组均设3个复孔,24 h后弃细胞培养液,用蛋白裂解液充分裂解细胞,收取细胞裂解液,置4 ℃离心(12 000 r/min,10 min),取上清液。用BCA蛋白浓度测定试剂盒测定其蛋白含量,检测各组细胞内MDA含量及T-SOD活力。具体操作严格按照试剂盒说明书进行。本实验重复3次。
1.2.4Real-time PCR技术检测指标mRNA的相对表达量:如上述收获细胞裂解液,按Trizol试剂说明书方法提取总RNA。取1 μg进行RT-PCR反应。产物使用10 μL体系放入Real-time PCR仪进行反应,结果以β-actin为内参照,根据循环(Ct)值用2-ΔΔCt法计算基因的相对表达量。本实验重复3次。Drp1上游引物5’-GAAGTGGTGCAGTGGAAATGAC-3’,下游引物5’-GTTTCTATTGGGAACCACTGCC-3’;Mfn2上游引物5’-CACTACCACATCGGACACCCTA-3’,下游引物5’-GAA CTTGTGTCTTGCATTTGGC-3’;Bcl-2上游引物5’-GGTGG AGGAACTCTTCAGGGA-3’,下游引物5’-GGTTCAGGTACTC AGTCATCCA-3’;Bax上游引物5’-TGCTGATGGCAACTTCA ACT-3’,下游引物5’-ATGATGGTTCTGATCAGCTCG-3’;Caspase-3上游引物5’-GAGACAGACAGTGGAACTGACGA TG-3’,下游引物5’-GGCGCAAAGTGACTGGATGA-3’;TNF-α上游引物5’-CGAGTGACAAGCCCGTAGCC-3’,下游引物5’-GGATGAACACGCCAGTCGCC-3’;β-actin上游引物5’-CCTCTATGCCAACACAGTGC-3’,下游引物5’-ATACT CCTGCTTGCTGATCC-3’。
1.2.5Western Blot法检测各指标蛋白的表达:如上述收获细胞裂解液,置4 ℃离心(12 000 r/min,10 min),取上清液。用BCA蛋白浓度测定试剂盒测定其蛋白含量。定容定量后取样品加热变性、加样、电泳分离蛋白、转膜,用5%脱脂牛奶封闭,TBS-T洗膜,4 ℃下I抗孵育过夜,洗膜后 II抗室温孵育1 h,再洗膜后加化学发光液,用Image-lab成像仪曝光显影。用计算机分析软件对条带进行分析,以目的蛋白与内参蛋白条带累积吸光度(A)比作为反映目的蛋白表达水平的相对指标。I抗浓度:各蛋白指标1∶1 000,内参1∶5 000; II抗浓度:1∶5 000。
1.3统计学处理方法 采用SPSS17.0统计软件进行统计学分析,实验数据均以±s表示。参数多组间比较使用单因素方差分析(ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1药物适宜干预浓度选择 分别以终末浓度0.05 mmol/L的OA及0.025、0.05、0.1、0.15 mmol/L 的PA干预正常BRL-3A细胞24 h,MTT法检测细胞活力。结果表明:0.05 mmol/L OA对细胞活力无明显影响。与OA组相比,0.025 mmol/L PA组细胞活力变化差异无统计学意义(P>0.05),当PA浓度>0.025mmol/L时,不同浓度PA对BRL-3A细胞的生长均具有抑制作用,差异均具有统计学意义(P<0.05或P<0.01)。随PA作用浓度的增加,各组细胞活力均呈下降趋势并且呈明显剂量依赖关系。0.1 mmol/L PA为分界点,0.05 mmol/L PA时细胞活力仍>75%,细胞数量较多,因此选择0.05 mmol/L PA作为后续造模浓度。见图1。

图1 不同浓度的PA对BRL-3A细胞活力的影响
分别以终末浓度0.05 mmol/L PA、0.05 mmol/L PA+1 μmol/L L6H4、0.05 mmol/L PA+5 μmol/L 6H4、0.05 mmol/L PA+10 μmol/L L6H4、0.05 mmol/L PA+20 μmol/L L6H4的培养液干预正常BRL-3A细胞24 h,MTT法检测细胞活力。结果表明:当L6H4干预浓度≤10 μmol/L时,细胞活力均高于75%,当L6H4干预浓度>20 μmol/L,细胞活力降至50%以下。与0.05 mmol/L PA组相比,10 μmol/L 6H4为分界点,差异无统计学意义(P>0.05),当浓度<10 μmol/L,细胞活力明显上升,差异具有统计学意义(P<0.05),因此选择5 μmol/L作为后续的药物干预浓度。而20 μmol/L L6H4已明显抑制细胞活力,差异具有统计学意义(P<0.01)。见图2。
2.2各组大鼠BRL-3A肝细胞匀浆MDA及T-SOD测定结果 与CON组相比,PA组大鼠肝细胞内MDA含量明显升高,T-SOD活力则明显降低,差异均具有统计学意义(P<0.01)。与PA组相比,L6H4组MDA含量明显降低,T-SOD活力明显升高,差异均具有统计学意义(P<0.01)。见表1。
2.3各组大鼠BRL-3A肝细胞Real-time PCR的测定分析结果 与CON组相比,PA组肝细胞中的Drp1、Bax、Caspase-3、TNF-α的mRNA相对含量及Bax/ Bcl-2比值均明显升高,差异均具有统计学意义(P<0.01)。而Bcl-2、Mfn2的mRNA相对含量则明显下降,差异均具有统计学意义(P<0.01)。OA组与CON组相比,差异无统计学意义(P>0.05);与PA组相比,L6H4组肝细胞中的Drp1、Bax、Caspase-3、TNF-α的mRNA相对含量及Bax/Bcl-2比值明显下降,而Bcl-2 的mRNA相对含量显著升高,差异均具有统计学意义(P<0.01或P<0.05),但是Mfn2 mRNA含量差异无统计学意义(P>0.05)。见图3。
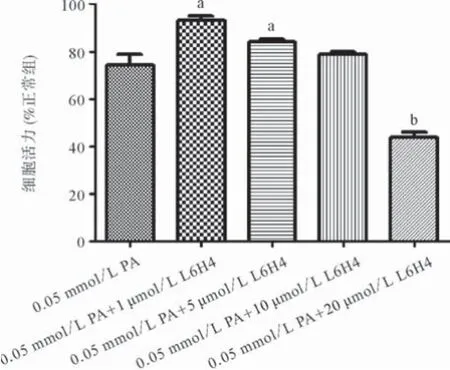
图2 不同浓度姜黄素衍生物L6H4对PA干预BRL-3A细胞活力的影响
表1 各组大鼠肝细胞MDA及T-SOD活力的比较(±s)
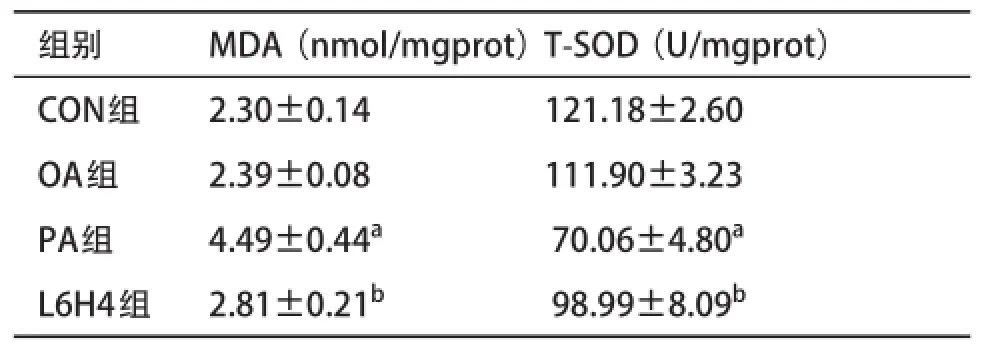
表1 各组大鼠肝细胞MDA及T-SOD活力的比较(±s)
与CON组比:aP<0.01;与PA组比:bP<0.01
组别 MDA(nmol/mgprot)T-SOD(U/mgprot)CON组 2.30±0.14 121.18±2.60 OA组 2.39±0.08 111.90±3.23 PA组 4.49±0.44a70.06±4.80aL6H4组 2.81±0.21b98.99±8.09b
2.4各组大鼠BRL-3A肝细胞Western Blot测定结果
与CON组相比,PA组肝细胞中的Drp1、Bax、Caspase-3、TNF-α的蛋白表达及Bax/Bcl-2比值均显著升高,而Mfn2、Bcl-2的蛋白表达则显著下降,差异均具有统计学意义(P<0.05或P<0.01)。OA组与CON组相比,差异均无统计学意义(P>0.05)。与PA组相比,L6H4组肝细胞中的Drp1、Bax、Caspase-3、TNF-α的蛋白表达以及Bax/Bcl-2的比值明显下降,而Bcl-2蛋白的表达则明显升高,差异均具有统计学意义(P<0.05或P<0.01),但是Mfn2蛋白差异无统计学意义(P>0.05)。见图4。
3 讨论
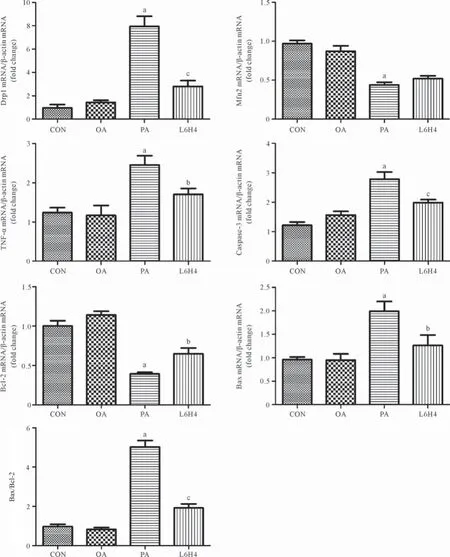
图3 Real-time PCR检测结果
NAFLD的发病机制尚未完全阐明。目前处于主导地位的“二次打击学说”认为胰岛素抵抗导致肝脏组织脂质堆积,形成“第一次打击”,随后不断增加的氧化应激反应和脂质过氧化损伤形成“二次打击”,诱导了肝脏炎性反应、肝细胞变性坏死和肝纤维化的发生[1]。本实验通过体外培养大鼠正常肝细胞,PA诱导肝细胞损伤以模拟NAFLD模型。用MTT法检测发现不同浓度的PA均使肝细胞生存能力下降,细胞死亡增加,且成剂量依赖相关。0.1 mmol/L PA为分界点,为避免PA对肝细胞的过度损伤,本实验选择0.05 mmol/L PA成功制作体外造NAFLD模型。在姜黄素衍生物L6H4干预治疗PA诱导的肝细胞损伤的实验中,发现低浓度姜黄素衍生物L6H4干预可以提高模型肝细胞的生存力,高浓度姜黄素衍生物L6H4则加剧模型肝细胞的损伤,其机制有待进一步的研究。10 μmol/L是姜黄素衍生物L6H4干预浓度的分界点。本实验选择5 μmol/L姜黄素衍生物L6H4干预治疗PA诱导的肝细胞损伤,以期研究其保护肝细胞损伤的机制。

图4 Western Blot法测定结果
NAFLD发展过程中氧化应激损伤被认为是重要病理基础。氧化应激是指机体或细胞内氧自由基的产生与清除失衡,导致活性氧和活性氮在体内或细胞内蓄积而引起的氧化损伤过程。MDA是自由基引起的脂质过氧化过程中的一种醛类物质。SOD可清除H2O2和OH-的前身超氧离子。MDA含量的升高,SOD活性的降低,即可引发氧化应激反应,提示氧化应激的增高。本实验发现PA诱导的肝细胞内MDA含量升高,SOD活性降低,提示PA能促使肝细胞的氧化应激的增加,而姜黄素衍生物L6H4干预后MDA含量降低,SOD活性升高,提示姜黄素衍生物L6H4可通过降低氧化应激,从而保护PA诱导的肝细胞损伤。
近几年来,众多的研究证实:在病理状态下,氧化应激产物来自于细胞线粒体,而且氧化应激可加重线粒体的结构和功能的不稳定性,其主要表现为线粒体的分裂增加,融合减低。Drp1与Mfn2分别执行线粒体的分裂与融合功能,对线粒体形态的稳定起关键作用[2-3]。Mfn2主要定位于线粒体外膜,负责线粒体外膜的融合功能,Drp1则处于细胞浆与线粒体外膜之间穿梭的状态,当细胞处于应激状态,Drp1定位于线粒体外膜上的分裂位点,使线粒体膜通透性增加,使线粒体内物质外流增加,从而加重氧化应激的程度,促进线粒体分裂增加,线粒体相关的细胞凋亡的发生[2-3]。另外,Drp1与Bax共定位在线粒体膜上的分裂位点,Bax的高表达可以协同Drp1加快线粒体的分裂[7]。在Drp1敲除的细胞中,同样条件下通过Bax形成的环状结构减少线粒体内细胞色素C的流出[8]。本实验中,我们观察到PA组Drp1、Bax升高,Mfn2下降,提示线粒体可能在Drp1 与Bax协同作用下分裂的增加,而L6H4组Drp1、Bax明显下降,Mfn2没有明显改变,提示姜黄素衍生物L6H4主要是通过抑制Drp1、Bax的表达,减少线粒体分裂。
线粒体分裂增加,不仅可以反过来加重氧化应激,还可以导致下游线粒体相关的细胞凋亡信号通路的开放。Bcl-2家族被认为是主导线粒体凋亡通路的关键分子,直接受到细胞氧化应激状态的影响[9]。Bcl-2与Bax作为家族中的重要成员其形成一个相互对立的作用,Bcl-2主要位于线粒体外膜而Bax则处于胞浆与线粒体外膜之间穿梭的状态,当Bax聚集于线粒体外膜后进入激活状态,可以形成环形脂质孔隙从而增加线粒体通透性,使线粒体内细胞色素C的流出,向下激活Caspase大瀑布反应,从而导致细胞凋亡的发生;而线粒体外膜上的Bcl-2则可以与Bax结合,阻止其进入激活态,从而抑制细胞凋亡[8,10],因此Bax/Bcl-2比值成为凋亡早期重要的凋亡信号指标。我们观察到PA组细胞Bax/Bcl-2比值有明显升高,而L6H4组Bax/Bcl-2比值则明显降低,提示PA可通过细胞线粒体凋亡通路导致细胞的凋亡;姜黄素衍生物L6H4通过调低Bax/Bcl-2的比值,抑制线粒体通路的凋亡。
TNF-α是重要的炎症指标,同时也是细胞损伤早期信号之一。TNF-α蛋白定位于细胞膜上,在接受细胞外源性损伤刺激后向膜内传导激活Caspase-8进而激活Caspase-3。众所周知,Caspase-3位于各凋亡通路的最下游,是凋亡最后的执行者,也是细胞凋亡的指标。Caspase-3表达增加,则凋亡的发生增加。本实验观察到PA组TNF-α与Caspase-3均明显升高,结合我们的MTT实验结果,即PA导致肝细胞的死亡(凋亡),细胞的生存能力降低,提示PA降低肝细胞的生存能力,可能是因为其增加肝细胞Caspase-3的表达,促使肝细胞的凋亡。而L6H4组中TNF-α、Caspase-3明显降低,提示姜黄素衍生物L6H4可能是通过减少肝细胞的凋亡,发挥其保护作用。
综上所述,在PA诱导肝细胞的损伤的过程中,Drp1表达增高,Mfn2的表达降低,一方面促使线粒体的分裂增多,融合减少,线粒体产生更多的氧化应激产物,加重细胞的损伤;另一方面Drp1和Bax可能通过两者的协同作用,在增加线粒体分裂的同时,调高Bax/Bcl-2比值,激活线粒体凋亡通路及TNF-α为首的炎症因子的信号转导,最后凋亡执行蛋白Caspase-3的增加,导致细胞凋亡。姜黄素衍生物L6H4通过调低Drp1、Bax的表达,削弱Drp1、Bax的协同作用,减少线粒体的分裂及氧化应激,同时降低Bax/Bcl-2比值,抑制线粒体凋亡通路的激活及炎症因子的信号转导,减少细胞凋亡的发生。
[1]DAY C P. Non-alcoholic fatty liver disease: a massive problem[J]. Clin Med, 2011, 11(2): 176-178.
[2]SUEN D F, NORRIS K L, YOULE R J. Mitochondrial dynamics and apoptosis[J]. Genes Dev, 2008, 22(12): 1577-1590.
[3]SANTEL A, FULLER M T. Control of mitochondrial morphology by a human mitofusin[J]. J Cell Sci, 2001, 114(Pt5): 867-874.
[4]KUO J J, CHANG H H, TSAI T H, et al. Curcumin ameliorates mitochondrial dysfunction associated with inhibition of gluconeogenesis in free fatty acid-mediated hepatic lipoapoptosis[J]. Int J Mol Med, 2012, 30(3): 643-649.
[5]WU J, LI J, CAI Y, et al. Evaluation and discovery of novel synthetic chalcone derivatives as anti-infl ammatory agents [J]. J Med Chem, 2011, 54(23): 8110-8123
[6]陈四梅, 张森凯, 刘网网, 等. 姜黄素衍生物L6H4对糖脂代谢异常大鼠的治疗作用及其机制[J]. 温州医科大学学报, 2015, 45(3): 176-179.
[7]KARBOWSKI M, LEE Y J, GAUME B, et al. Spatial and temporal association of Bax with mitochondrial fi ssion sites,Drp1, and Mfn2 during apoptosis[J]. J Cell. Biol, 2002, 159(6): 931-938.
[8]GROSSE L, WURM C A, BRUSER C, et al. Bax assembles into large ring-like structures remodeling the mitochondrial outer membrane in apoptosis[J]. EMBO J, 2016, 35(4): 402-413.
[9]FRANCO R, CIDLOWSKI J A. Apoptosis and glutathione:beyond an antioxidant[J]. Cell Death Differ, 2009, 16(10):1303-1314.
[10]CORY S, ADAMS J M. The Bcl2 family: regulators of the cellular life-or-death switch[J]. Nat Rev Cancer, 2002, 2(9):647-656.
(本文编辑:丁敏娇)
Roles of Drp1 and Mfn2 in palmitate induced rat hepatocyte injury and the effects of curcumin derivative L6H4 on it
ZHENG Jingyu1, WU Huan1, TANG Wen1, LIU Cheng1, DING Tingting1, DAI Shuang1, WU Ling1, ZHU Zaisheng2, LI Jianmin1. 1.Department of Pathology, the First Affi liated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Gerontology, the First Affi liated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To explore the roles and mechanism of mitochondrial dynamin-related protein 1 (drp1) and mitochondrial fusion protein 2 (Mfn2) in palmitate (PA) induced rat hepatocyte injury in the model of nonalcoholic-fatty-liver-disease (NAFLD) in vitro, and the effects of curcumin derivative L6H4 on it. Methods: Rat BRL-3A hepatocytes were cultured with difference concentrations of PA and oleate (OA) and PA+ curcumin derivative L6H4 mixed medium for 24 hours respectively. Cell vitality was detected by MTT assay and the optimal concentration of PA for establishing non alcoholic fatty liver model in vitro and drug intervention of curcumin derivative L6H4 were screened. Cells were divided into 4 groups: control group (CON group), oleate group (OA group), palmitate group (PA group) and curcumin derivative L6H4 intervention group (L6H4 group), andwere cultured with normal medium, containing oleate medium, containing palmitate medium and containing palmitate and curcumin derivative L6H4 mixed medium for 24 hours, respectively. Total SOD activity was detected y hydroxylamine method. The content of MDA was analyzsed by thiobarbituric acid method. The expression of mRNA and protein of Drp1, Mfn2, Bcl-2, Bax, Caspase-3, TNF-α of hepatocyte were detected by real-time PCR nd Western blot respectively. Results: Different concentrations of PA had certain inhibitory effect on BRL-3A ells growth (P<0.05), and showed a clear dose dependence manner, 0.1 mmol/L PA was the cut-off point, while .05 mmol/L OA had no obvious effect. 0.05 mmol/L PA was selected as the optimal concentration to establish he model of NAFLD in vitro. The cell viability was higher than 75% when the concentration of curcumin derivaive L6H4 was lower than 10 μmol/L. The cell viability dropped to below 50% (P<0.05) when the concentration f curcumin derivatives L6H4 was higher than 20 μmol/L, 10 μmol/L L6H4 was the cut-off point. Therefore, 5 mol/L curcumin derivative L6H4 was chosen for subsequent L6H4 interfere concentration. Compared with the CON group, MDA content of cellular homogenization and the expressions of mRNA and protein of Drp1, Bax,Caspase-3, TNF-α were increased (P<0.05) signifi cantly, T-SOD activity and the expressions of mRNA and proein of Mfn2, Bcl-2 were decreased (P<0.05) signifi cantly in PA group. Compared with the PA group, MDA conent of cellular homogenization and the expressions of mRNA and protein of Drp1, Bax, Caspase-3, TNF-α were ecreased signifi cantly (P<0.05), T-SOD activity and the expressions of mRNA and protein of Bcl-2 were inreased signifi cantly (P<0.05) in L6H4 group, but the expression of Mfn2 had no signifi cant difference (P>0.05). Conclusion: Curcumin derivative L6H4 plays an important role in attenuation hepatocyte injury induced by PA,which is associated with its decrease the lipid peroxidation, inhibition mitochondrial fi ssion and suppression the ownstream of mitochondrial apoptotic pathway and signal transduction of infl ammatory factor. It may be one of he underlying mechanism for curcumin derivative L6H4 to treat NAFLD.
curcumin derivative L6H4; BRL-3A; palmitate; mitochondria; apoptosis
R361.2
A DOI: 10.3969/j.issn.2095-9400.2016.07.001
2016-02-29
国家自然科学基金资助项目(81170204);浙江省自然科学基金资助项目(Y15H250006);浙江省医药卫生科技计划项目(2014KYA137);温州市公益性科技计划项目(Y20150176)。
郑靖宇(1988-),男,浙江温州人,硕士生。
李剑敏,教授,硕士生导师,Email:wzyxyljmin@163.com。

