高原多脏器功能障碍综合征蕨麻小型猪模型的建立及促肾上腺皮质激素与皮质酮的变化
冯小明, 罗晓红, 王红义, 郭晓宇, 陆 璐, 申 健, 肖 攀, 牛廷献(兰州军区兰州总医院动物实验科, 兰州 730050)
高原多脏器功能障碍综合征蕨麻小型猪模型的建立及促肾上腺皮质激素与皮质酮的变化
冯小明, 罗晓红, 王红义, 郭晓宇, 陆 璐, 申健, 肖攀, 牛廷献
(兰州军区兰州总医院动物实验科, 兰州 730050)
目的 研究高原多脏器功能障碍综合征(H-MODS)蕨麻小型猪模型的建立及促肾上腺皮质激素(ACTH)与皮质酮(CORT)的变化特点。方法 选用3个剂量(低、中、高)内毒素(LPS)诱导高原土生蕨麻小型猪成功建立H-MODS模型(B、C、D组),生理盐水为对照组(A组)。检测不同时点血清生理生化指标及ACTH与CORT表达水平。 结果各组蕨麻小型猪泵入LPS后肌酸激酶(CK)在3~24 h升高,48 h之后明显降低; 天门冬氨酸转氨酶(AST)在6~24 h升高; 丙氨酸氨基转移酶(ALT)在12 ~24 h的水平显著高于0 h和A组; 总胆红素(TBIL)在24~48 h的水平显著升高; 肌酐(CRE)在6 h水平明显高于0 h。白细胞数量在0~6 h升高,6~24 h降低。ACTH表达量在泵入LPS后开始上升, 在12 h后降低,在72 h基本恢复到与对照组相同水平; CORT在泵入LPS后3 h上升至最高,后又开始下降,24 h后开始上升,在72 h时基本恢复到正常。低、中、高剂量组的变化趋势基本相同。结论高原MODS形成时机体处于严重感染应激状态下,ACTH与CORT表达水平出现剧烈变化, 下丘脑-垂体-肾上腺轴对机体调节的动态平衡被打破而出现紊乱。
高原多脏器功能障碍综合征(H-MODS); 蕨麻小型猪; 促肾上腺皮质激素(ACTH);皮质酮(CORT)
我国高原地区面积大, 急性重型高原病并发多脏器功能障碍综合征(highland multiple organ dysfunction syndrome, H-MODS)的发病率较高[1,2]。本质上, H-MODS与平原MODS没有差别,但高原特殊的缺氧环境使其所受外界环境的影响因素有所不同, 所以其临床特征及发病特点也会出现一些变化[3]。下丘脑-垂体-肾上腺(HPA)轴作为神经内分泌免疫网络的枢纽, 主要作用是维持人体内环境的稳定, 对外界环境的刺激做出生理心理反应,以适应环境的刺激。本研究在海拔3 200 m的高原实地采用高原土生动物蕨麻小型猪作为研究对象建立H-MODS模型, 对其血液生理生化指标进行检测, 并对促肾上腺皮质激素(ACTH)、皮质酮(CORT)的表达量进行检测,研究H-MODS发生发展中神经内分泌的变化特点。
1 材料与方法
1.1动物与试剂
蕨麻小型猪24只,雌雄各半,体质量15 kg左右,分为H-MODS蕨麻小型猪模型高、中、低剂量组和对照组,每组6只,按雌雄各半随机分组。蕨麻小型猪为甘南地区散户饲养。ACTH、CORT试剂盒均购自Cusabio公司(美国)。氯胺酮(国药准字: H35020148,福建古田药业有限公司),地西泮注射液(国药准字: H12020957, 天津金耀氨基酸有限公司),内毒素(LPS) (血清型为: O127: B8,批号为64H4010,Sigma公司,美国)。
1.2模型建立
建模方法参照文献[4],本实验在海拔3 500 m的甘南桑科草原进行,将猪运到在实验地点适应性饲养3 d,待动物状态稳定后进行实验。采用氯胺酮(6 mg/kg)联合安定(0.5 mg/kg)进行肌肉注射麻醉动物,同时肌肉注射阿托品(0.05 mg/kg)。动物麻醉后经耳缘静脉泵入LPS,每组泵入时间均控制在30 min左右, 低、中、高剂量组分别按0.25 mg/kg B组)、0.35 mg/kg(C组)、0.5 mg/kg(D组),对照组(A组)以等量的生理盐水代替。
1.3MODS的诊断标准
参照胡森等[5]提出的动物发生MODS时各个器官功能障碍分期诊断标准和评分标准。在注射LPS后出现2个或2个以上器官或系统功能障碍判定为MODS。
1.4血清采集
三组分别于泵入LPS后0 h、3 h、6 h、12 h、24 h、48 h和72 h经颈静脉采血, 分离血清存于-80 ℃备用。
1.5血常规及血清生化指标的测定
血常规测定白细胞数(WBC),血清生化指标检测[6]肌酸激酶(CK)、天门冬氨酸转氨酶(AST)、丙氨酸氨基转移酶(ALT)、总胆红素(TBIL)和肌酐CRE)。血常规及各项生化指标的检测均由本院检验科完成。
1.6ELISA检测指标
ACTH与CORT表达水平的检测由本实验室按试剂盒操作说明操作完成。
1.7 数据处理与统计
2 结果
2.1体征表现
泵入LPS 1 h后低、中剂量组猪开始转醒但是倒卧不起,高剂量组仍然昏睡,各组猪均出现心率增快,伴随有腹胀、发热、尿频; 苏醒后四肢无力倒卧,无食欲,精神萎靡,呼吸急促; 高剂量组在2 h后开始转醒;低、中剂量组猪在8 h后站立行走,开始采食,精神基本恢复正常,高剂量组晚2 h恢复; 中剂量组1头猪在4 h时因呼吸窘迫、心律失常、继之心衰死亡。高剂量组猪在3 h和5 h时各有1只猪因呼吸窘迫、心律失常、继之心衰死亡。低剂量组猪没有出现死亡,对照组猪体征表现正常也没有出现死亡。中剂量组与高剂量组猪死亡率分别为16.7%和33.3%。
2.2血清生化指标的变化
B、C、D组CK在3~24 h的水平与0 h和A组相比有明显的升高,但是在48 h之后明显降低,其水平低于0 h和A组。B、C、D组AST 在6~12 h水平与0 h和A组相比显著升高,且在12 h升至最高。B、C、D组ALT在12~24 h水平显著高于0 h和A组(P<0.01或P<0.05)。B、C、D组TBIL在24~48 h水平显著高于0 h和A组, B组在72 h的水平显著高于0 h和A组(P<0.01或P<0.05)。C、D组CRE在6 h水平均明显高于0 h (P<0.05)(表1)。
2.3WBC、ACTH与CORT的变化
静脉泵入LPS后,B、C、D组WBC数目急剧下降,在3~6 h与0 h和A组相比明显下降(P<0.05 或P<0.01),在6 h之后开始攀升,24 h时B、C、D组WBC 与0 h和A组相比明显升高(P<0.05或P<0.01),C、D组在 48 h时与0 h和A组相比明显升高(P<0.05或P<0.01),D组在 48 h时达到最高点,B、C组在24 h上升至最高点,B、C、D组WBC数目在72 h变化基本恢复到正常。从总体变化趋势来看,D组较B、C组WBC数目升降变化幅度大(表2)。
B、C、D组在注入LPS后,ACTH表达量开始上升, D组在3 h时与0 h和A组相比明显升高,C组和A组相比明显升高(P<0.05); B组在6 h时与A组相比明显升高,C、D组0 h和A组相比明显升高(P<0.05),详见表2。CORT在注入LPS后同样开始上升,在3 h、6 h D组与0 h和A组相比明显升高(P<0.05); 12 h 时C组与0 h和A组相比明显降低(P<0.05)(表2)。
3 讨论
本研究采用LPS诱导蕨麻小型猪多脏器损伤建立H-MODS模型,选用高、中、低3个剂量来建立模型,结果表明3个剂量的LPS都可以引起蕨麻小型猪生理生化指标的变化,同时中、高剂量组猪均出现死亡,都可以成功建立H-MODS模型。
本研究在成功建立H-MODS模型的基础上,进一步对动物发生MODS时的HPA轴神经内分泌进行检测,研究H-MODS发生发展中神经内分泌的变化特点。一般而言,动物会根据外界环境的刺激作出生理心理反应以适应环境的刺激。在应激状态下HPA轴会导致肾上腺分泌糖皮质激素(GC),然后与其受体结合产生负反馈调节作用而形成调控作用[7],糖皮质激素伴随应激的结束而恢复到正常水平,通过这种机制可以维持机体内环境的稳定,HPA轴在整个应激反应过程中起到平衡激素水平和应对应激的作用。
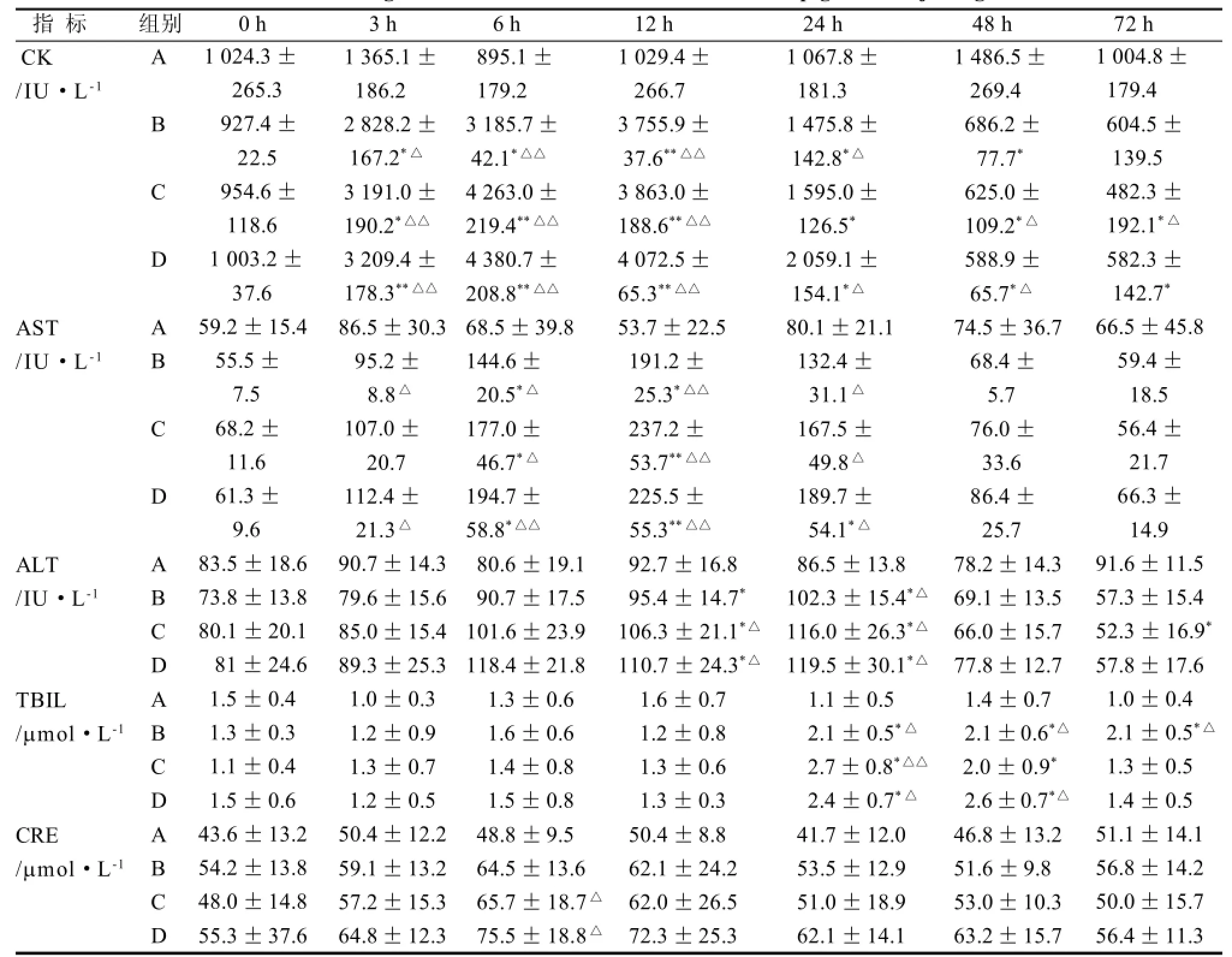
表1 LPS静脉注射后小型猪血清生化指标的变化Table 1 The change of biochemical indexes in serum of minipigs after injecting LPS

表2 各组小型猪不同时点WBC、ACTH与CORT的比较Table 2 The comparison of number WBC,ACTH and CORT in different time in each group of minipigs
ACTH与CORT是表征HPA神经内分泌的两个重要指标。ACTH是维持肾上腺正常形态和功能的重要激素, 动物处于正常的生理状态下, 肾上腺对垂体和下丘脑通过分泌的GC形成负反馈作用, ACTH也可负反馈作用于下丘脑, 形成一个相互协调的反馈调节系统, 但是机体处于急性或长期的慢性应激刺激下, HPA会出现一些病理变化而表现异常[8], 这时机体将可能出现一系列功能紊乱。因此, 高原MODS发生时, 动物在LPS的急性应激和高原环境的持续刺激下, ACTH开始升高, 至24 h后开始回落, HPA 轴在这种应激状态下, 持续亢进, 一方面, 机体的一些功能出现失调或者紊乱状态; 另一方面, HPA 轴也在刺激中调整应对, 逐渐显示机体的自我调节功能, 在48 h后, ACTH开始回落恢复到正常范围。
CORT是通过肾上腺皮质线粒体中的11 β-羟化酶的作用,由11-脱氧皮质醇生成[9]。动物处于应激状态下,各种有关应激的输入信息聚集于一些小细胞性神经元,这些神经元会合成促糖皮质激素释放激素(CRH)和精氨酸加压素 (AVP),同时,下丘脑室旁核也产生CRH,CRH通过垂体门脉系统进入垂体前叶,刺激ACTH的释放,ACTH作用于肾上腺皮质,促进一个完整的HPA 轴系统,最终发挥生物学作用。因此,高原MODS发生时,动物在LPS的急性应激和高原环境的持续刺激下,HPA 轴的会出现异常, CORT开始升高之后又降低。这可能是机体在应激状态下,HPA轴持续亢进,超过了其自身调节的范围,从而引起机体出现神经、免疫、内分泌等多系统功能紊乱的各种症状[10,11]。
有研究[12]表明,应激HPA轴亢奋状态下应激激素上升导致小胶质细胞活化[13,14],产生如肿瘤坏死因子-α (TNF-α)、白细胞介素-1β (IL-1β)、一氧化氮(NO)、前列腺素和活性氧等一系列炎性因子以及趋化因子[15],这些物质均能加重中枢神经系统的炎症反应,使HPA 轴调节失衡,导致应激刺激及炎症更加严重。此外,先前研究[16,17]表明,MODS形成时TNF-α与IL-1β炎症因子表达量也出现上调,本研究中ACTH与CORT表达量也开始升高,HPA 轴活动增强,HPA 轴平衡被打破。有研究[18]证实,手术创伤引起的应激可导致HPA 活动增强,血液中CORT的水平显著提高。此外,有研究[19]显示,肝气郁结实验模型组血浆ACTH、CORT含量高于对照组,HPA 轴兴奋性升高。也有研究[20]报道长期慢性束缚应激会造成大鼠血浆CORT和ACTH含量的升高,内分泌功能失调,HPA轴功能亢进。本研究中高剂量LPS组出现动物的高死亡率,CORT和ACTH表达量也比低剂量组高,机体平衡失调严重程度不同,其死亡率也不同,这与上述研究报道的结果也是相符的。
可见,动物在泵入LPS之后形成H-MODS时,机体处于严重的应激感染状态下,HPA轴开始对动物进行调节,而HPA轴的调节是一种动态的调节,炎症反应使得HPA轴的调节状态出现紊乱,调节的动态平衡被打破; 同时,伴随着HPA轴平衡被应激炎症反应打破,HPA轴开始进行调节,抑制过度炎症反应,维持机体的平衡。因此,HPA轴的调节作用具有双重性。大量研究证实,感染应激时给予补充外源性糖皮质激素可减轻感染的严重程度,降低死亡率。相反,如果切断机体内源性糖皮质激素来源或使用糖皮质激素受体抑制剂往往增加感染的死亡率[21-23]。而另一方面,如果HPA轴过度激活有加重机体感染的危险。因此,研究H-MODS发生发展过程HPA轴变化特点,将有助于加强对H-MODS本质的认识,对H-MODS的干预治疗提供理论参考。
[1] 周其全, 刘福玉, 郑必海, 等. 3184例重型急性高原病患者并发多器官功能障碍综合征的结果分析[J]. 中国危重病急救医学, 2007, 19(1):362-401.
[2] 周其全, 刘福玉, 郑必海, 等. 白细胞与白细胞介素增高在急性高原病并发多器官功能障碍中的作用及临床意义[J].中国危重病急救医学, 2007, 19(10):5882-5921.
[3] 张世范, 刘毅, 高炜, 等. 高海拔地区多脏器功能障碍评分系统诊断的标准[J]. 中华急诊医学杂志, 2006, 15(4):366-369.
[4]牛廷献, 万东君, 陆璐, 等. 高原地区多脏器功能障碍综合症绵羊模型的建立[J]. 实验动物与比较医学, 2012, 32(4):285-289.
[5] 胡森, 盛志勇, 周宝桐, 等. 双相迟发多器官功能不全综合征(MODS)动物模型的研究[J]. 中华创伤杂志, 1996, 12 (2):102-106.
[6] 王春雨, 凡春玲, 罗晓红, 等. 内毒素致多脏器功能障碍综合征绵羊模型的建立[J]. 中国比较医学杂志, 2011, 21(8):49-52.
[7] Kloet ER, Joels M, Holsboer F. Stress and the brain: from adaptation to disease[J]. Nat Rev Neurosci, 2005, 6(6):463-75.
[8] 路翠艳, 潘芳. 应激反应中HPA轴的中枢调控和免疫调节[J]. 中国行为医学科学, 2003, 12(3):353.
[9] Pruessner JC, Wolf OT, Hellhammer DH, et al. Free cortisol levels after awakening: a reliable biological marker for the assessment of adrenocortical activity[J]. Life Sci, 1997, 61 (26):2539-2549.
[10] 乔瑞瑞, 燕平, 刘明菲, 等. 电针“百会”“神门”“太冲”穴对慢性应激抑郁模型大鼠血清ACTH、CORT的影响[J]. 世界中西医结合杂志, 2014, 9(2):156-158.
[11] 夏楠, 王扬天, 王坚. 五味子对高强度军事训练步兵应激系统的影响[J]. 解放军医学杂志, 2014, 39(1):65-69.
[12] McEwen BS.Stress and hippocampal plasticity[J]. Annu Rev Neurosci, 1999, 22:105-122.
[13] 袁权, 诸毅晖, 裴钰, 等. 针刺对下丘脑-垂体-肾上腺轴的调整作用[J]. 时珍国医国药, 2012, 23(7):1795-1797.
[14]De Pablos RM, Villaran RF, Arguelles S, et al. Stressincreases vulnerability to inflammation in the rat prefrontal cortex[J]. J Neurosci, 2006, 26(21):5709-5719.
[15]Frank MG, Baratta MV, Sprunger DB, et al. Microglia serve as a neuroimmune substrate for stress-induced potentiation of CNS proinflammatory cytokine responses[J]. Brain Behav Immun, 2007, 21(1):47-59.
[16] 陆璐, 冯小明, 王红义, 等. 血必净对大鼠多脏器功能障碍综合征炎性因子的影响[J]. 中国比较医学杂志, 2013, 3 (23):26-30.
[17] 冯小明, 王红义, 牛廷献, 等. 乌斯他丁对大鼠多脏器功能障碍综合征炎性因子的影响及意义[J]. 实验动物与比较医学, 2014, 4(34):278-282.
[18] 叶雷, 刘喆, 冯培培, 等. 电针对POCD模型中老龄大鼠下丘脑-垂体-肾上腺轴及认知功能的影响[J]. 浙江中医药大学学报, 2014, 38(7):894-899.
[19] 刘建鸿, 姚凝, 王淳, 等. 肝郁证与下丘脑-腺垂体-肾上腺皮质轴和肝组织过氧化损伤的实验研究[J].中国中西医结合消化杂志, 2008, 16(5):302-304.
[20] 贺立娟, 王玉来, 郭蓉娟, 等. 肝气郁结证大鼠模型的建立及评价[J]. 北京中医药大学学报: 中医临床版, 2013, 20 (6):10-13.
[21] Webster JI, Sternberg EM. Role of the hypothalamicpituitary-adrenal axis, glucocorticoids and glucocorticoid receptors in toxic sequelae of exposure to bacterial and viral products[J]. JEndocrinol, 2004, 181(2):207-221.
[22] Silverstein R, Johnson DC. Endogenous versus exogenous glucocorticoid responses to experimental bacterial sepsis[J]. J Leukocyte Biol, 2003, 73(4):417-427.
[23] Gómez SA, Fernández GC, Vanzulli S, et al. Endogenous glucocorticoids attenuate Shiga toxin-2-induced toxicity in a mouse model of haemolytic uraemic syndrome[J]. Clin Exp Immunol, 2003, 131(2):217-224.
Establishment of Highland Multiple Organ Dysfunction Syndrome Model in Juema Minipig and Changes of Adrenocorticotropic Hormone and Corticosterone
FENG Xiao-ming, LUO Xiao-hong, WANG Hong-yi, GUO Xiao-yu, LU Lu, SHEN Jian, XIAO Pan, NIU Ting-xian
(Lanzhou General Hospital, Lanzhou Military CommandDepartment of Animal Experiment, Lanzhou 730050, China)
ObjectiveTo study the expression changes of adrenocorticotropic hormone (ACTH) and corticosterone (CORT) by model of the highland multiple organ dysfunction syndrome (H-MODS) in Juema minipig. MethodsThe H-MODS model was induced by different dosages of lipopolysaccharide (LPS) in Juema minpig (groups B, C and D), the saline as the control. The expression of CORT and ACTH in serum at different times were detected. ResultsThe expression of ACTH in model groups were rised after pumping LPS and reduce after 12 h, and to return the same as the control in the 72 h. The expression of CORT was rised to highest at 3 h after pumping LPS and then to decline, but to rise after 24 h, and to return the same as the control in the 72 h. The changes in groups of B, C and D have the same trendency. ConclusionThe H-MODS has the severe infection in the model minipigs, the expressionof CORT and ACTH have significient changes, andthe regulation balance of hypothalamicpituitary-adrenal axis was broken.
Highland multiple organ dysfunction syndrome(H-MODS); Juema minipig;Adrenocorticotropic hormone (ACTH); Corticosterone (CORT)
Q95-33
A
1674-5817(2016)02-0107-06
10.3969/j.issn.1674-5817.2016.02.005
2015-09-21
甘肃省技术研究与开发专项计划(1205TCYA010)
冯小明(1980-), 男, 主管技师, 主要研究方向: 实验动物质量控制及开发。E-mail: fxm8006@163.com
牛廷献(1966-), 男, 主任技师, 主要研究方向: 人类疾病动物模型的建立及相关研究。E-mail: niutx10000@163.com

