白藜芦醇在PD小鼠模型中对TLR3/TRIF信号通路及脑内炎症微环境的影响*
杨 明,杨 茜,单明慧,周红利,苏炳银,李淑蓉△
1.成都医学院 病理学与病理生理学教研室(成都 610500);2.发育与再生四川省重点实验室 (成都 610500)
·论著·
白藜芦醇在PD小鼠模型中对TLR3/TRIF信号通路及脑内炎症微环境的影响*
杨明1,杨茜1,单明慧1,周红利2,苏炳银2,李淑蓉1△
1.成都医学院 病理学与病理生理学教研室(成都610500);2.发育与再生四川省重点实验室 (成都610500)
目的建立1-甲基-4苯基-1,2,3,6-四氢吡啶(MPTP) 诱导的小鼠PD模型,探究白藜芦醇(resveratrol,Res)对PD小鼠TLR3/TRIF信号通路及中脑黑质炎症微环境的影响。方法雄性C57/BL6小鼠30只, 按照随机数字表法分为对照组、MPTP组和MPTP+Res组,每组各10只。对照组腹腔注射相同体积生理盐水;MPTP组腹腔注射生理盐水新鲜配制的MPTP 30 mg/(kg·d),连续7 d,结束注射7 d后取材;MPTP+Res组: Res用乙醇溶解为50 mg/mL,用PBS以1∶4的体积比进行稀释,连续注射MPTP 7 d后,腹腔注射Res 28 d,结束注射7 d后取材。采用免疫组化及免疫荧光分别观察小鼠中脑黑质中多巴胺能神经元的变化及小胶质细胞、星形胶质细胞的活化状态。采用实时荧光定量PCR技术检测中脑黑质相关炎症因子mRNA的表达。结果免疫组化结果显示:与MPTP组相比,MPTP+Res组小鼠中脑黑质TH标记的多巴胺能神经元的数量及形态未发生明显变化;CD11b标记的小胶质细胞胞体相对变小,呈圆形及椭圆形,突起减少,变细、变长;而GFAP标记的星形胶质细胞胞体变小,胞体呈圆形,突起变短。qPCR实验结果表明:与MPTP组相比,MPTP+Res组小鼠中脑黑质部位TLR3、IFN-β的mRNA表达量明显增加,差异有统计学意义(P<0.05),但TRIF的mRNA表达量未见明显变化,促炎因子iNOS、TNF-α的mRNA表达量明显下降,差异有统计学意义(P<0.05)。而抗炎因子Arg-1的mRNA表达量明显增加。结论Res可能通过抑制小胶质细胞及星形胶质细胞活化及激活TLR3/TRIF信号通路,降低中脑黑质的促炎因子的释放,从而改善MPTP诱导的小鼠PD模型中的炎症微环境。
TLR3/TRIF信号通路;白藜芦醇;小胶质细胞;炎症表型;星形胶质细胞;多巴胺能神经元
帕金森病(Parkinson′s disease, PD)是常见的中枢神经系统退行性疾病,其主要病变特征是黑质致密部多巴胺(DA)神经元变性缺失,使通过黑质纹状体束作用于纹状体的DA减少,造成纹状体内DA和乙酰胆碱递质平衡失调而发病[1]。主要临床表现为运动迟缓、静止性震颤和肌强直等症状。尽管PD病变部位明确、局限,但其病因及发病机制迄今未明,尚无有效的根治方法。近年来研究[2]表明,炎症反应在PD发病中发挥着重要的作用。白藜芦醇(resveratrol, Res)是一种非黄酮类多酚化合物[3],在植物界广泛分布。研究[4]表明,Res对炎症的发生发展以及相关炎症介质的产生均有一定的抑制作用。Chen等[5]研究发现,Res对机体免疫系统有调控作用,认为其对巨噬细胞、中性粒细胞等释放炎症介质有强烈的抑制作用,且体内抗炎实验亦表现出一定的功效。朴花子等[6]研究表明,Res对脂多糖诱导的小胶质细胞分泌的一氧化氮和肿瘤坏死因子-α有一定的抑制作用,从而对急性脑缺血发作后的神经功能起到一定的保护作用。本研究拟探讨Res在1-甲基-4苯基-1,2,3,6-四氢吡啶(MPTP)动物模型中抑制炎症因子的释放,并通过影响小胶质细胞及星形胶质细胞对多巴胺神经元产生保护作用的可行性,为PD的预防及临床治疗提供线索。
1 材料与方法
1.1实验动物及分组
雄性C57/BL6小鼠30只,3~4月龄,体质量22~25 g,按照随机数字表法分为对照组、MPTP组和MPTP+Res组,每组各10只。对照组:腹腔注射相同体积生理盐水;MPTP组:腹腔注射生理盐水新鲜配制的MPTP 30 mg/(kg·d),连续7 d,结束注射7 d后取材。MPTP+Res组: Res用乙醇溶解为50 mg/mL, 用PBS以1∶4的体积比进行稀释,注射剂量25 mg/(kg·d),采用连续注射MPTP 7 d后连续腹腔注射Res 28 d,结束注射7 d后取材。
1.2试剂和设备
MPTP(美国Sigma公司)、Res(美国Sigma公司)、兔抗TH多克隆抗体(美国Millipore公司)、兔抗CD11b单克隆抗体(英国Abcam公司)、小鼠抗GFAP单克隆抗体(英国Abcam公司)、荧光二抗(美国Life Technologies公司)、Reverse Transcription System试剂盒(美国Promega公司)、FastStar Universal SYBR Green Master(ROX) (瑞士Roche公司)、Trizol试剂(美国Invitrogen公司)、PCR仪(美国BioRad公司)、冰冻切片机(德国LEICA公司),倒置荧光显微镜(日本Olympus公司)。
1.3动物取材及切片
小鼠经4%水合氯醛腹腔麻醉,0.9%生理盐水50~100 mL灌注,待从右心耳流出的液体清澈时,更换4%多聚甲醛溶液100 mL进行灌注,小鼠全身僵硬时灌注成功。在冰盒上分离取出脑组织,用4%多聚甲醛后固定过夜,再放入30%蔗糖溶液中至脑组织沉底。脑组织经OCT包埋,取中脑黑质部冰冻切片(片厚20 μm),放在含4%多聚甲醛溶液的小皿内备用。
1.4免疫组化染色观察
免疫组化染色按常规方法,一抗分别用兔抗TH多克隆抗体、兔抗CD11b单克隆抗体、小鼠抗GFAP单克隆抗体,硫酸镍铵-DAB显色法显色,透明、封片,镜下观察多巴胺能神经元、小胶质细胞及星形胶质细胞。
1.5RT-PCR测定
采用颈椎脱臼法处死动物, 在冰盒上操作, 迅速断头取脑,在体视显微镜下分离中脑黑质,尽量除去黑质外的部分,迅速放入有液氮的碾钵中碾碎标本,用TRIZOL 法抽提总RNA,反转录合成 cDNA。按罗氏试剂盒说明书,采用RT-PCR测定相关炎症因子的mRNA水平。

2 结果
2.1MPTP小鼠模型及Res处理小鼠TH的表达
TH免疫荧光染色结果发现,对照组多巴胺能神经元突起分布密集,着色较深(图1A)。 MPTP组多巴胺能神经元较对照组数量明显减少,残存神经元形态不一,轴突变短、少,部分残存神经元萎缩,细胞核缩小,染色分布不均(图1B)。MPTP+Res组小鼠中脑黑质多巴胺能神经元形态及数量较MPTP组无明显变化(图1C)。
2.2星形胶质细胞GFAP的表达
中脑黑质GFAP免疫组化结果显示,对照组中星形胶质细胞形态正常,密度相对稀少,胞体相对较小,突起分支较细、较少,GFAP染色相对较淡(图2A)。MPTP组星形胶质细胞数量明显增加,突起相对变短,呈现明显活化状态(图2B)。MPTP+Res组与MPTP组相比,星形胶质细胞数量明显减少,突起变短, 胞体变小、变圆,趋向于静息状态(图2C)。
2.3小胶质细胞CD11b的表达
中脑黑质CD11b免疫组化结果显示,对照组中小胶质细胞胞体较小,突起相对较小,染色相对淡染,呈现静息状态(图3A)。MPTP组中小胶质细胞活化明显,胞体肥大,染色加深,突起增多、增粗(图3B)。与MPTP组相比,MPTP+Res组中小胶质细胞数量减少,胞体变小,突起相对变细减少,染色变浅,趋向于静息状态(图3C)。

图1免疫荧光染色检测TH免疫阳性产物在中脑黑质多巴胺能神经元内的表达(Scar bar=200 um)
注:图A:对照组中小鼠中脑黑质免疫荧光TH染色,多巴胺能神经元呈红色带状密集分布,突起分布密集,着色较深;图B:MPTP组小鼠中脑黑质免疫荧光TH染色,较对照组多巴胺神经元数量明显减少,残存神经元形态不一,轴突变短、少,部分残存神经元萎缩,细胞核缩小,染色分布不均;图C:MPTP+Res组小鼠中脑黑质免疫荧光TH染色,较MPTP组多巴胺能神经元无明显变化

图2GFAP免疫组化检测中脑黑质星形胶质细胞(Scar bar=50 um)
注:图A:静息状态下的星形胶质细胞,细胞数目较少,且胞体呈线形、梭形等,突起细长;图B:注射MPTP后活化的星形胶质细胞数量明显增加,胞体呈圆形或椭圆形,染色加深,突起增多,变短、变粗;图C:先注射MPTP后注射Res的星形胶质细胞数目相对减少,突起减少,染色变淡
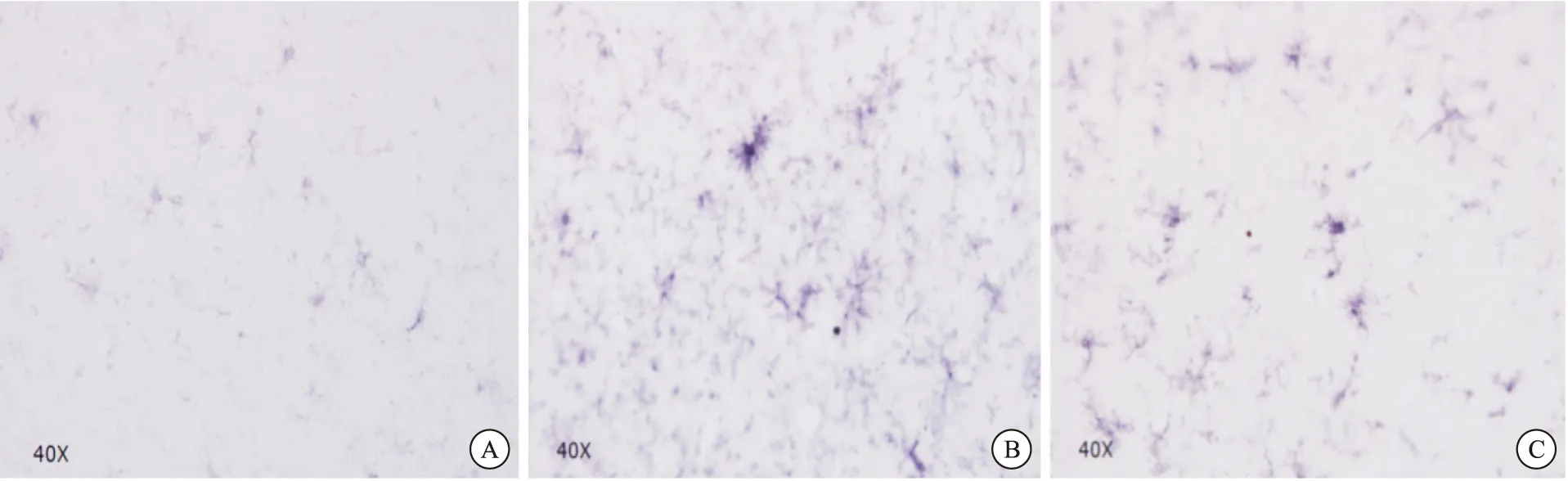
图3CD11b免疫组化检测中脑黑质小胶质细胞 (Scar bar=50 um)
注: 图A:静息状态下的小胶质细胞,胞体较小,突起较长;图B:注射MPTP后活化的小胶质细胞,胞体明显增大,染色加深,突起增多、增粗;图C:先注射MPTP后注射Res的小胶质细胞数量变少,胞体变小,突起相对变少、变长
2.4Res对TLR3/TRIF信号通路及相关炎症因子的作用
中脑黑质qPCR结果显示,与对照组相比,MPTP组中促炎因子iNOS、TNF-α以及TLR3/TRIF信号通路相关蛋白TLR3、TRIF和IFN-β的mRNA表达水平均明显升高。而抑炎因子Arg1 的mRNA表达水平明显下调。MPTP+Res组中促炎因子iNOS、TNFα的mRNA表达水平均降低,而抑炎因子Arg1的mRNA表达水平相对升高,TLR3、IFN-β的mRNA表达水平均增高,而TRIF的mRNA表达水平无明显变化,差异无统计学意义(P<0.05)(图4)。
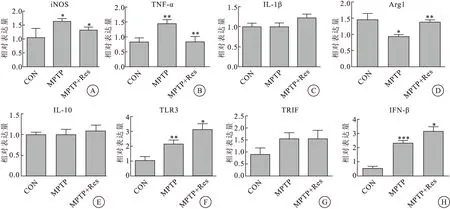
图4Res对MPTP诱导小鼠模型中SNpc炎症因子表达水平的影响
注:*P<0.05,**P<0.01,***P<0.001;图A-E中注射Res后促炎因子iNOS,TNF-α有明显的抑制作用,对抑炎因子Arg1有升高作用,而促炎IL-1β、抑炎因子IL-10无明显变化,差异无统计学意义;图F-H中,注射Res后TLR3、IFN-β表达水平增高,而TRIF表达水平无明显变化,差异无统计学意义
3 讨论
PD由多种因素共同作用而引起,近年研究[7]证实,神经免疫炎症反应也参与了PD的发病。而小胶质细胞和星形胶质细胞对神经炎症反应具有重要调控作用。
小胶质细胞的异常激活对神经元产生毒性作用,从而引起损伤。研究表明,小胶质细胞可通过多种途径被激活,MPTP可导致多巴胺能神经元损伤。McGeer 等[8]对PD患者尸检发现,黑质致密部激活的小胶质细胞聚集在Lewy小体周围。同时,星形胶质细胞也参与MPTP导致的神经元损伤及炎症反应,MPTP引起PD损伤过程中,星形胶质细胞通过其细胞膜表面的单胺氧化酶-B(MAO-B),把MPTP转化为有毒的1-甲基-4-苯基吡啶离子(MPP+),后者被转运进入多巴胺能神经元[9],进而阻止线粒体膜蛋白复合物Ⅰ的电子传递,最终导致多巴胺能神经元的死亡[10]。PD等退行性疾病的炎症反应中,星形胶质细胞激活相对小胶质细胞较弱,其激活后产生的炎症因子也较小胶质细胞少,且星形胶质细胞多在小胶质细胞激活后继发活化[11]。星形胶质细胞被激活后可产生TNF-α、IL-6、NO、IL-1β 等致炎因子。这些致炎因子以不同途径启动细胞内某些信号转导通路,最终导致DA能神经元的死亡[12]。
本研究结果表明,Res干预对于小鼠中脑黑质多巴胺能神经元的形态及数量无明显影响。但是,MPTP+Res组与MPTP组相比,星形胶质细胞数量减少,胞体变小,突起变短变细,向静息状态转变;小胶质细胞从MPTP诱导的活化状态向静息状态转变,即细胞数量减少,胞体变小,染色变淡,突起减少。说明MPTP诱导的损伤过程中,Res可促使星形胶质细胞及小胶质细胞由活化状态向静息状态转变,可能改变PD的炎症微环境。
此外,相关炎症因子mRNA的检测结果表明,Res对PD小鼠中促炎因子iNOS、TNF-α有明显的抑制作用,而对抑炎因子Arg1的产生有一定的促进作用。已有研究[12]认为Res对炎症的发生发展以及炎症因子的释放均有明显的抑制作用。Machado等[13]研究表明,iNOS基因敲除的小鼠能够降低黑质多巴胺能神经元对MPTP诱导的神经损伤的敏感性,并且在MPTP小鼠模型中诱导型一氧化氮合酶抑制剂能够在较大程度上逆转多巴胺能神经元的死亡[14]。本研究与已有研究结果一致,这种作用的产生可能与TLR3/TRIF信号通路相关。本研究证实,Res可改变MPTP诱导的神经炎症反应微环境,并且此种作用可能是通过激活TLR3/ TRIF信号通路而引发的。
总之,根据以上实验结果推测Res可能通过抑制小胶质细胞、星形胶质细胞的活化及激活TLR3/TRIF信号通路,降低促炎因子在脑组织中的表达,对星形胶质细胞的炎症刺激减弱,使星形胶质细胞也向静息状态转变,形成一个良性循环,整体上降低局部脑组织的炎症微环境。但是,Res抑制PD炎症反应的具体作用靶点需要进一步探讨。本研究提示Res可以作为一种有效的PD抗炎思路,为PD的治疗及预防提供一个新的视角。
[1]Dexter DT, Jenner P. Parkinson disease: from pathology to molecular disease mechanisms[J]. Free Radical Biology and Medicine, 2013, 62: 132-144.
[2]Prinz M, Priller J. Microglia and brain macrophages in the molecular age: from origin to neuropsychiatric disease[J]. Nature Reviews Neuroscience, 2014, 15(5): 300-312.
[3]Cookson MR.The biochemistry of Parkinson′s disease [J].Annu Rev Biochem, 2005,74:29-52.
[4]Shao W, Zhang S, Tang M,etal. Suppression of neuroinflammation by astrocytic dopamine D2 receptors via αB-crystallin[J]. Nature, 2013, 494(7435): 90-94.
[5]Chen G, Liu W, Li J,etal. Novel 1,2-diphenylethene derivatives for treatment of immune diseases: US2004010 2517A1[P]. 2004-01-17.
[6]朴花子, 张成镐,朴日龙.白藜芦醇对脂多糖诱导一氧化氮和肿瘤坏死因子生成的影响[J].中药药理与临床,2006,22(5):12-14.
[7]Bruttger J, Karram K, Wörtge S,etal. Genetic cell ablation reveals clusters of local self-renewing microglia in the mammalian central nervous system[J]. Immunity, 2015, 43(1): 92-106.
[8]McGeer PL, McGeer EG.Glial reactions in Parkinson′ s disease [J]. Mov Disord,2008, 23(4): 474-483.
[9]Biber K, Müller T, Boddeke E,etal. Central nervous system myeloid cells as drug targets: current status and translational challenges[J]. Nature Reviews Drug Discovery, 2016, 15(2): 110-124.
[10] Liu B, Hong JS. Role of microglia in inflammation-mediated neurodegenerative diseases: mechanisms and strategies for therapeutic intervention[J]. Journal of Pharmacology and Experimental Therapeutics, 2003, 304(1): 1-7.
[11] Sekar A, Bialas AR, de Rivera H,etal. Schizophrenia risk from complex variation of complement component 4[J]. Nature, 2016, 530(7589): 177-183.
[12] Wolter F, Ulrich S, Stein J. Molecular mechanisms of the chemopreventive effects of resveratrol and its analogs in colorectal cancer: key role of polyamines?[J]. The Journal of Nutrition, 2004, 134(12): 3219-3222.
[13] Machado CJ, Whitaker AM, Smith SE,etal. Maternal immune activation in nonhuman primates alters social attention in juvenile offspring[J]. Biological Psychiatry, 2015, 77(9): 823-832.
[14] Spillantini MG, Schmidt ML, Lee VM,etal. α-Synuclein in Lewy bodies[J]. Nature, 1997, 388(6645): 839-840.
The Effect of Resveratrol on TLR3/TRIF Signaling Pathway and Cerebral Inflammatory Microenvironment in the Brain of PD Mice
YangMing1,YangXi1,ShanMinghui1,ZhouHongli2,SuBingyin2,LiShurong1△.
1.DepartmentofPathologyandPathophysiology,ChengduMedicalCollege,Chengdu610500,China; 2.KeyLaboratoryofDevelopmentandRegenerationofSichuanProvince,Chengdu610500,China
ObjectiveTo construct the animal model of PD mice induced by MPTP and explore the effect of resveratrol on the TLR3/TRIF signaling pathway and the inflammatory microenvironment of the midbrain substantia nigra in PD mice. Methods30 male C57/BL6 mice were divided into the control group, MPTP group and MPTP+Res group in accordance with the random number table, and each group consists of 10 mice. The rats of the control group received 30 mg/kg normal saline daily by intraperitoneal injection, those of MPTP group were administered with the same amount of MPTP daily in the same way for 7 days in succession, and those of MPTP+Res group were injected with MPTP for 7 days in succession and then they were injected with resveratrol for 28 days in succession. Immunohistochemistry and immunofluorescence were adopted to observe the changes of dopaminergic neurons in the substantia nigra, the microglial cells and the activation state of astrocytes. Real-time fluorescence quantitative PCR technique was used to detect the mRNA expression of inflammatory factors in the substantia nigra. ResultsFirstly, the immunohistochemistry results showed that the number and morphology of dopamine neurons in the substantia nigra TH in MPTP+Res group did not change significantly, the CD11b labeled microglia cells were relatively small, round and oval while the projections became less, thinner, and longer. The GFAP labeled astrocytes were smaller, the cells were round, and the projections became shorter. Secondly, the results of the qPCR experiment showed that TLR3, IFN β mRNA expressions of midbrain substantia nigra parts in the mice of MPTP+Res group increased significantly (P<0.05), but TRIF mRNA expression was not significantly changed. Proinflammatory factors of iNOS and TNF-α mRNA expression reduced significantly (P<0.05). The mRNA expression increased significantly in the anti-inflammatory factor Arg-1. ConclusionResveratrol may decrease the release of proinflammatory factors in the midbrain substantia nigra and improve the inflammatory microenvironment in MPTP-induced mouse model by inhibiting the activation of microglia and astrocytes and activating TLR3/TRIF signaling pathway.
TLR3/TRIF signaling pathway; Resveratrol; Microglia; Inflammatory phenotype; Astrocytes; Dopaminergic neurons
10.3969/j.issn.1674-2257.2016.04.001
国家自然科学基金资助项目(No:31371215;31540032)
李淑蓉,E-mail:lsrsus@163.com
R364;R965
A
网络出版地址:http://www.cnki.net/kcms/detail/51.1705.r.20160728.1751.014.html

