骨肉瘤Saos-2细胞Set7/9基因沉默及基因治疗靶点构建
施星臣 耿哲 施鑫鹤
骨肉瘤Saos-2细胞Set7/9基因沉默及基因治疗靶点构建
施星臣耿哲施鑫鹤
目的:构建沉默的人Set7/9的真核表达载体,筛选其稳定转染的骨肉瘤Saos-2细胞株,评价干扰效果以及对骨肉瘤相关基因表达和细胞增殖的影响,为临床骨肉瘤基因治疗提供新靶点。方法:依据靶向序列,构建人Set7/9基因的shRNA和对照载体,稳定转染骨肉瘤细胞Saos-2。应用Real-time PCR以及Western-blot方法检测其基因和蛋白质水平,确定该基因的沉默情况。结果:构建载体Set7/9-shRNA,Real-time PCR和Western-blot结果显示,沉默后Set7/9基因和蛋白表达明显被抑制,而与其相关的Sirt1、Suv39h1蛋白表达水平提高,细胞增殖率增加。结论:沉默Set7/9基因后,上调与其相关的Sirt1和Suv39h1蛋白表达水平,Set7/ 9基因在骨肉瘤Saos-2细胞系中可能调控其的表达。此外,细胞增殖效率增加表明Set7/9具有抑制骨肉瘤Saos-2细胞增殖的作用。
Set7/9;Saos-2细胞;Western-blot
【Abstract】Objective:To silencehuman gene Set7/9 and screen outstable transfection cell line in Saos-2,and investigate the impact ofknockdown ofSet7/9 and influence to theexpression of the related genes.Supplynew target forclinical testand therapy.M ethods:The target oligowasdesigned by thesoftand synthesized,shRNA interferencevectorand the controlvectorwere constructed and transfected into Saos-2 cells.Then Real-time PCR and western-blotwere performed for detection of knockdown of Set7/9.Results:The shRNA interference vector wasconstructed and transfected into Saos-2 cellssuccessfully,comparedwith thenegative controlgroup,theexpression ofSet7/9wasdramatically down-regulated.Meanwhile,expression of related protein Sirt1 up regulated.Conclusion:Down regulation the expression of Set7/9 can upregulate Sirt1and Suv39h1,imply thatSet7/9may regulate theirexpression in Saos-2,and suppress theproliferation.
【Keywords】Set7/9;Saos-2 cells;Western-blot
骨肉瘤(Osteosarcoma,OS)又称为成骨肉瘤,是从间质细胞系发展而来的一种最常见的原发性骨恶性肿瘤,在儿童和年轻成人中具有高侵袭性和远端高发转移性[1]。小儿骨恶性肿瘤治疗包括新辅助化疗和手术技术,治疗方法虽有巨大进步,但仍有大量的复发或转移的病例[2,3]。骨肉瘤的治愈率约为25%,治愈水平几乎停滞在20年前[4,5]。因此,迫切需要研究其发病机制,为药物研究提供新的靶点,从而为临床给出新的治疗方案。
表观遗传学方面的研究逐渐成为热点,其在肿瘤发生和发展中的作用也不断被揭示,其中越来越多的报道探讨了SET结构域在肿瘤发生、发展中的作用[6,7]。SET结构域是蛋白赖氨酸甲基化转移酶(protein ysine methyltransferases,PLMTs或PKMTs)家族成员[8,9]。有报道Set7/9可介导Suv39h1甲基化,致使基因组不稳定[10],对Sirtuin 1(Sirt1)去乙酰化起作用[11],而Suv39h1与肿瘤发病有关。对于Set7/9在骨肉瘤细胞中如何影响Suv39h1以及Sirt1基因和蛋白水平表达,是否可以调控其细胞活性,仍有待研究。
研究报道指出Set7/9、Suv39h1、Sirt1等基因之间存在一定相互作用,而这些作用与一些疾病的发生有关。这三个基因在骨肉瘤细胞中的作用,特别是起关键调控作用的Set7/9基因鲜有报道。本研究以人骨肉瘤Saos-2细胞株为研究对象,构建了Set7/9-shRNA质粒,沉默骨肉瘤细胞株中Set7/9基因,以探讨其在骨肉瘤细胞系Saos-2中所发挥的作用。为临床治疗提供依据和预后判断标准;并在基础研究方面为骨肉瘤细胞活性及细胞周期等方面的研究提供靶向生物治疗的理论支持。
1 材料与方法
1.1实验材料及试剂和设备E.coli.Top10感受态细胞、骨肉瘤细胞株Saos-2均由本实验室保存,DNA内切酶、DNA连接酶、DNAmarker、琼脂糖等均购自加拿大BBI公司;抽提质粒的试剂盒购买于上海生工生物工程有限公司;LipofectamineTM2000转染试剂购自Invitrogen公司;DMEM、胎牛血清FBS、双抗(青链霉素)均购自GIBCO公司;Polybrene购自Sigma公司;PBS购自AMEROSCO公司;SIRT1多克隆抗体SIRT1(sc-15404),SUV39H1单克隆抗体SUV39H1(sc-377112)SET7/9的单克隆抗体SET7/9(sc-56774),购自SANTA CRUZ公司;荧光显微镜生产商为Motic公司,MX3000P实时荧光定量PCR仪购买于Stratagene公司。
1.2构建SETD7-shRNA载体质粒及其鉴定应用在
线软件http://genomics.jp/sidirect/,合并通过文献查阅列出SET7/9基因干扰序列为GGGCACCTGGACGATGACGGA,TTCTCCGAACGTGTCACGT为阴性对照。为避免终止信号产生,loop结构为TTCAAGAGA。两端酶切位点EcoRI与BamHI。按照如下程序在PCR仪上退火:95℃5min;85℃5min;75℃5min;70℃5min;4℃保存。退火后得浓度为10μM的shRNA模板。酶切载体,电泳后回收。随后,连接反应,挑选阳性克隆,提取质粒,测序。
1.3慢病毒载体的包装及侵染细胞将慢病毒包装系统质粒共转染293FT细胞,48h收集上清并浓缩;72h再收集浓缩。滴度1×108TU/m l,重组后病毒侵染Saos-2细胞,puromycin筛选获得稳筛株细胞。
1.4SET7/9表达效果检测puromycin选择后,扩增稳筛株,收样,提取总RNA,荧光定量PCR检测,SET7/9基因的(目的)F primer:CACAGATGGGAGACTGATCTTCAAG,R primer:TTACTTCTCCTACAAGGCT TCCTCC,PCR条件为:95℃,2分钟预变性;95℃,30秒;63℃,40秒;40个循环;western-blot检测干扰后SET7/9蛋白表达情况。
1.5Saos-2细胞增殖实验本实验采用CCK8试剂检测Saos-2细胞增殖。制备细胞悬液:细胞计数;接种到96孔板中,3个重复;37℃培养箱中培养,加入10μl CCK8;培养3小时,可以继续培养,以确认最佳条件;测定450nm吸光度。
2 结果

图1 挑取Set7/9菌落测序鉴定
2.1Set7/9-shRNA载体质粒的鉴定和测序结果空载体pGLV3/H1/GFP/puro连接插入子,之后转化菌株Top10,挑取菌落并抽提质粒。用EcoRI进行单酶切,电泳进行初步判断,并且将符合8000bp的酶切条带所对应的克隆挑取2个,进行测序证明SET7/9shRNA载体构建成功。见图1。2.2 SET7/9基因沉默情况稳筛株细胞扩增,72h收样,Western-blot、Realtime PCR检测。从蛋白和基因水平上对Saos-2细胞中SET7/9基因的沉默情况进行分析,Western-blot检测显示,其蛋白表达也显著下调,同样该基因表达水平明显被抑制(P<0.05)。β-actin为内参,检验转染72h SET7/9基因以及蛋白表达水平。见图2。

图2 SET7/9蛋白与基因的沉默效果
2.3SET7/9基因沉默可以上调SIRT1表达同时在实验组中,用Western-blot对SIRT1及SUV39H1的蛋白表达进行检测,SIRT1蛋白表达水平显著增加,SUV39H1蛋白的表达也有上调,但变化不显著,见图3。
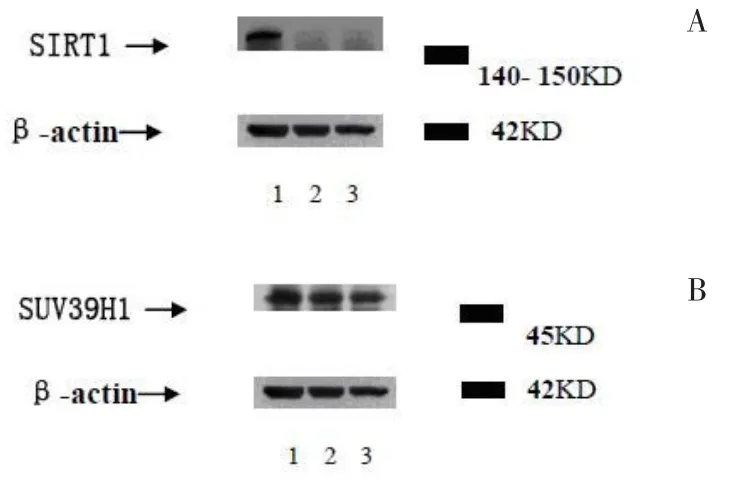
图3 SET7/9沉默后SIRT1与SUV39H 1蛋白表达变化
2.4SET7/9基因影响Saos-2细胞增殖对SET7/9基因进行沉默实验后,相对于野生型和阴性对照组Saos-2细胞的增殖率显著提高,从转染后72h开始出现差异,到达120h时沉默组与野生型组差异最显著,在96h时,沉默组与阴性对照组差异最明显,见图4。
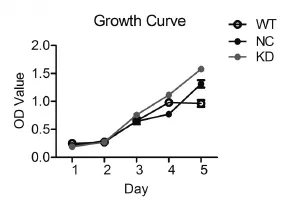
图4 SET7/9基因沉默后骨肉瘤细胞增殖率提高
3 讨论
骨肉瘤是从间质细胞系发展而来,是一种最常见的原发性骨恶性肿瘤,其中小儿骨恶性肿瘤中最为常见。目前对于骨肉瘤成因,特别是重要作用机制和相关因子的研究鲜有报道,因此,从分子生物学角度入手,深入探讨其发病机制,有助于提高骨肉瘤治疗的针对性,提高患者生存率。
对具有修饰功能的蛋白进行研究有助于揭示其抑癌等作用的机制,Set7/9基因具有对多个与肿瘤相关基因的调控作用,对其作用机制的研究可以为骨肉瘤的发病机制提供参考依据。国内研究人员发现Set7/9可以调控Sirt1,而Sirt1可以抑制p53乙酰化,导致p53乙酰化水平增高[12];p53作为抑癌基因已有较多报道,在胃癌等疾病中其发生突变是早期事件[13-15]。在异染色质形成及基因转录调控中,Set7/9可以影响Suv39h1蛋白的甲基化水平[10],研究指出,Suv39h1对于组蛋白H3K9的甲基化具有较大作用,H3K9甲基化与胃癌等在内的一些肿瘤发生有关。因此,结合Set7/9已有的功能报道,本文对其在骨肉瘤细胞中的功能进行研究。选择一种有效的和长期的沉默Set7/9的方法是必需的。脂质体介导shRNA进入细胞通常转染效率低,而慢病毒包装,转染细胞获得稳定株在越来越多的研究中得到应用[16]。通过改造HIV-1形成的逆转录病毒[17],shRNA可以进行长期基因沉默研究的方法[18-20],能够将目的基因整合到染色体上,得到稳定的细胞株。
本研究成功构建了Set7/9-shRNA质粒,初步探索了与其相关蛋白的表达变化情况及在骨肉瘤细胞系Saos-2中该基因的功能。研究发现,在骨肉瘤细胞系Saos-2中沉默Set7/9基因后,与其相关作用的Sirt1蛋白表达水平显著提高,Suv39h1蛋白表达也有所升高。这表明在Set7/9沉默后,Sirt1,Suv39h1所具有的去乙酰化和甲基化作用在增强,使得细胞更倾向于增殖和分裂。在细胞增殖实验也进一步证实了在Saos-2中沉默Set7/9基因后,细胞增殖率明显高于野生型和阴性对照组,由此可以看出Set7/9基因对于骨肉瘤Saos-2细胞的增殖具有一定的调控作用。
本研究通过沉默Set7/9基因,观察了与其相关因子的表达变化和甲基化作用,发现这些因子水平的变化可能对细胞周期和活性产生影响,对于骨肉瘤中这些因子的相互作用,有待更深入的研究,以充实骨肉瘤的形成及转移的分子机制,为进一步开展靶向药物研究和临床检测治疗提供依据。
[1]Carola AS,Arndt,Peter S,et al.Common Musculoskeletal Tumors of Childhood and Adolescence[J].Mayo Clin Proc,2012,87(5):475-487.
[2]BacciG1,FerrariS,LonghiA,etal.Patternof relapse in patientswithosteosarcomaof the extremities treated with neoadjuvantchemotherapy[J]. Eur JCancer,2001,37(1):32-38.
[3]Kempf-Bielack B,Bielack SS,JürgensH,et al.Osteosarcoma relapse after combined modality therapy:an analysis of unselected patients in the Cooperative Osteosarcoma Study Group(COSS)[J].Journal of ClinicalOncology,2005,23(3):559-568.
[4]Gorlick R,Anderson P,Andrulis I,etal.Biology of childhood osteogenic sarcoma and potential targets for therapeutic development:meeting summary[J].Clin Cancer Res,2003,9(15):5442-5453.
[5]Allison,DC,Carney SC,Ahlmann ER,et al.A meta-analysis of osteosarcoma outcomes in themodernmedical era[J].Sarcoma,2012,2012(4):704872.
[6]Kurash JK,LeiH,Shen Q,etal.Methylation ofp53 by Set7/9mediates p53 acetylation and activity in vivo[J].Molecular cell,2008,29(3):392-400.
[7]Esteve PO,Chin HG,Benner J,et al.Regulation of DNMT1 stability through SET7-mediated lysinemethylation inmammalian cells[J].Proc Natl Acad SciUSA,2009,106(13):5076-5081.
[8]Guo HB,Guo H.Mechanism of histonemethylation catalyzed by protein lysinemethytransferase SET7/9 and origin ofproductspecificity[J]. Proc Natl Acad SciUSA,2007,104(21):8797-802.
[9]Qian C,Zhou MM.SET domain protein lysinemethyltransferases:structure,specificityand catalysis[J].CellMolLifeSci,2006,63(23):2755-63.
[10]Donglai Wang,Jingyi Zhou,Xiangyu Liu,et al.Methylation of SUV39H1 by SET7/9 results in heterochromatin relaxation and genome instability[J].Proc NatlAcad SciUSA,2013,110(14):5516-5521.
[11]Liu X,Wang D,Zhao Y,et al.Methyltransferase Set7/9 regulates p53 activity by interacting with Sirtuin 1(SIRT1)[J].Proc Natl Acad Sci USA,2011,108(5):1925-1930.
[12]Huang J,Perez-Burgos L,Placek B J,et al.Repression of p53 activity by Smyd2mediatedmethylation[J].Nature,2006,444(7119):629-632.
[13]朱薇,史平,李晓明.凋亡诱导因子和突变型p53在胃癌前病变组织及胃癌组织中的表达及其相关性研究[J].兰州大学学报:医学版,2015,41(2):41-45.
[14]Scoumanne A,Chen X.Proteinmethylation:anewmechanism ofp53 tumorsuppressor regulation[J].HistolHistopathol,2008,23(9):1143-1149.
[15]Niu ZS,Li BK,Wang M,M Wang.Expression of p53 and C-myc genes and its clinical relevance in the hepatocellular carcinomatous and pericarcinomatous tissues[J].World Journal of Gastroenterology,2002,8(5): 822-826.
[16]Ghosh SS,Gopinath P,Ramesh A.Adenoviral vectors:a promising tool for gene therapy[J].Applied Biochemistry and Biotechnology,2006,133(1):9-29.
[17]Lois C,Hong E J,Pease S,etal.Germ line transmission and tissue specific expression of transgenes delivered by lentiviral vectors[J].Science,2002,295(5556):868-872.
[18]姜海艳,王玉梅,关伟军.乳腺癌多药耐药机制及RNAi技术的应用[J].中国实验诊断学,2009,13(4):561.
[19]Yu JY,DeRuiter SL,Turner DL.RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells[J].ProceedingsoftheNationalAcademyofSciences(USA),2003,7(2):228-236
[20]Liu F,He CW,Zhang YF,et al.RNA interference by expression of shorthairpin RNAs suppresses bcl-xL gene expression in nasopharyngealcarcinomacells[J].ActaPharmacologicaSinica,2005,26(2):228-234.
Establishment and effection of Saos-2 Stable cell linesw ith Saos-2 gene knockdown and new thinking for therapy
ShiXingchen1, Geng Zhe2,ShiXinhe3.1.DepartmentofOrthopaedics,the Second People'sHospital ofLanzhou City,Lanzhou 730046,China;2.SchoolofBasic Medicine,Lanzhou University,Lanzhou 730000,China;3.Department ofCentral Laboratory,Lanzhou University Second Hospital,Lanzhou 730030,China
A
1004-2725(2016)09-0646-04
甘肃省青年科技基金计划(项目编号:1506RJYA315)
730046甘肃兰州,兰州市第二人民医院骨科(施星臣);730000甘肃兰州,兰州大学基础医学院生物化学与分子生物学研究所(耿哲);730030甘肃兰州,兰州大学第二医院中心实验室(施鑫鹤)
施星臣,E-mail:shixh@lzu.edu.cn

