氯乙烯非汞合成宏观动力学
张晓光,吴 同,袁向前,宋宏宇
华东理工大学化学工程联合国家重点实验室,上海 200237
氯乙烯非汞合成宏观动力学
张晓光,吴 同,袁向前,宋宏宇
华东理工大学化学工程联合国家重点实验室,上海 200237
在内循环无梯度反应器中研究了铜系催化剂氯乙烯非汞合成的反应特性。在转速为1 000~4 000 r/min,乙炔空速80~170h-1,乙炔和氯化氢物质的量比为0.5~2.0,反应温度180~300℃的实验条件下,考察了转速、空速、原料配比和反应温度对氯乙烯非汞合成反应的影响。选取幂函数动力学模型,根据实验数据,运用线性最小二乘法,回归得到表观活化能为28 kJ/mol,C2H2的反应级数为1.43,HCl的反应级数为2.11。残差分析和统计检验表明,动力学模型是适定的。
氯乙烯 非汞催化剂 动力学
氯乙烯(VCM),又名乙烯基氯(Vinyl chloride),是一种基本的化工原料。氯乙烯的生产方法主要有乙烯法、乙炔法和乙烷法[1]。我国生产氯乙烯常用乙炔法和乙烯法[2],但主要采用煤路线的乙炔法[3]。乙炔法使用的催化剂以活性炭为载体,浸渍吸附质量分数为10%~12%左右的氯化汞制备而成,由于汞升华及中毒等原因,催化剂活性下降到一定程度后需进行更换。另外,我国每吨聚氯乙烯消耗氯化汞催化剂约1.2 kg(以氯化汞的平均质量分数为11%计),占全国汞消耗量的60%,约1.056×106kg[4],对环境造成很大的污染。同时,由于国际上对汞出口的禁止和我国汞矿石可开采品位的降低,汞的价格将一路走高[5],因此乙炔法非汞合成氯乙烯催化剂及工艺的研究引起重视。王声洁等[6-8]对Au系催化剂进行了研究,Mitchenko等[9]研究了K2Pt2Cl6催化剂,这两种催化剂的转化率和选择性都很高,但存在着高成本的问题。魏小波等[10]制备了Bi,Cu复合磷酸盐催化剂,活性有汞催化剂的1/3,但由于BiCl3的流失和反应过程中积炭,催化剂很快失活。这些贵金属催化剂均因成本高,稳定性差而难以实现工业化。本工作采用华东理工大学催化所和上海氯碱公司共同开发的铜系催化剂(已经过5 000h的寿命考评),研究搅拌转速、空速、原料配比和温度对氯乙烯非汞合成反应的影响,并建立了动力学模型,为探索该工艺的反应器选型和较优工艺条件提供依据。
该反应的反应方程式为:

副反应方程式为:

1 实验部分
1.1实验装置及流程
实验采用山东威海化工机械有限公司生产的BSI-2A型内循环无梯度反应器,实验装置如图1所示。实验步骤为:称取5.7 g球形催化剂(∅1.5mm)装入无梯度反应器篮筐中,按图1搭建实验装置并检查气密性。打开N2钢瓶,将减压阀调至0.2 MPa,保持整个反应体系充满N2。通冷却水,打开转子电动机,调至所需转速。设定预热器和反应器温度,调节加热电压至220 V。等待反应器升温到设定值并且预热器和反应器的温度稳定。为模拟一定的转化率和反应物配比,打开2,3和4号钢瓶,调节V2,V3和V4,使通入原料气体和氯乙烯的气体流量稳定在实验所需流量,同时记录下反应时间。待反应20倍停留时间后,在锥形瓶出口处取样进行气相色谱分析,求出反应的转化率和选择性。

图1 反应装置Fig.1 Experimental apparatus
1.2实验条件
动力学实验条件为反应温度180~300℃;压力0.101 MPa;乙炔(A)空速80~170h-1;乙炔和氯化氢(B)物质的量比为0.5~2.0;乙炔进口转化率(xA 0)为0.00~0.95。其中,xA 0通过下式计算:

式中:fA 0和fC 0分别为乙炔和氯乙烯初始摩尔流量,mol/h。
1.3分析方法
实验样品由气相色谱仪进行定量分析。色谱柱采用中科院大连化物所的 PEG-20M。设定检测器温度280℃,注样器气化温度150℃。色谱柱温升程序如下:保持30℃初始温度10min,以20℃/min的速率升温至200℃并保持3min。通过外标法得到乙炔和氯乙烯的摩尔分数分别为yA和yC。若1,1-二氯乙烷和1,2-二氯乙烷的总物质的量为fD,可以得到:
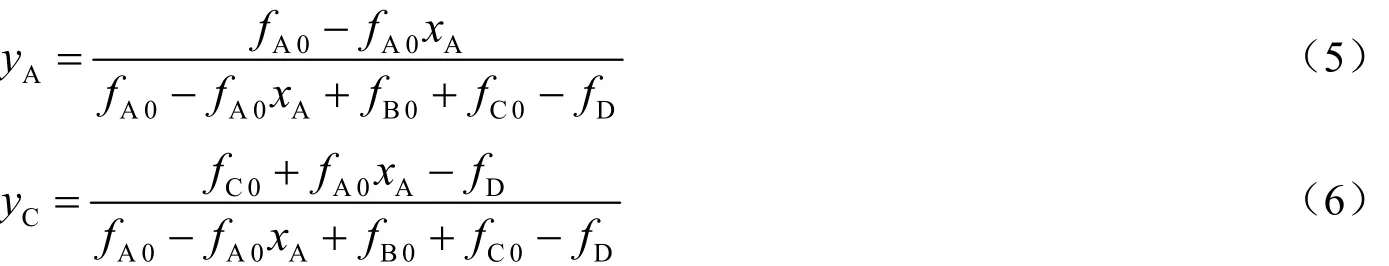
式中,fB 0为氯化氢初始摩尔流量,mol/h。
已知fA 0,fB 0和fC 0,可以求出xA和fD。可以通过下式求得各个组分的物质的量:

总量(fT)为:

选择性(β)为:

2 结果与讨论
2.1转速对转化率的影响
在进料乙炔和氯化氢物质的量比为1.0∶1.5,温度220℃,乙炔空速80~170h-1下,考察转速对乙炔转化率的影响,结果如图2所示。由图可见,在空速一定的条件下,随着篮筐转速的增加,反应转化率也随之增加。无论哪一种空速情况,篮筐转速超过3 000 r/min后,转化率增加不明显。
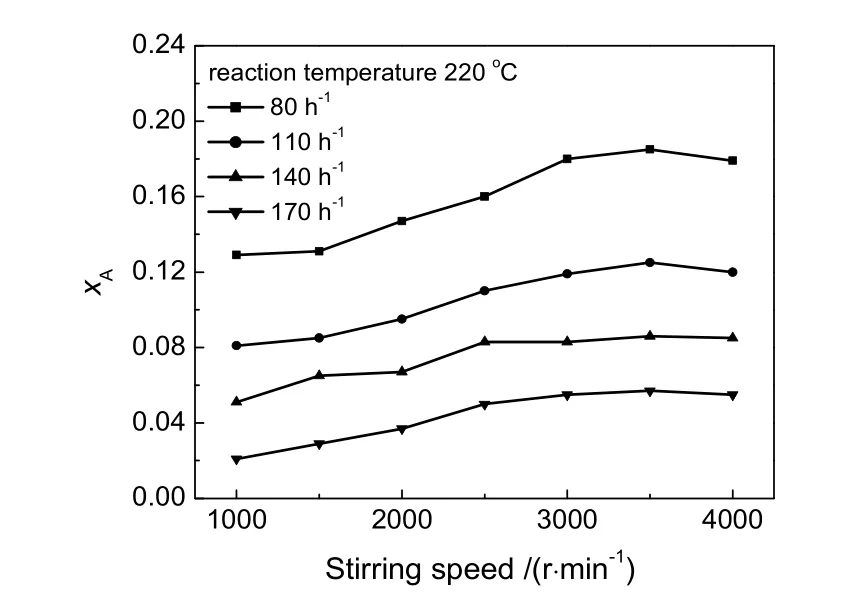
图2 不同空速下转速对转化率的影响Fig.2 Effect of stirring speed on conversion of acetylene
在进料乙炔和氯化氢物质的量比为1.0∶1.5,空速140h-1,温度180~260℃下,考察转速对乙炔转化率的影响,结果如图3所示。从图可看出,反应温度一定,反应的转化率随转速的增加而增大,但转速增加到3 000 r/min以上时,反应转化率提高不明显。说明外扩散已经消除,在后续的实验中,将转速控制在3 000 r/min。

图3 不同温度下转速对转化率的影响Fig.3 Effect of stirring speed on conversion of acetylene
2.2空速对转化率影响
在反应温度180~260℃,乙炔和氯化氢物质的量比为1.0∶1.5下,考察空速对乙炔转化率的影响,结果如图4所示。由图可知,反应温度一定,反应转化率随着空速的增加而减小。空速增大,乙炔、氯化氢与催化剂表面接触几率减小,导致了乙炔转化率的降低。空速表明的是反应器的处理能力[11],在保证产品收率的条件下应尽量提高空速。

图4 空速对转化率的影响Fig.4 Effect of space velocity on conversion of acetylene
2.3温度和配比对反应的影响
在乙炔空速140h-1的条件下,考察不同乙炔和氯化氢物质的量比和温度对乙炔转化率的影响,结果如图5所示。由图可看出,当氯化氢摩尔分数增加时,反应转化率提高。但配比为1.0∶2.0比1.0∶1.5的转化率提高不明显。反应转化率随着温度的升高而增大。此反应为气固相催化反应,反应物分子在催化剂上吸附、活化需要能量,温度升高,会加速反应物分子的活化,从而提高反应速率。最高反应温度应小于催化剂的失活温度。
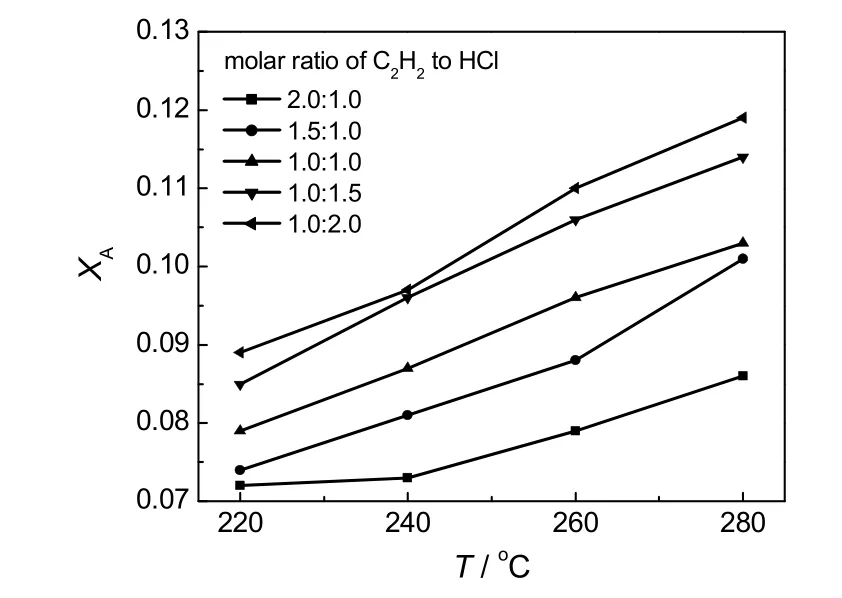
图5 反应温度对转化率的影响Fig.5 Effect of reaction temperature on conversion of acetylene
在空速140h-1,乙炔进口转化率0.5条件下,考察温度对选择性的影响,结果如图6所示。由图可以看出,温度升高,反应的选择性下降。在相同的温度条件下,乙炔浓度升高,反应的选择性升高。
3 模型参数的确定
3.1数据处理
在压力为0.101 MPa,乙炔空速为80~170h-1,乙炔和氯化氢物质的量比为0.5~2.0,乙炔进口转化率为0~0.95,温度为180~300℃条件下,测得了136组动力学实验数据。将136组数据的浓度换算出乙炔的反应速率[12]:

其中:

式中:r为反应速率,mol/(g.h);qv为气体体积流量,L/h;Wcat为催化剂质量,g;C为摩尔浓度,mol/L。P为压力,Pa;T为温度,K;R为气体常数。
3.2参数拟合
假定此反应对于C2H2为a级反应,对HCl为b级反应,宏观动力学方程采用幂函数形式:

将式(15)进行线性化处理后,得到下式:

利用MATLAB回归分析工具箱,得到此反应的动力学参数k0为10.50,活化能E为32.87 kJ/mol,a为1.43,b为2.11。最终动力学模型为:

3.3残差检验
由动力学得到的模型计算值与实验值比较见图7,残差分析见图8。从图7可看出,大多数的点均匀分布在对角线附近。从图8看出,残差均匀分布在x轴上下,说明得到的计算值和实验值吻合良好。
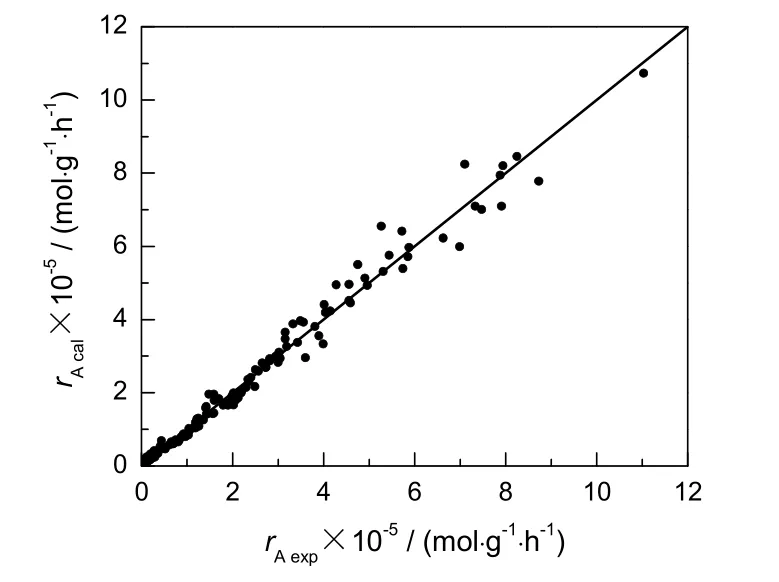
图7 反应速率的实验值与计算值Fig.7 Comparison between experimental and calculated data
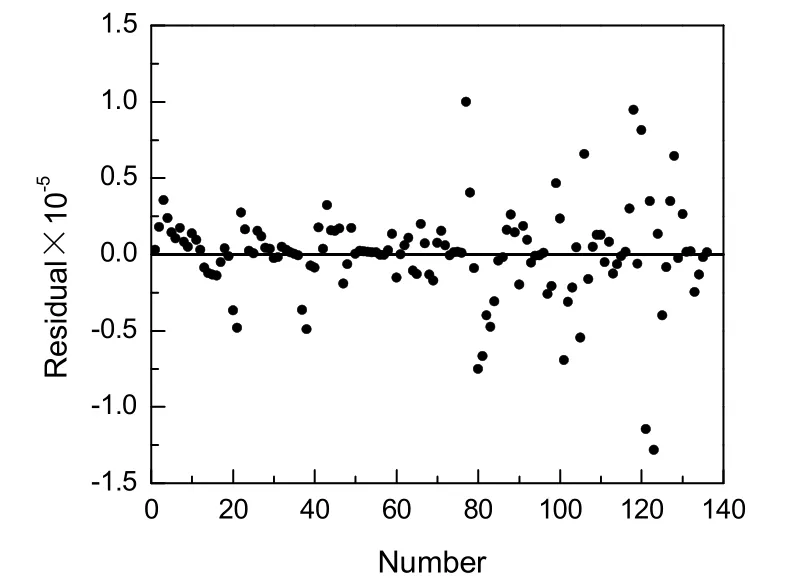
图8 计算值和模拟值之间的残差分布Fig.8 Residual distributions of experimental and calculated data
3.4统计检验
对动力学方程进行F统计和相关指数检验,以检验动力学模型对实验数据的实用性。相关系数ρ2是决定性指标,F为回归均方和与模型残差均方和之比。

式中:F为统计量;M为实验次数;MP为参数个数。
一般认为ρ2大于0.9,F大于l0FT时,模型是适定的。FT为显著水平5%相对应自由度(Mp,M-Mp-1)下的F表值,可查表获得。计算得动力学模型的相关指数ρ2为0.991,大于0.9,F统计量为56.282,大于10 FT(5,131),约等于44.0。综上所述,动力学模型是适定的。
4 结 论
本工作采用的催化剂用于无汞催化合成氯乙烯是可行的。当无梯度反应器转速控制在3 000 r/min以上时,反应器已消除外扩散。实验得到较优的操作条件为乙炔空速110h-1,乙炔和氯化氢物质的量比为1.0∶1.5,反应温度220℃。通过实验数据,拟合得到动力学模型,该反应的表观反应活化能为32.873 kJ/mol,C2H2的反应级数为1.43,HCl的反应级数为2.11,统计性检验和残差分析表明模型是适定的。
[1]张学鲁. 低固汞触媒工业应用分析及总结[J]. 中国氯碱, 2008, 32(5):24-26. Zhang Xuelu. Analysis and experience summary of the industrial application of low/solid-mercury catalyst[J]. China Chlor-Alkali, 2008,32(5):24-26
[2]邴涓林. 2012年中国PVC产业状况分析[J]. 聚氯乙烯, 2013, 41(5):1-8. Bing Juanlin. Analysis on situation of China's PVC industry in the year 2012[J]. Polyvinyl Chloride, 2013, 41(5):1-8.
[3]韩钦生, 孙 芳. 乙炔法PVC与乙烯法PVC对比[J]. 聚氯乙烯, 2009, 37(9):5-7. Han Qinsheng, Sun Fang. Contrast analysis on PVC produced by ethylene method and acetylene method[J]. Polyvinyl Chloride, 2009, 37(9):5-7.
[4]钱伯章, 朱建芳. 二氯乙烷和氯乙烯单体的生产技术与市场分析[J]. 中国氯碱, 2008, 28(1):1-3. Qian Bozhang, Zhu Jianfang. Production technology and market analysis of ethylene dichloride and vinyl chloride monomer[J]. China Chlor-Alkali, 2008, 28(1):1-3.
[5]戎兰狮. 中国电石行业现状及电石法聚氯乙烯发展前景分析[J]. 中国氯碱, 2011, 31(12):1-5. Rong Lanshi. Calcium carbide industry current situation of China and analysis of development prospect of PVC by calcium carbide process[J]. China Chlor-Alkali, 2011, 31(12):1-5.
[6]王声洁, 沈本贤, 肖卫国, 等. 乙炔氢氯化反应高分散载金催化剂的制备及催化性能[J]. 石油学报, 2009, 38(3):249-253. Wang Shengjie, Shen Benxian, Xiao Weiguo, et al. Preparation and catalytic performance of high dispersed gold-supported catalysts for hydrochlorination of acetylene[J]. Acta Petrolei Sinica, 2009, 38(3):249-253.
[7]王声洁, 沈本贤, 肖卫国, 等. Au-K/C催化剂用于乙炔氢氯化反应制氯乙烯的催化性能[J]. 华东理工大学学报, 2010, 36(1):245-248. Wang Shengjie, Shen Benxian, Xiao Weiguo, et al. Catalytic activity of Au-K/C catalyst for acetylene hydrochlorination[J]. Journal of East China University of Science and Technology, 2010, 36(1):245-248.
[8]王芳超, 高管俊, 胡瑞生, 等. 炭载体对乙炔氢氯化反应金催化剂催化性能的影响[J]. 化学进展, 2010, 29(12):2304-2308. Wang Fangchao, Gao Guanjun, Hu Ruisheng, et al. Impact of carbon support on gold catalyst performance for acetylene hydrochlorination[J]. Chemical Industry and Engineering Process, 2010, 29(12):2304-2308.
[9]Mitchenko S A, Khomutov E V, Shubin A A, et al. Catalytic hydrochlorination of acetylene by gaseous HCl on the surface of mechanically preactivated K2Pt2Cl6salt[J]. Journal of Molecular Catalysis A:Chemical, 2004, 212:345-352.
[10]魏小波, 魏 飞, 骞伟中, 等. 铋复合盐在乙炔氢氯化反应中的催化作用[J]. 过程工程学报, 2008, 8(6):1218-1222. Wei Xiaobo, Wei Fei, Qian Weizhong, et al. Catalysis of bismuth complex salt in vapor phase hydrochlorination of acetylene[J]. The Chinese Journal of Process Engineering, 2008, 8(6):1218-1222.
[11]Fogler H S. Elements of chemical reaction engineering[M]. Third edition. Bermingham:Pearson Hall PTR, 1999:448-479.
[12]程振民, 朱开宏, 袁渭康. 高等反应工程教程[M]. 上海:华东理工大学出版, 2010, 22-23.
Macro-Kinetics of Acetylene to Vinyl Chloride over Nonmercury Catalyst
Zhang Xiaoguang, Wu Tong , Yuan Xiangqian, Song Hongyu
East China University of Science and Technology, Shanghai 200237, China
The reaction characteristics of acetylene to vinyl chloride over copper-based non-mercury catalyst were studied in a non-gradient inner loop reactor. The experiment was performed at the stirring speed of 1 000-4 000 r/min, acetylene space velocity of 80-170h-1, molar ratio of acetylene to hydrogen chlorine of 0.5-2.0, reaction temperature of 180-300℃. An exponential kinetic model was established and the linear least squares method was used to estimate parameters of the proposed models based on the experimental data. The calculation showed that activation energy was 32.87 kJ/mol and reaction orders were 1.43 for acetylene and 2.11 for hydrogen chloride, respectively. The residual error analysis and the statistic tests showed that the proposed macro-kinetic model was reliable and adequate.
vinyl chloride; nonmercury catalyst; kinet
TQ222.4+23;TQ018
A
1001—7631 ( 2016 ) 04—0348—06
2015-04-02;
2016-03-22。
张晓光(1989—),男,硕士研究生;袁向前(1956—),男,副教授。E-mail:yuanxiangqian@ecust.edu.cn。

