HPLC法测定陕西商南地产金银花不同采收时间及不同部位中木犀草苷的含量
柯 园,解淑琴,姚 远
(商洛市食品药品检验所,商洛 726000)
HPLC法测定陕西商南地产金银花不同采收时间及不同部位中木犀草苷的含量
柯园,解淑琴,姚远
(商洛市食品药品检验所,商洛726000)
目的建立高效液相色谱法测定金银花不同部位(花、叶和茎)中木犀草苷的含量。方法应用KromasilC18色谱柱(150mm×4.6mm,5μm);以乙腈-5mL·L-1冰醋酸溶液为流动相,按1∶9梯度洗脱至3∶7;流速为1.0mL·min-1;柱温为30 ℃;检测波长为350nm。结果木犀草苷存在于金银花的花、叶和茎中,随着花的成熟,花中含量逐渐提高,叶和茎中含量逐渐降低。结论HPLC法操作简便、结果准确,适用于金银花中木犀草苷的测定。
金银花;木犀草苷;高效液相色谱法
金银花又称双花,来源于忍冬科忍冬属植物忍冬的干燥花蕾,作为传统常用中药,已有上千年的用药历史[1]。其性甘、寒,归肺、心、胃经,具有清热解毒、疏散风热的功能[2]。金银花富含挥发油、黄酮类、有机酸和三萜皂苷类等[3]成分。2010年版《中国药典》[4]规定,金银花中的标志性成分是绿原酸和木犀草苷,而是否含有木犀草苷是区别正品金银花和同科的山银花、忍冬藤的主要化学指标,也是正品金银花与山银花等同科植物在疗效上存在差异的主要原因。以木犀草素及其木犀草苷为代表的黄酮类化合物,具有抗炎、抗菌、抗病毒和抗癌等多种药理作用[5-7]。“巨花一号”金银花在商南县富水镇王家楼村长势良好,适应性强、易栽培、易成活、耐旱涝,在山坡和沟台地均能种植。据报道,金银花叶片粗提物的抑菌效果基本等同于金银花粗提物,具有较高的开发利用价值[8]。
1 仪器与试药
1.1仪器高效液相色谱仪(日本岛津制作所,20A);超声波提取器(昆山市超声仪器有限公司);电子分析天平(瑞士梅特勒托利多仪器公司,万分之一)。
1.2试药木犀草苷对照品(中国食品药品检定研究院,批号:111720-201307,质量分数:94.0%);甲醇和乙腈为色谱纯(美国赛默飞世尔科技公司);冰醋酸和乙醇为分析纯;水为纯化水。
2 方法与结果
2.1色谱条件色谱柱:KromasilC18柱(150mm×4.6mm,5μm);流动相:乙腈(A)-5mL·L-1冰醋酸溶液(B),进行梯度洗脱,见表1;流速:1mL·min-1;柱温:30 ℃;进样量:10.0μL;检测波长:350nm[4]。
表1梯度洗脱程序
Tab.1Thegradientelutionprogram

时间/min流动相A/%流动相B/% 0~1510→2090→80 15~302080 30~4020→3080→70
2.2样品采集于2013年4月25日,4月30日和5月9日,从商南县富水镇王家楼村金银花产业基地采收金银花不同部位(花、叶和茎)样品若干,带回实验室阴干后密封,阴凉处保存。
2.3样品处理分别称取2.0g不同采收时间、不同部位样品,粉碎,将其分别用体积分数为70%的乙醇溶解,定容于50mL的棕色量瓶中,超声1h,放冷,再称定质量,用体积分数为70%的乙醇补足减失的质量,摇匀,滤过。精密量取续滤液10mL,回收溶剂至干,残渣再用体积分数为70%的乙醇溶解,转移至5mL棕色量瓶中,加体积分数为70%的乙醇至刻度,即得供试品溶液。
2.4对照品溶液的制备精密称取木犀草苷对照品4.0mg,用体积分数为70%的乙醇溶液配制成质量浓度为0.040mg·mL-1的对照品溶液,用0.45μm的滤膜过滤,备用。
2.5线性关系考察精密吸取木犀草苷对照品溶液1,2,4,6,8和10mL,置于5mL棕色量瓶中,定容至刻度,按照上述色谱条件进行测定,记录峰面积,得到直线回归方程Y=33 613 021.230 1X-5 416.076 2(Y代表峰面积,X代表木犀草苷质量浓度/mg·mL-1),r=0.999 8,结果表明,木犀草苷对照品质量浓度在0.008~0.080mg·mL-1范围内呈良好的线性关系。
2.6精密度实验取木犀草苷对照品溶液,按照上述色谱条件连续进样6次,精密度良好(RSD值为0.7%,n=6)。
2.7重复性实验取5月10日金银花的花1份,按照上述方法平行制备样品溶液4份,分别进行测定,结果表明,木犀草苷的重复性良好(RSD值为0.1%,n=4)。
2.8稳定性实验取4月30日金银花的花样品溶液1份,分别在0,2,4,8,12和24h进行测定,结果表明,供试品在室温条件下,24h内基本稳定(RSD值为0.8%,n=6)。
2.9回收率实验精密称取已知木犀草苷含量的5月10日金银花的花1.000g,按照上述方法制备样品溶液2份,其中1份加入木犀草苷对照品溶液(质量浓度为0.040mg·mL-1)2.0mL,按照上述方法进行测定,回收率为95.7%。
2.10测定结果取制备好的金银花样品溶液和对照品溶液,按照上述方法进行测定,结果表明,木犀草苷普遍存在于金银花的花、叶和茎中,其中以花中含量较高,超过《中国药典》规定的1倍多,随着采收时间不同含量亦有变化,近花期含量最高;其次是叶,含量也达到《中国药典》的规定水平,并随着花期临近,含量逐渐降低,这可能是木犀草苷向花中转移的结果;茎中含量最少,与《中国药典》的规定值相差较大,不具有实际的药用价值。液相色谱图见图1。
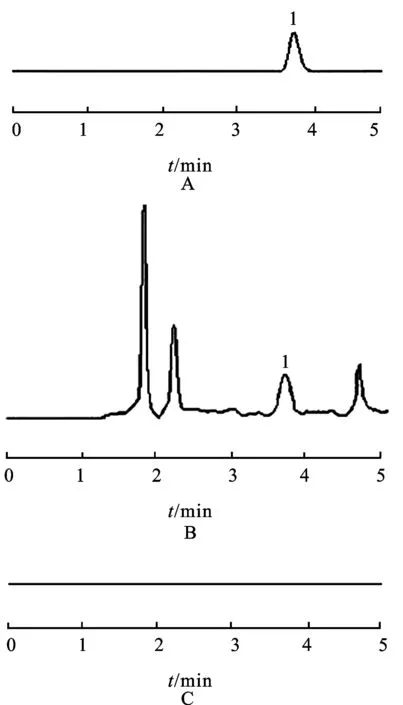
图1高效液相色谱图
A.对照品;B.供试品;C.阴性对照;1.木犀草苷
Fig.1HPLCchromatograms
A.referencesubstance;B.testsample;C.negtivecontrol;1.luteoloside
3 讨论
3.1色谱条件的选择在中药化学成分检测中也不难看到,中药因其成分复杂多变,质量评价和标准还存在很多问题[9]。本文选用比较成熟的《中国药典》方法,色谱柱为KromasilC18柱,流动相及梯度洗脱程序同《中国药典》,实验结果显示,木犀草苷出峰快,分离效果较好,可作为商南产金银花中木犀草苷含量测定用方法。
3.2采收时间的选择实验用样品均为商南金银花产地采样,根据金银花的花蕾形成过程,时间间隔分别为3,3和10d,能较好地反映金银花自花蕾形成到含苞待放时间过程中木犀草苷在花、叶和茎中的转移和分布,通过测定不同采收时间金银花中木犀草苷的含量,为后期研究金银花最佳采收时间提供参考依据。文献报道[10],金银花中有效成分在1日之内也会不断发生变化,早晨和下午采收都有区别,因此,通过测定有效成分含量变化,不断优化金银花采收时间,最大限度地发挥金银花药理作用。
3.3提取溶剂的选择取金银花粉末0.1g,精密称定,分别加入体积分数为25%, 50%和70%的甲醇25mL以及体积分数为25%,50%和70%的乙醇25mL,超声提取30min。结果以体积分数为70%的甲醇和体积分数为70%的乙醇作溶剂提取木犀草苷含量高,考虑到二者提取的量几乎一致,而前者成本高,毒性大,所以选择体积分数为70%的乙醇作为提取溶剂[11]。
实验结果表明,木犀草苷存在于金银花的花、叶和茎中,随着花的成熟,花中含量逐渐提高,叶和茎中含量逐渐降低,但花和叶中木犀草苷含量均能达到《中国药典》的规定标准,说明金银花叶也具有一定的药用价值。通过比较木犀草苷含量的变化,可以确定在金银花含苞待放时采收品质最佳[12],此时花中木犀草苷含量最高。这可能与金银花在生长过程中一些物质含量在不断发生变化和转移有关,同时也与日光、天气变化等因素有关。也有相关文献报道,金银花叶中木犀草苷高于花中的含量[13-14],这可能与金银花的产地、采收时间等因素有关。通过测定金银花中木犀草苷的含量变化,可为商南金银花产业基地采收金银花时间提供一定的参考,提高陕西产金银花的市场竞争力[15]。
[1]梁萱,赵建军,梁永锋.人工种植金银花中绿原酸含量测定和提取工艺研究[J].西北药学杂志,2013,28(3):228-230.
[2]庄丽,张超,阿里穆斯.金银花的药理作用与临床应用研究进展[J].辽宁中医杂志,2013,40(2):378-380.
[3]刘雄,高建德.金银花质量控制、化学成分及药理学研究进展[J].甘肃中医学院学报,2006,23(4):46-49.
[4]国家药典委员会.中国药典2010年版[S].一部.北京:中国医药科技出版社,2010:205-206.
[5]马双成,刘燕,毕培曦,等.金银花药材中抗呼吸道病毒感染的黄酮类成分的定量研究[J].药物分析杂志,2006,26(4):426-430.
[6]管仁伟,曲永胜,顾正位,等.木犀草苷的药理作用研究[J].中国野生植物资源,2014,33(1):1-3.
[7]王继双,何焱,张文静,等.木犀草苷的药理作用研究进展[J].生命科学,2013,5(6):560-565.
[8]梅林.秀山金银花、叶、茎中绿原酸的检测及其抑菌作用研究[J].中国药业,2007,16(3):5-6.
[9]赵超,李会军,陈君,等.中药复杂成分解析与质量评价的研究进展[J].中国药科大学学报,2012,43(3):283-288.
[10]徐李,曾忠良,徐晓玉,等.不同采收时间、花期及干燥方法对秀山金银花中绿原酸含量的影响[J].安徽农业科学,2010,38(6):2938-2939.
[11]辛华,丰杰,程若敏,等.HPLC测定不同产地金银花中绿原酸和木犀草苷[J].中国实验方剂学杂志,2011,17(2):60-63.
[12]李强,任茜,张永良.生境、采收期、贮藏时间等因素对秦岭金银花绿原酸含量的影响[J].中国中药杂志,1994,19(10):594-595,638.
[13]郭玉,郑兴,曹轩,等.RP-HPLC测定金银花叶中木犀草苷的含量[J].中成药,2009,31(8):1299-1300.
[14]何孝金.HPLC法测定金银花的花、叶、茎中绿原酸和木犀草苷的含量[J].光明中医,2013,28(10):2046-2049.
[15]孙宁宁,程巧凡,郭增军.不同种源金银花陕西引种后主要成分的比较分析[J].西北药学杂志,2014,29(4):358-360.
Determination of the contents of luteoloside of different parts and harvest time in Lonicera japonica that collected from Shaanxi Shangnan by HPLC
KE Yuan, XIE Shuqin,YAO Yuan
(Shangluo Institute for Food and Drug Control,Shangluo 726000,China)
ObjectiveToestablishanHPLCmethodforthedeterminationofluteolosideindifferentpartsofLonicera japonica(flowers,leavesandstems).MethodsSamplesweredeterminedonaKromasilC18column(150mm×4.6mm,5μm).Themobilephaseofisolatingluteolosidewasacetonitrileand5mL·L-1aceticacid,gradientelutionfrom1∶9to3∶7.Theflowratewas1.0mL·min-1,thecolumntemperaturewas30 ℃,andtheUVdetectionwavelengthwasat350nm.ResultsLuteolosideexistsinLonicera japonicaflowers,leavesandstems.Astheflowermatured,thecontentofflowersincreasedwiththecontentsofleavesandstemsdecreasedgradually.ConclusionHPLCmethodissimpleandaccurate,andcanbeusedforthedeterminationofluteolosideinLonicera japonica.
Lonicera japonica;luteoloside;HPLC
10.3969/j.issn.1004-2407.2016.05.006
R927.2
A
1004-2407(2016)05-0459-03
2015-10-20)

