多聚免疫球蛋白受体(pIgR)基因多态性及其与仔猪腹泻关系
王希彪,童县伟,崔世泉,狄生伟,李富荣,刘志然,宋 斌(东北农业大学动物科学技术学院,哈尔滨 150030)
多聚免疫球蛋白受体(pIgR)基因多态性及其与仔猪腹泻关系
王希彪,童县伟,崔世泉,狄生伟,李富荣,刘志然,宋斌
(东北农业大学动物科学技术学院,哈尔滨150030)
采用PCR-SSCP结合测序方法,在民猪、长白猪两群体中检测pIgR基因外显子1多态性,研究母猪基因多态性与仔猪腹泻关系。结果表明,pIgR基因外显子1存在两个错义突变,第373位C→T导致丙氨酸→缬氨酸变异,第394位A→G导致天冬氨酸→丝氨酸变异。民猪群体有AA、AB和BB三种基因型,长白猪群体有AA和AB两种基因型,两群体基因型分布差异极显著(P<0.01)。民猪群体,不同基因型母猪仔猪腹泻指数和腹泻致死率均存在显著差异(P<0.05),但长白猪群体,仅腹泻指数表现显著差异(P<0.05)。
民猪;pIgR基因;多态性;腹泻;SSCP
王希彪,童县伟,崔世泉,等.多聚免疫球蛋白受体(pIgR)基因多态性及其与仔猪腹泻关系[J].东北农业大学学报,2016,47 (4):10-15.
Wang Xibiao,Tong Xianwei,Cui Shiquan,et al.Polymorphism ofpIgRgene and its relation with piglet diarrhea[J].Journal of Northeast Agricultural University,2016,47(4):10-15.(in Chinese with English abstract)
网络出版时间2016-4-22 10:00:48[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160422.1000.002.html
多聚免疫球蛋白受体(Polymeric immunoglobu⁃lin receptor,pIgR)为免疫球蛋白超家族中Ⅰ型跨膜蛋白,是多聚免疫球蛋白A(Polymeric IgA,pIgA)和多聚免疫球蛋白M(Polymeric IgM,pIgM)特异性受体[1],在黏膜免疫中发挥重要作用。乳腺黏膜上皮细胞中,pIgR胞外部分与黏膜固有层中的pIgA结合,经穿胞转运将pIgA从上皮细胞基底侧膜转运到顶膜。Mostov研究发现,在硫醇依赖性蛋白酶作用下,pIgR胞外部分脱落,形成分泌片SC(Secretory component,SC),SC和pIgA一起分泌到乳中,形成分泌型IgA(sIgA)[2]。sIgA对酸、碱以及蛋白酶水解作用有较强抵抗力,在消化道中维持其抗体活性。Luton等研究表明,乳中sIgA进入仔猪消化道后附着在消化道黏膜表面,可阻止病原微生物对肠道黏膜上皮黏附作用,促进病原微生物排出,减少肠道疾病发生[3]。未与pIgA结合的SC称为游离SC,直接参与机体非特异性免疫活动[4]。Willer等研究发现,人乳中游离SC可与福氏及宋氏志贺菌结合,预防新生儿痢疾[5]。
目前,对pIgR研究多集中在人类黏膜免疫方面,有关pIgR基因多态性是否影响仔猪腹泻鲜见报道。因此,本研究选择抗腹泻能力差别较大的民猪和长白猪为试验对象[6-7],通过PCR-SSCP结合测序方法分析猪pIgR基因外显子1多态性,研究基因多态性与仔猪腹泻性状和生长性状关系,旨在寻找与抗腹泻相关的pIgR遗传标记,发掘民猪抗腹泻遗传优势。
1 材料与方法
1.1材料
1.1.1试验动物
黑龙江省兰西县种猪场民猪母猪70头,对应仔猪720头;长白母猪43头,对应仔猪410头。
1.1.2耳组织采集
采集70头民猪母猪和43头长白猪母猪耳组织,约0.5 g,置于装有70%乙醇Ep管中,-20℃保存,提取猪基因组DNA。
1.1.3仔猪腹泻评分记录
仔猪出生至35日龄,每日逐头检查哺乳仔猪肛门,根据有无粪便污染,是否红肿及圈内仔猪粪便状况评分,记录仔猪死亡原因及头数。腹泻状况评分参照文献[8],见表1。腹泻指数=粪便状况评分之和/供试验猪总头数,指数越高,腹泻越严重;腹泻致死率(%)=腹泻死亡头数/总头数×100%。
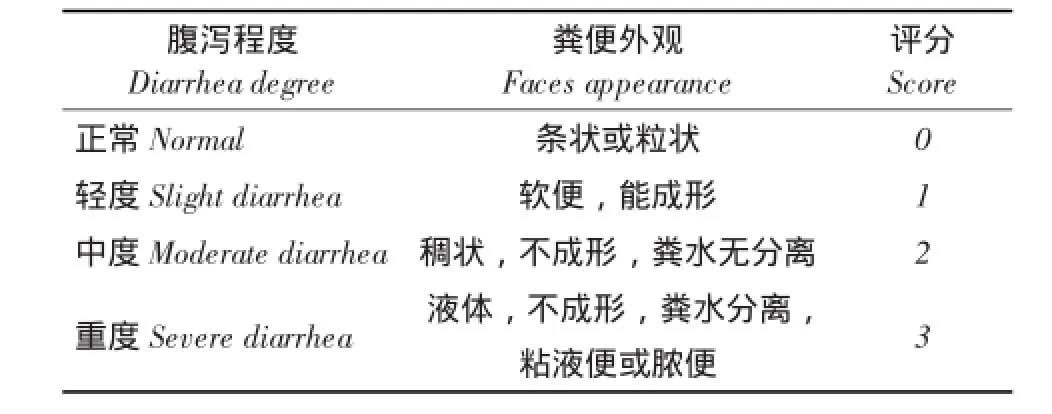
表1 腹泻状况评分标准Table 1 Evaluation standard of diarrhea degree
1.1.4仔猪生长性能测定
称量每头仔猪出生重和35日龄重,计算哺乳期仔猪平均日增重,平均日增重=(35日龄重-初生重)/35。
1.1.5试验试剂
三氯甲烷、Tris饱和酚、蛋白酶K(Proteinase K)、十二烷基硫酸钠、乙二胺四乙酸二钠、DL2000marker、琼脂糖、丙烯酰胺、甲叉双丙烯酰胺、甲醛、硝酸银、乙醇等分析纯等级试剂均购自哈尔滨适合生物科技有限公司。
1.1.6主要仪器和设备
梯度PCR仪,购自德国Biometro公司;冷冻离心机,购自Bakman公司;凝胶成像系统,购自美国UVP公司;超纯水仪,购自美国Milli-Q公司;紫外分光光度计Ultrospec 1000,购自美国Phamacia公司;热循环仪2219,购自德国Bromma公司;DYY-Ⅲ33A型水平电泳槽,购自北京市六一仪器厂;垂直板电泳槽,购自北京东方特力有限公司;电子天平BL610,购自德国塞多利斯公司;电子恒温水浴锅DK98-1,购自天津市泰特斯仪器有限公司。
1.2方法
1.2.1DNA提取与检测
采用酚-氯仿法提取耳组织基因组[9],1.5%琼脂糖凝胶电泳和分光光度计分别检测DNA质量和浓度,浓度合格DNA稀释到200 ng·μL-1。
1.2.2引物设计与合成
根据猪pIgR基因序列(NCBI ID:397315),Primer 5.0设计引物P1(F:5'CCCTGCCCCTCATCCT 3'R:5'TCTTCCCTCTGGTCTCACCT 3'),扩增外显子1(680 bp),测序寻找SNP位点;根据检测到的SNP位点设计引物P2(F:5'ATATACATCTGCCAG⁃GCTGG R:5'TGTTGATGACCACATTGCAG),扩增包含SNP位点的基因片段(193 bp),用于SSCP分型。引物由哈尔滨适合生物科技有限公司合成。
1.2.3PCR反应条件及扩增程序
PCR反应体系(20 μL):ddH2O 7 μL、DNA模板1 μL、上下游引物各0.3 μL、2×Power Taq PCRmasterMix 10 μL。
PCR扩增程序:94℃预变性5min;94℃变性30 s,55.1℃退火30 s,72℃延伸30 s,29~33个循环,72℃延伸8min,扩增产物4℃保存备用。
1.2.4测序
民猪和长白猪两个群体中,挑选12头对应仔猪腹泻程度差异较大母猪进行外显子1测序。
1.2.5SSCP检测
PCR产物2 μL加6 μL上样缓冲液(98%甲酰胺,0.025%二甲苯青,0.025%溴酚蓝),100℃变性10min、冰浴5min,取2 μL样品点样于14%非变性聚丙烯酰胺凝胶。室温条件下,150 V电泳15 h,电泳结束后,银染显色和基因分型。
1.2.6数据统计及分析
采用Excel 2010计算不同群体基因型频率和基因频率;利用SPSS 17.0软件进行卡方检验,判断两群体基因型分布是否存在差异,计算不同群体基因纯合度(Ho)、杂合度(He)、有效等位基因数(Ne)、多态信息含量(PIC);采用Duncan's检验多重比较和差异显著性分析pIgR基因型与腹泻性状和生长性状关系。
2 结果与分析
2.1PCR扩增
pIgR两条引物扩增结果见图1和2,目的基因特异性好、条带清晰,可用于后续试验。
2.2测序及SSCP分型结果
pIgR外显子1存在两个SNP位点,第373位 C→T导致丙氨酸→缬氨酸变异,第394位A→G导致天氨酸→丝氨酸变异,测序峰图见图3。针对两个突变位点SSCP分型发现,两位点仅存在AA、BB和AB三种基因型,AA型为野生型,BB型为两位点同时突变型,AB型为两位点同时杂合型,SS⁃CP分型见图4。
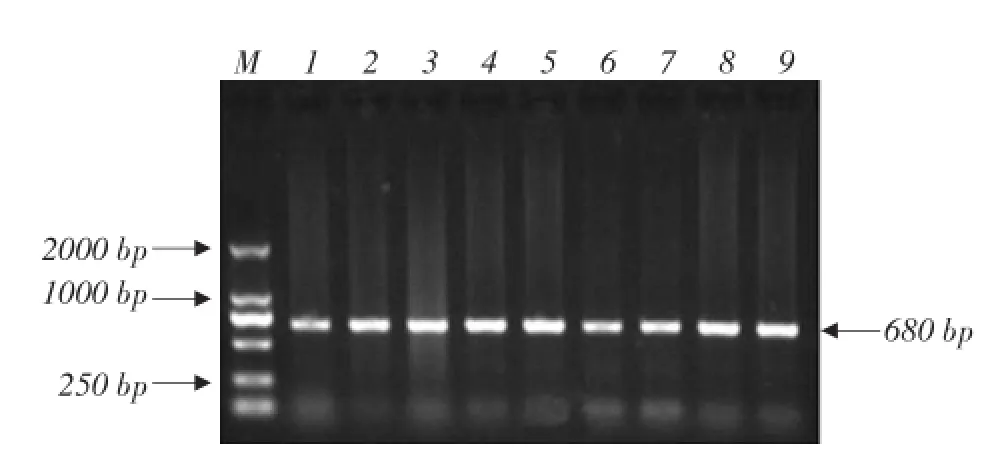
图1 引物P1 PCR扩增结果Fig.1 PCR amplification result of primer P1

图2 引物P2 PCR扩增结果Fig.2 PCR amplification result of primer P2

图3 外显子1部分测序结果,箭头所指为突变位置Fig.3 Partial sequence of exon 1,arrow pointing to the position ofmutations

图4 外显子1的SSCP检测结果Fig.4 SSCP detection results of exon 1
2.3不同品种基因频率与基因型频率
基因频率与基因型频率检测结果见表2。民猪和长白猪均存在A、B两种等位基因,且A为优势等位基因。民猪存在AA、AB和BB三种基因型,AB为优势基因型;长白猪存在AA和AB两种基因型,AA为优势基因型。χ2独立性检验结果表明,民猪和长白猪基因型分布存在极显著差异(P< 0.01)。
2.4遗传多态性分析
由表3可知,民猪杂合度(0.496)和多态信息含量(0.373)高于长白猪(分别为0.068和0.066),民猪表现为中度多态,长白猪表现为低度多态。

表2 民猪、长白猪外显子1等位基因频率和基因型频率Table 2 Allele and genotype frequencies of exon 1 inmin pig and Landrace

表3 民猪、长白猪外显子1多态性分析Table 3 Analysis of exon 1 polymorphism inmin pig and Landrace
2.5不同基因型母猪对应仔猪腹泻程度比较
由表4可知,民猪群体中,不同基因型母猪对应仔猪腹泻指数和腹泻致死率差异显著,具体表现为AB型两腹泻指标均显著低于AA型(P<0.05),低于BB型。长白猪群体中,AB型母猪对应仔猪腹泻指数显著低于AA型(P<0.05),腹泻致死率低于AA型。
2.6不同基因型母猪对应仔猪生长性能比较
由表5可知,民猪群体中,不同基因型母猪对应仔猪35日龄重及平均日增重均有显著差异,AB型35日龄重和平均日增重均显著高于AA型(P<0.05),高于BB型。长白群体中,不同基因型母猪对应仔猪35日龄重和平均日增重均无显著影响,但AB型母猪对应仔猪35日龄重和平均日增重均高于AA型。

表4 外显子1不同基因型母猪仔猪腹泻性状Table 4 Piglet diarrhea traits of different sows on exon 1 genotype

表5 外显子1不同基因型母猪仔猪生长性状Table 5 Piglet growth traits of different sows on exon 1 genotype
3 讨论与结论
本研究通过对民猪和长白猪pIgR外显子1多态性研究发现,两群体共有3种基因型,其中AA 和AB基因型两群体均有分布,BB基因型在长白猪群体中未检测到,原因是BB基因型为长白猪不利基因型,在长期自然或人工选择中被淘汰。χ2检验表明,民猪和长白猪基因型分布存在极显著差异(P<0.01)。
多态信息含量(PIC)、杂合度(He)和有效等位基因数(Ne)均可度量群体内遗传变异[10]。杨述林等对18个中国地方猪种26个微卫星标记研究发现,地方猪种等位基因数高于欧洲猪种[11-12],表明中国地方猪种具有更高遗传变异。本研究对民猪和长白猪pIgR外显子1遗传多态参数比较分析发现,民猪pIgR外显子1的PIC、He和Ne值均高于长白猪,民猪群体变异程度高于长白猪群体。
研究显示,pIgR的SNP与疾病易感性有关,如人类IgA肾炎和鼻咽癌[13-14]。仔猪肠道中,sIgA及游离SC可与致病微生物结合,限制致病微生物对肠细胞粘附,促进病原微生物排出体外,而sIgA及游离SC合成分泌均需pIgR参与。本研究分析pIgR外显子1不同基因型(AA、BB和AB型)母猪对应仔猪腹泻程度差异,结果显示,两群体中AB型母猪对应仔猪抗腹泻能力较强。本试验结果表明,pIgR基因外显子1可作为猪抗腹泻育种潜在遗传标记。
sIgA是母乳重要免疫因子之一,在新生动物肠黏膜免疫中起关键作用。Johansen和Shimada等将小鼠pIgR基因敲除后,小鼠血清中pIgA显著聚积,外分泌液中sIgA含量明显减少[15-16]。Aroeti和Coyue等研究发现,对兔子pIgR基因点突变后,pIgR与pIgA结合能力也明显降低[17-18]。本研究对pIgR SNP分析发现,pIgR外显子1有两个错义突变,三种基因型,不同基因型母猪对应仔猪腹泻程度差异显著。pIgR基因外显子1突变是否改变乳中sIgA含量,进而影响仔猪腹泻,尚需深入研究验证。
[1]唐庆娟,戚欣,耿美玉.多聚免疫球蛋白受体(pIgR)在粘膜免疫中的重要功能[J].中国生物化学与分子生物学报,2007,23(9): 724-729.
[2]Mostov K E.Transepithelial transport of immunoglobulins[J].An⁃nual Review of Immunology,1994,12(1):63-84.
[3]Luton F,Mostov K E.Transduction of basolateral-to-apical sig⁃nals across epithelial cells:ligand-stimulated transcytosis of the polymeric immunoglobulin receptor requires two signals[J].Molbi⁃olcell,1999,10(5):1409-1427.
[4]付金龙,刘沛.SC结构、功能及其临床研究进展[J].世界华人消化杂志,2009,17(3):293-298.
[5]Willer Edam,Lima R de L,Giugliano LG.In vitro adhesion and invasion inhibition of Shigella dysenteriae,Shigella flexneri and Shigella sonnei clinical strains by humanmilk proteins[J].BMCmicrobiol,2004(4):18.
[6]王希彪,黄宣凯,崔世泉,等.民猪与长白猪哺乳仔猪腹泻程度的差异及其对生产性能的影响[J].东北农业大学学报,2014, 45(7):79-82.
[7]王希彪,李建敏,许愿,等.哺乳仔猪腹泻发生时间和程度的品种间差异及对增重的影响[J].东北农业大学学报,2014,45(9): 79-83.
[8]汪蕊,王莉,王希彪.断奶仔猪血清及肠道肠三叶因子ITF水平与腹泻的关系研究[J].东北农业大学学报,2012,43(3):15-18.
[9]卢圣栋.现代分子生物学实验技术[M].北京:中国协和医科大学出版社,1999:9-10.
[10]杨巧丽,孔晶晶,赵生国,等.猪SLA-DRA基因外显子2多态性及其与仔猪腹泻的关联分析[J].畜牧兽医学报,2012,43(7): 1020-1027.
[11]杨述林.十八个中国地方猪品种遗传多样性分析[D].武汉:华中农业大学,2004.
[12]Laval G,Iannuccelli N,Legault C,et al.Genetic diversity of elev⁃en European pigbeerds[J].Genet Sel Evol,2000,32:187-203.
[13]Obara W,Iida A,Suzuki Y,et al.Association of single-nucleo⁃tide polymorphisms in the polymeric immunoglobulin receptor gene with immunoglobulin A nephropathy(IgAN)in Japanese pa⁃tients[J].JHum Genet,2003,48(6):293-299.
[14]Hirunsatit R,Kongruttanachok N,Shotelersuk K,et al.Polymeric immunoglobulin receptor polymorphisms and risk of nasopharyn⁃geal cancer[J].BMC Genet,2003(4):3-11.
[15]Johansen F E,Peknam,Norderhaug I N,et al.Absence of epithe⁃lial immunoglobulin A transport,with increasedmucosal leaki⁃ ness,in polymeric immunoglobulin receptor/secretory componentdeficientmice[J].JExpmed,1999,190(7):915-922.
[16]Shimada S,Kawaguchimm,Kushiro A,et al.Generation of poly⁃meric immunoglobulin receptor-deficientmouse withmarked re⁃duction of secretory IgA[J].J Immunol,1999,163(10):5367-5373.
[17]Aroeti B,Kosen P A,Kuntz I D,et al.Mutational and secondary structural analysis of the basolateral sorting signal of the polymer⁃ic immunoglobulin receptor[J].Journal of Cell Biology,1993,123 (5):1149-1160.
[18]Coyne R S,Siebrechtm,Peitschm C,et al.Mutational analysis of polymeric immunoglobulin receptor/ligand interactions.Evidence for the involvement ofmultiple complementarity determining re⁃gion(CDR)-like loops in receptor domain I[J].J Biol Chem,1994, 269(50):31620-31625.
Polymorphism ofpIgRgene and its relation with piglet diarrhea
WANG Xibiao,TONG Xianwei,CUI Shiquan,DI Shengwei,LI Furong,LIU Zhiran,SONG Bin(School of Animal Sciences and Technology,NortheastAgricultural University,Harbin 150030,China)
The polymorphism ofpIgRexon 1 inmin pig and Landrace was detected with PCR-SSCP binding sequencingmethod,and the relationship between gene polymorphism and piglet diarrhea was analyzed.The results showed that twomissensemutations were detected inpIgRexon 1,and C373T led to alanine→Valine,A394G led to aspartic→serine.Min pig population revealed three genotypes including AA,AB and BB,and Landrace population had two genotypes with AA and AB,respectively,the difference of genotype distribution between the two groups was extremely significant difference(P<0.01).Inmin pig population, both piglet diarrhea index andmortality rate of different genotypic sows were significant difference(P<0.05). However,only piglet diarrhea index showed significant difference in Landrace population(P<0.05).
Min pig;pIgRgene;polymorphism;diarrhea;SSCP
S858.28
A
1005-9369(2016)04-0010-06
2016-03-17
国家自然科学基金青年基金项目(31501916)
王希彪(1965-),男,教授,博士,博士生导师,研究方向为猪的育种与生产。E-mail:wxibiao1967@aliyun.com

