苦酸通方对自发性2型糖尿病胰岛素抵抗大鼠体质量与腹部脂肪组织中FAS表达的影响*
金美英 高胜男 朴春丽(长春中医药大学附属医院,吉林 长春 130117)
·研究报告·
苦酸通方对自发性2型糖尿病胰岛素抵抗大鼠体质量与腹部脂肪组织中FAS表达的影响*
金美英 高胜男 朴春丽△
(长春中医药大学附属医院,吉林 长春 130117)
目的 观察苦酸通调方对自发性2型糖尿病胰岛素抵抗大鼠体质量及腹部脂肪中脂肪酸生成酶(FAS)蛋白表达的影响。方法 以30只雄性ZDF大鼠为实验对象,利用高脂饲料饲养,以12周周龄形成2型糖尿病大鼠模型。按体质量随机分为3组,分别为模型组、吡格列酮治疗组、苦酸通调方治疗组各10只。正常对照组为其同系雄性非糖尿病Zucker Lean(ZL)大鼠10只,其中空白组以普通饲料喂养。并用Western blot法,检测各组大鼠腹部脂肪组织中FAS蛋白的表达情况。结果 1)经药物治疗12周后,模型组、吡格列酮组、苦酸通调组体质量均显著高于正常对照组(P<0.01)。治疗8周、12周后,苦酸通调组体质量与模型组相比明显下降,吡格列酮组与模型组相比差异无统计学意义(P>0.05)。2)腹部脂肪组织中FAS蛋白的表达情况:与正常组比较,模型组FAS蛋白表达明显升高(P<0.05)。吡格列酮组和苦酸通调组明显降低FAS蛋白表达,与模型组比较有明显改善(P<0.01)。结论 1)苦酸通调方具有减轻体质量,提高胰岛素敏感性,改善胰岛素抵抗的作用。2)苦酸通调方组可明显降低腹部脂肪组织中FAS蛋白的表达,实验结果说明2型糖尿病的糖脂代谢紊乱与FAS有关联。苦酸通调方可以通过对体内合成脂肪途径中的关键酶之一FAS起抑制作用,减少脂肪沉积,控制脂肪合成、减少体质量。FAS可能是苦酸通调方的作用新靶点,其机制可能与干预机体内脂肪组织的合成、分解代谢、进而改善胰岛素抵抗作用有关。
苦酸通调方 2型糖尿病 胰岛素抵抗 体质量 脂肪酸合成酶
【Abstract】Objective:To observe impacts of the Kusuan Tongtiao decoction on on FAS expression in abdominal adipose tissue of spontaneous type 2 diabetes mellitus in rats with insulin resistance.Methods:30 male Zucker Diabetes Fat(ZDF)rats were selected as experimental subjects,fed with high-fat diet for twelve weeks to form type 2 diabetic rats.They were randomly divided into three groups,namely,the model group,Pioglitazone treatment group,Kusuan Tongtiao decoction group,10 cases in each.The control group of non-diabetic male included 10 Zucker Lean(ZL)rats and the blank group were fed with normal diet.FAS protein expression of the abdominal adipose tissue of rats was detected with western blot method.Results:1)After 12 weeks of treatment,the weight of the model group,pioglitazone group and Kusuan Tongtiao decoction group were significantly higher than the control group(P<0.01).8 weeks or 12 weeks after treatment,body weight of Kusuan Tongtiao decoction group significantly decreased compared with the model group.There was no significant difference between pioglitazone group and the model group(P>0.05).2)The expression of FAS protein in abdominal adipose tissue:compared with the normal group,FAS protein expression of the model group was significantly increased(P<0.05).FAS protein expression of Pioglitazone group and Kusuan Tongtiao decoction group significantly reduced,compared with model group,which was significantly improved(P<0.01).Conclusion:1)Kusuan Tongtiao decoction has an effect on improving insulin sensitivity and insulin resistance.2)Kusuan Tongtiao decoction can significantly reduce FAS protein expression of abdominal adipose tissue.The experimental results show that the disorder of glucose and lipid metabolism in type 2 diabetes mellitus is related to FAS.Kusuan Tongtiao decoction can inhibit FAS,one of
the key enzymes in the body fat pathway,reduce fat deposition,control fat synthesis,and reduce body weight.FAS may be a new target for its effect,whose mechanism may be related to the synthesis,decomposition and metabolism of adipose tissue in the body,and then to improve insulin resistance.
【Key words】Kusuan Tongtiao decoction;Type 2 diabetes mellitus;Insulin resistance;Weight;FAS
2 型糖尿病(T2DM)是一个典型的现代不良生活方式疾病,往往存在着脂代谢紊乱、肥胖、糖耐量异常等问题,肥胖是这些问题的基础,它的发病是可以预见的。大量研究表明,肥胖是胰岛素抵抗的独立危险因素,肥胖时,脂肪组织结构和功能紊乱,失调的脂肪组织是连接胰岛素抵抗、T2DM和动脉粥样硬化的桥梁[1]。近年来研究发现,脂肪组织不仅是能量储存器官,还是一个可以分泌产生多种激素和细胞因子的新的内分泌器官,它可以合成和释放大量脂肪因子。脂肪酸合成酶(FAS)作为脂肪代谢的主要酶,含有脂肪酸合成所需的全部酶活性,其表达的改变可能是肥胖、2型糖尿病发生的分子基础之一,从而进一步降低了胰岛素的敏感性,诱发肥胖向2型糖尿病的转化与发展[2]。脂肪酸合成酶很可能是体内调节能量消耗和储存的重要位点之一。近年来大量研究表明,脂肪酸合成酶抑制剂C75和浅蓝菌素具有减少小鼠进食量,增加能量消耗、降低体质量、预防胰岛素抵抗的作用[3-6]。
中医药对于2型糖尿病的发生和控制2型糖尿病的进展有十分重要的意义,因此深入开展中医药从整体观改善肥胖及胰岛素抵抗,具有广泛前景。本研究以中医理论为指导,在已有前期研究的基础上,以高脂饲料诱导的T2DM大鼠为实验对象,观察苦酸通调方对大鼠体质量、FAS蛋白相关表达有影响,寻找改善大鼠胰岛素抵抗新靶点。现报告如下。
1 材料与方法
1.1 动物与分组 清洁级9周龄雄性ZDF大鼠42只(体质量244~291 g)和同周龄雄性ZL大鼠10只(体质量183~220 g),购于北京维通利华实验动物技术有限公司,动物许可证:SCXK(京)2014-0003。ZDF大鼠予高脂饲料#5008(粗脂肪6.5%、粗蛋白23.5%)喂养,ZL大鼠予普通饲料#1022(粗蛋白%≥18.0、粗脂肪% ≥4.0、粗纤维%≤5.0、水分%≤8.0)喂养,饲料购于北京华阜康生物科技股份有限公司,合格证号SCXK(京)2009-0008。大鼠在北京中医药大学基础医学院实验室中饲养,实验室温度20~22℃,相对湿度(55± 5)%,12/12 h光照黑暗循环 (光照时间8∶00~20∶00,黑暗时间20∶00-~8∶00)。实验前均予普通饲料适应性喂养1周,所有实验大鼠自由获取食物和饮水。将造模成功的ZDF大鼠随机分为模型组(n=10),苦酸通调组(n=10)、吡格列酮组(n=10)3组,10只ZL大鼠为空白对照组。将苦酸通调方和吡格列酮分别配置成混悬液,造模成功后,苦酸通调方使用时按照3.29 g/(kg·d)体质量(前期工作已确定的最佳剂量)混悬液灌胃,吡格列酮组按照1.07 mg/(kg·d)体质量灌胃,正常对照组和模型组均予等体积蒸馏水灌胃,各组大鼠均连续灌胃12周,每日1次。用药治疗期间正常对照组大鼠饲以普通饲料,其他组饲以高脂饲料,自由进食、饮水,每周称质量,根据体质量调整灌胃剂量。
1.2 试药与仪器 FAS、GAPDH抗体,Anti-FAS、Anti-GAPDH抗体、化学发光液(美国CST公司);蛋白裂解液+苯甲基磺酰氟 (PMSF)(上海碧云天生物技术公司);BCA蛋白浓度测定试剂盒包括A液100 mL、B液5 mL、蛋白标准品1 mL(上海碧云天生物技术公司);PVDF膜(美国Millipore公司);苦酸通调方(黄连15 g,乌梅15 g,大黄10 g,干姜6 g),长春中医药大学附属医院颗粒药房提供;吡格列酮,江苏恒瑞医药股份有限公司(批号:国药准字H20040631)等。主要仪器包括:调节台式高速低温离心机 (HERAEUS Fresco 17,Thenno Scientific,USA);温控震荡仪(Thenno Scientific,USA);电泳仪、电泳及电转移装置(PowerPac Basic,Bio-Rad,USA);酶标仪(Model 550 Microplate Reader,Bio-Rad公司,USA);凝胶图像处理系统 (上海产Tanon GIS-1000)。
1.3 模型制备 实验用ZDF以及ZL大鼠均分笼饲养,每笼2只。实验过程中,大鼠可以自由进食和饮水。实验开始前大鼠均给予适应性喂养,饲料采用普通级。实验开始后,ZL组继续给予普通饲料而ZDF组大鼠给予高脂饲料喂养。12周后,检测造模情况。造模评价标准:糖耐量实验,检测前禁食不禁水15 h,血糖仪检测大鼠空腹血糖,然后给予30%葡萄糖溶液灌胃(2 g/kg)。分别在灌胃后0.5、1、1.5、2 h取血并测量血糖。血糖峰值高于16.7 mmol/L,或糖负荷2 h后血糖高于11.1 mmol/L,可判定造模成功。如仅具备上述1条,则为糖耐量减低。
1.4 标本采集与检测 给药治疗12周后,将大鼠处死后打开腹腔,迅速取出腹部脂肪组织,把组织剪切成细小的碎片,PMSF与PIPA裂解缓冲液以1∶100的比例加入组织中,涡旋振荡,冰浴中用玻璃匀浆器匀浆,直至充分裂解,将匀浆液其置于EP管中,4℃、13000 r/min离心30 min,收集中层清液,用于检测FAS蛋白的表达。蛋白免疫印迹实验检测脂肪组织FAS蛋白表达,细胞经裂解液处理后收集蛋白用BCA法进行蛋白定量。10%SDS-PAGE电泳、电转、据蛋白质Marker不同分子量条带的所在位置切下预计含目的蛋白的PVDF膜,放置于封闭缓冲液中。分别加入相应一抗FAS、GAPDH以1∶1000比例1.2 μL抗体混于1.2 mL封闭缓冲液,后置于4℃低温震荡仪过夜。次日洗膜4次后,加入二抗,同样以1∶1000比例1.2 μL抗体混于1.2 mL TBST中,室温震摇1 h。再次洗膜4次后进行曝光,显影,定影。采用蛋白电泳图像分析软件Gel-pro32(Labwork)分析电泳条带灰度值,以目的蛋白灰度值除以内参GAPDH灰度值来表示目的蛋白相对表达量。
1.5 统计学处理 应用SPSS19.0统计软件分析。实验数据计量资料以(±s)表示,服从正态分布的两组间均数比较用t检验,同批次多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠体质量比较 见表1和图1。经药物治疗12周后,模型组、吡格列酮组、苦酸通调组体质量均显著高于正常对照组(P<0.01)。治疗4周后,中药组、西药组体重与模型组相比,虽有下降趋势,但无统计学意义(P>0.05)。治疗8周、12周后,苦酸通调组体质量与模型组相比明显下降,吡格列酮组与模型组相比差异无统计学意义(P>0.05)。苦酸通调方可降低糖尿病大鼠体质量,提高胰岛素敏感性,说明苦酸通调方能调节糖脂代谢、减轻体质量、提高胰岛素敏感性,从而改善IR。
表1 各组大鼠药物体质量比较(g,±s)
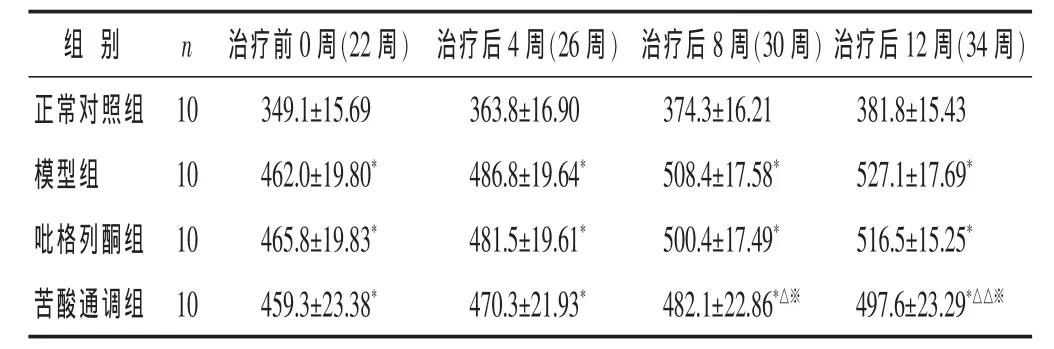
表1 各组大鼠药物体质量比较(g,±s)
与正常组比较,*P<0.01;与模型组比较,△P<0.05,△△P<0.01;与吡格列酮组比较,※P<0.05。下同。
?

图1 大鼠体质量变化
2.2 各组大鼠FAS蛋白表达的比较 见表2和图2。采用蛋白电泳图像分析软件Gel-pro32(Labwork)分析电泳条带灰度值,以目的蛋白灰度值除以内参GAPDH灰度值来表示目的蛋白相对表达量。结果显示,与正常组比较,模型组FAS蛋白表达明显升高(P<0.05)。吡格列酮治疗组和苦酸通调方治疗组,可明显降低FAS蛋白表达,与模型组比较有明显改善(P<0.01),两组之间有差异无统计学意义(P>0.05)。模型组大鼠腹部脂肪组织中FAS阳性表达明显增加,苦酸通调方组FAS阳性表达则明显下降,从蛋白水平进一步说明FAS可能是苦酸通调方的作用靶点,可以阻滞生脂通路,控制脂肪合成、减少体质量,从而减轻胰岛素抵抗。
表2 各组大鼠FAS相对蛋白表达比较(±s)

表2 各组大鼠FAS相对蛋白表达比较(±s)
组别 n FAS/GAPDH正常对照组 10模型组 10吡格列酮组 10 0.097±0.008 0.443±0.075*0.095±0.013△△苦酸通调组 10 0.082±0.021△△

图2 各组大鼠FAS相对表达量
3 讨 论
3.1 “六郁和络滞”为T2DM的病机关键 糖尿病属中医学“消渴”范畴,发病原因主要由饮食偏好如嗜食肥甘,从而导致食郁中焦,气机运化失常,邪毒内生,最终出现一系列临床表现。“六郁和络滞”学说的创立,高度概括了肥胖T2DM脂代谢紊乱和脂肪组织炎症的发病机制,该理论的提出具有科学性与前瞻性。本课题组提出2型糖尿病的中医病机核心是 “六郁和络滞”,囊括了2型糖尿病早期无明显三多一少症状的情况。六郁是指以食郁为先导而形成的气郁、热郁、血郁、痰郁、湿郁的病理状态;络滞是由六郁交互作用而形成脉络郁滞的病理状态[7]。
机体在六郁的病理状态下,久而化生膏、浊、痰、瘀、毒等病理产物,病理产物久而不化,留于全身经络各处,或堆积于肓膜之上,或散布于肌肉腠理之间,或蕴藏于胸腹之中,形成络滞的病理状态,故“六郁和络滞”可能是T2DM患者多体形臃肿的原因。如能够及时清除致病的病理产物,改善内环境,就能够有效地改善脂肪组织相关的微炎症、脂代谢紊乱状态,进而减轻体重,改善患者临床症状。
针对上述T2DM的核心病机,本课题组提出苦酸通调的中医治疗法则。苦酸通调法是对 “解毒通络”、“苦酸制甜”和单一治法学说的高度概括,“解毒通络”法以长期临床经验为基础[8],根据络病治疗法则而设,“苦酸制甜”理论则基于药物四气五味的药性理论而来[9],研究表明[10],T2DM 早期即存在络脉郁滞,且贯穿T2DM始终。
苦酸通调方由黄连15 g,乌梅15 g,大黄10 g,干姜6 g组成。本方为源自《温病条辨》连梅汤加大黄、干姜而成,君用黄连、大黄,苦寒泄壅解毒,破积化瘀;乌梅收敛生津,以防苦寒伤阴,黄芩燥湿解毒,此两药共为臣药;佐以干姜、白芍,用以调畅气机,养血柔肝,收敛气阴,且反佐苦寒药物之偏弊,故为二者共为佐使。该方体现了治疗消渴病“糖络并治”的理论。
3.2 苦酸通调方对2型糖尿病IR大鼠体质量与腹部脂肪组织中FAS蛋白表达的影响 FAS是催化乙酰辅酶A、丙二酸单酰辅酶A和NADPH合成饱和长链脂肪酸的关键酶[11-14]。它能经转酰、缩合、还原、脱水和再还原的重复过程合成脂肪酸,而脂肪酸是合成三酰甘油的重要原料。糖尿病的脂质代谢紊乱与肝脏FAS表达的变化有密切关系。在2002年ADA会议上Mc Garry[15]提出了“糖尿病是糖脂病”的概念。苦酸通调方组可明显降低腹部脂肪组织中FAS蛋白的表达,与模型组比较有明显改善。实验结果说明2型糖尿病的糖脂代谢紊乱与FAS有关联。苦酸通调方可以通过对体内合成脂肪途径中的关键酶之一FAS起抑制作用,减少脂肪沉积,控制脂肪合成、减少体质量,增强胰岛素敏感性。FAS可能是苦酸通调方的作用靶点,其机制可能与干预机体内脂肪组织的合成、分解代谢、进而改善胰岛素抵抗作用有关。
[1] Kukidome D,Nishikawa T,Sonod K,et al.Activation of activated protein kinase reduces hyperglycemi induced mitochondrial reactive oxygen species prodution and promotes mitochondrial biogenesis in human umbilical vein endotheli al cells[J].Diabetes,2006,55(1):120-127.
[2] Weyer C,Foley JE,Bogardus C,et al.Enlarged sub cut aneousab-dominala dipocy te size,but not obesity itsel,fpredictstypeⅡdia-betes independent of insulin resis tance[J].Diabe to logia,2000,43:1498-1506.
[3] Kim EK,Miller I,Landree LE,et al.Expression of FAS within hypothalamic neurous:a model for decreased food intake after C75 treatmet[J].Am J Physicl Endocrinol Metab,2002,283 (5):E867-879.
[4] Obici S,Feng Z,Arduini A,et al.Inhibition of hypothalamic camitine palm itoyltransferase-I decreases food intake and glucose production[J].Nat Med,2003,9(6):756-761.
[5] Kumar MV,Shimokawa T,Nagy TR,et al.Differential effects of acentrally acting fatty acid synthase inhibitor in lean and obese mice[J].Proc Natl Acad Sci USA,2002,99(4):1921-1925.
[6] Thupari JN,Landree LE,Ronnett GV,et al.C75 increases peripheral energy utilization and fatty acid oxidation in dietinduced obesity[J].Proc Natl Acad ScUSA,2002,99(4):9498-9502.
[7] 朴春丽,邓悦,米佳.苦酸通调法抑制糖尿病脂肪组织炎症机制的理论探讨[J].中华实用中西医杂志,2009,22(3):146-148.
[8] 于淼,朴春丽,南征,等.2型糖尿病胰岛素抵抗的肝内炎症发病机制与毒损肝络病机理论的相关性探讨[J].中国中西医结合杂志,2006,26(11):1032-1034.
[9] 刘彦君,潘长玉.自发的2型糖尿病动物模型—OLETF大鼠[J].国外医学内分泌学分册,1999,19(1):26-29.
[10]Wang H,Kourig,Wollheim CB.ER stress and SREBP-1 activation are implicated in beta-cell glucolipotoxicity[J].Cell sci,2005,118(pt117):3905-3915.
[11]Wakil SJ,Stoops JK,Joshi VC.Fatty acid synthesis andits regulation[J].Annu Rev Biochem,1983,52:537-579.
[12]Wakil SJ.Fatty acid synthase,a proficient multifunctionalenzyme[J].Biochemistry,1989,28(11):4523-4530.
[13]Smith S.The animal fatty acid synthase:one gene,onepolypeptide,seven enzymes[J].Faseb J,1994,8(15):1248-1259.
[14]Smith S,Witkowski A,Joshi AK.Structural and functionalorganization of the animal fatty acid synthase[J].Prog Lip-id Res,2003,42(4):289-317.
[15]Mc Garry JD.Dysregulation of fatty acid metabolism in the etiologoftype 2 dia betes[J].Diabetes,2002,51(1):7-18.
Effects of Kusuan Tongtiao Decoction on FAS Expression in Abdominal Adipose Tissue of Spontaneous Type 2 Diabetes Mellitus in Rats with Insulin Resistance
JIN Meiying,GAO Shengnan,PIAO Chunli.Hospital Affiliated to Changchun University of Chinese Medicine,Jilin,Changchun 130117,China.
R285.5 文献标志码:A
1004-745X(2016)08-1484-04
10.3969/j.issn.1004-745X.2016.08.009
吉林省自然科学基金项目(201115169)
(电子邮箱:piaochunli9811027@yahoo.com.cn)
2016-04-20)

