影响早期宫颈癌术后放疗的预后因素及生存质量分析
何 清, 张纬建
影响早期宫颈癌术后放疗的预后因素及生存质量分析
何清, 张纬建
目的回顾性分析早期宫颈癌手术后调强放疗(IMRT)和三维适形放疗(3D-CRT)治疗的预后及生存质量情况,探讨IMRT能否提高早期宫颈癌术后患者的治疗增益比。方法收集148例国际妇产科联盟(FIGO)分期为ⅠB~ⅡA期具有不良预后因素的宫颈癌术后患者的临床资料,其中IMRT组100例,3D-CRT组48例。采用单因素及多因素COX回归分析各种影响预后因素;Kaplan-Meier法计算总生存率及无复发生存率;非参数-秩和检验、卡方检验和成组t检验比较2组患者生存质量情况。结果IMRT组与3D-CRT组5年总生存率分别为85%和68%(P=0.005,P=0.012);3年无复发生存率分别为85%和70%(P=0.042,P=0.039)。而盆腔淋巴结转移0,1,≥2个5年生存率分别为90%,68%和43%(P=0.000,P=0.000);3年无复发生存率分别为83%,71%和57%(P=0.003,P=0.013)。IMRT组在躯体功能、角色功能及1,3,5年的总体生存质量评分优于3D-CRT组(P<0.05)。结论早期宫颈癌手术后患者辅助IMRT可降低复发率,提高生存率,提高患者的生存质量。盆腔淋巴结转移是影响预后的独立因素。
宫颈肿瘤; 预后; 放射疗法,适形; 放射疗法,调强适形; 生活质量
对于具有不良预后因素的早期宫颈癌(包括高危因素:盆腔淋巴结转移、切缘阳性、宫旁浸润;中危因素:肿瘤直径≥4 cm、脉管内癌栓、深肌层浸润),术后辅助放射治疗,有助于降低盆腔复发率[1-2]。近年来,随着放疗技术的进步,调强放疗(intensity modulated radiation therapy,IMRT)已广泛运用于各种恶性肿瘤的治疗领域。除头颈部、泌尿系统、中枢神经系统肿瘤外,宫颈癌IMRT的运用占据第4位[3-4]。随着治疗技术水平的提高,早期宫颈癌患者将成为越来越多的长期存活者。采用主观评价的方法评价与健康相关的生存质量,反映疾病及治疗技术对患者心理、生理及社会功能等方面的影响,是临床治疗标准选择的核心要素,一定程度上也是影响预后的因素[5-8]。本研究拟通过分析早期宫颈癌患者的预后及生存质量,以指导术后辅助放疗技术的选择。
1 对象与方法
1.1对象收集2007年7月-2015年2月在笔者医院放疗科收治的148例国际妇产科联盟(international federation of gynecology and obstetrics,FIGO)临床分期为ⅠB~ⅡA期的宫颈癌术后患者,年龄(48.04±9.05)岁(29~82)岁。其中IMRT组100例,三维适形放射治疗(3D imensional comformal radiation therapy,3D-CRT) 组48例。ⅠB1期23例,ⅠB2期49例,ⅡA期76例;术后病理为鳞状细胞癌122例,腺癌18例,其他8例(包括腺鳞癌7例,小细胞神经内分泌癌1例);无淋巴结转移的113例,淋巴结转移1个的18例,淋巴结转移≥2个的17例(表1)。
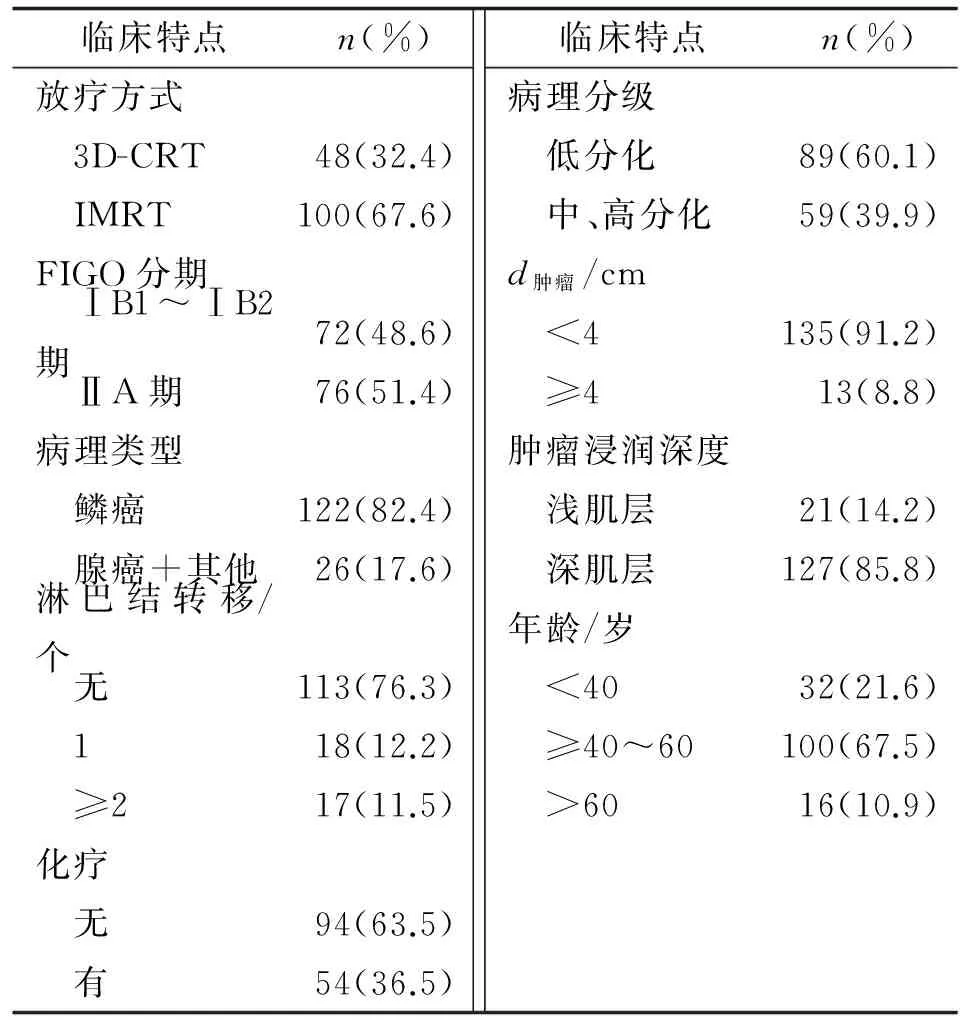
表1 148例患者临床资料
IMRT:术后调强放疗;3D-CRT:三维适形放疗.
1.2仪器模拟激光定位系统(Dorado3,德国LAP公司);16排螺旋CT机(日本Toshiba 公司);治疗计划系统(ADAC Pinnacle9.0,荷兰Philips公司);直线加速器(600C/D型6MV-X线,美国Varian公司)。
1.3方法
1.3.1化疗所有患者均未采用同期放化疗(concurrent chemoradiotherapy,CCRT),其中放疗后配合辅助化疗54例,未行辅助化疗94例。化疗2个周期,化疗方案:(紫杉醇135 mg/m2,静脉滴注d1+顺铂40 mg静脉滴注d1~d3)Q4W。
1.3.2放疗技术定位前要求患者排空直肠,充盈膀胱。患者仰卧位,平躺在体部固定板上,双手交叉抱肘关节放至前额部;双腿自然平放。暴露范围:上腹部至双侧膝关节。应用博达神州热塑型网状体膜进行体位固定。在真骨盆处,体表上的3个交叉点用金属铅点标记,并用记号笔标出CT扫描中心点。扫描前2 h口服造影剂(76%泛影葡胺20 mL稀释于1 000 mL饮用水中),扫描时阴道内放置标记物以标记阴道残端位置。CT扫描范围自第1腰椎上缘到坐骨结节下缘下3~5 cm,扫描层厚4 mm。根据ICRU62号报告,靶区包括:临床靶体积(clinical target volume,CTV)、计划靶体积(planning target volume,PTV)、危及器官(organs at risk,OAR)。其中CTV包括原瘤区、宫旁、上段阴道及髂总、髂内、髂外、骶前和闭孔淋巴引流区。CTV在所有方向外放0.5 cm形成计划靶体积(planning target volume,PTV)。危及器官包括:直肠、膀胱、小肠、骨盆(双侧髂骨翼、耻骨、坐骨、骶尾骨)、双侧股骨头。根据靶体积剂量、危及器官的限制剂量设置放射野及权重。PTV总剂量45~50.4 Gy,分次剂量1.8~2.0 Gy/次。IMRT设计5野,3D-CRT放疗为盒式4野,均要求95%等剂量曲线覆盖PTV,靶区最大及最小剂量不超过处方剂量±10%。95%以上的PTV达到处方剂量,无剂量冷点。所关注的危及器官无剂量热点。热点剂量不超过处方剂量的110%。危及器官的受照剂量限制要求:直肠V45<40%,膀胱V45<30%,小肠V45<20%,骨盆V40<30%,双侧股骨头V30<25%。
1.3.3观察指标总生存时间定义为:从患者手术后到死亡的时间;存活的患者为从手术后到随访截止日期。无复发生存时间定义为:从患者手术后到肿瘤局部复发或远处转移的时间。随访148例,随访截止至2015年2月28日。放疗结束后的2年内,每3月随访1次,2年之后每6月随访1次,5年后每1年随访1次。
1.3.4生存质量问卷调查登录欧洲癌症研究与治疗组织(european organisation for research and treatment of cancer,EORTC)官方网站,注册并通过电子邮件申请获得生存质量核心量表中文版(quality of life core questionaire,QLQ-30 V3.0);生存质量测量表之宫颈癌模块中文版(qality of life core questionaire,cervix cancer module,QLQ-CX24)。EORTC QLQ-30问卷部分共有30道题目,包括:功能方面(躯体功能、角色功能、情绪、认知功能、社会功能)、肿瘤相关症状和总体生存质量方面的题目。EORTC QLQ-CX24问卷部分共有24道题目,包括:宫颈癌特有症状、自身形象及性生活质量方面的题目。
1.3.5EORTC QLQ-30及EORTC QLQ-CX24问卷的评分计算先由患者对2份问卷的54道题目进行自主评分,然后由放疗科专业人员对每套问卷的自评分数进行整理和计算。EORTC QLQ-30问卷的评分计算:根据EORCT建议的线性公式进行计算得出相应的分数(表2)。

表2 生存质量评分计算公式
S:分数;RS:原始分数;I:每道题目原始分数;range:相应项目的值域.
每道题的原始分值1~4分,将患者的自主评分分别带入以上公式进行计算,得出相应的分值。求得功能及总体生存质量的分值越高表示生存质量越好。而症状评分,原始分值越高表示生存质量越差。为方便统计,本研究用100分减去所得数值,得出相应的症状评分。因此所有分数越高表示生存质量越好。EORTC QLQ-CX24问卷的评分计算:将所有患者的自评分数按照症状的“有”或“无”进行分组,即:1分为“无”,2分及以上为“有”。
1.4统计学处理数据采用SPSS 20.0统计软件处理。对潜在预后采用单因素Log-Rank检验;用Kaplan-Meier法计算总生存率及无复发生存率。对EORTC QLQ-30和EORTC QLQ-CX24评分结果分别采用Wilcoxon rank sum检验和χ2检验,比较2组的生存质量情况。P<0.05为差别有统计学意义。
2 结 果
2.1影响预后因素分析放疗技术、淋巴结转移个数是影响早期宫颈癌术后患者5年生存率及3年复发率的独立因素。其中,IMRT组100例,死亡9例(9.0%),复发17例(17.0%);3D-CRT组48例,死亡11例(22.9%),复发14例(29.2%);IMRT组优于3D-CRT组(P<0.05)。而不同淋巴结转移个数的生存时间及无复发生存时间分布也不同。无盆腔淋巴结转移者113例,死亡9例(7.9%),复发18例(15.9%);盆腔淋巴结1个转移者18例,死亡4例(22.2%)复发5例(27.8%),≥2个淋巴结转移者17例,死亡7例(41.2%),复发8例(47.1%)。无盆腔淋巴结转移者优于有转移者,且淋巴结仅1个转移者优于≥2个转移者(P<0.05,表3,4)。
表3单因素分析148例患者临床特点对总生存时间及无复发生存时间的影响
Tab 3Univariate analysis of clinical characteristics of 148 patients impact on overall survival time and relapse-free survival time
2.2生存分析148例中,复发31例(20.9%),死亡20例(13.5%);5年生存率为85%;2,3年无复发生存率分别为84%和79%。复发部位主要是盆腔。死亡原因主要表现为复发后未控(11例)及远处转移(9例)。其中IMRT组2,3及5年生存率分别为99%,96%和85%;3D-CRT组为93%,77%和68%。IMRT组1,2及3年无复发生存率为98%,89%和85%;3D-CRT组为1,2及3年无复发生存率为80%,73%和70%。IMRT组5年生存率及3年无复发生存率优于3D-CRT组(P<0.05)。而盆腔淋巴结转移0,1,≥2个的5年生存率分别为90%,68%和43%(P=0.000);3年无复发生存率为83%,71%和57%(P=0.03)。
2.3EORTC QLQ-30问卷评分结果通过电子邮件、信访、电话随访及门诊随访的方式对148例患者进行问卷调查,共有82例完成。其中IMRT组55例,3D-CRT组27例。IMRT组在躯体功能、角色功能及1,3,5年总体生存质量方面的评分优于3D-CRT组(P<0.05);在症状方面如气促、疲倦、恶心、呕吐、腹泻,3D-CRT组较IMRT组更为突出(P<0.05);而IMRT组治疗花费所造成的经济负担较3D-CRT组重(P=0.027);余差别均无统计学意义(P>0.05,表5,6)。
2.4EORTC QLQ-CX24问卷评分结果在宫颈癌19项特有的症状方面如:腹痛、大便失禁、血便、尿痛、潮热出汗、外阴部不适等,IMRT组较少出现潮热出汗的症状,而外阴部不适表现较3D-CRT组明显(P<0.05),余差别均无统计学意义(P>0.05,表7)。
2.5性生活比较2种放疗技术对患者性生活质量的影响比较,差别无统计学意义(P>0.05,表8)。
表4多因素分析148例患者临床特点对总生存时间及无复发生存时间的影响
Tab 4Analysis of the clinical features of 148 patients impact on overall survival time and relapse-free survival time of multivariate
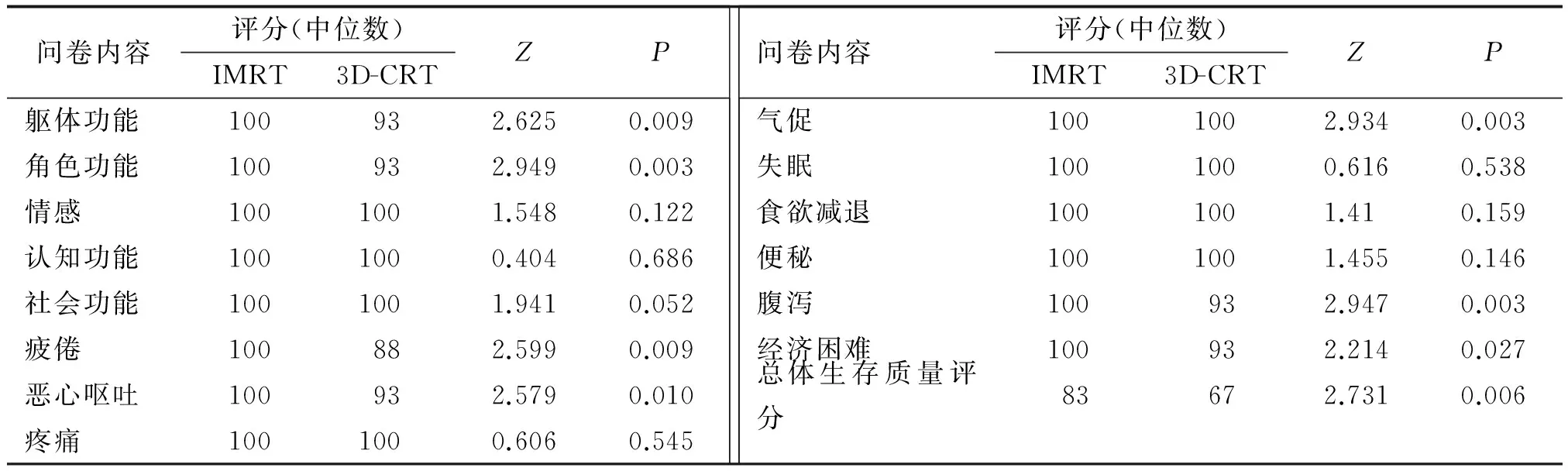
表5 2组EORTC QLQ-30问卷评分比较
IMRT:术后调强放疗;3D-CRT:三维适形放疗.
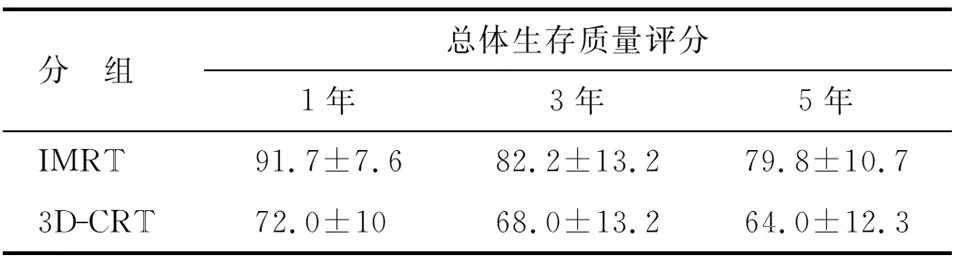
表6 2组总体生存质量评分
IMRT:术后调强放疗;3D-CRT:三维适形放疗.
表72组EORTC QLQ-CX24问卷评分
Tab 7Comparison of two groups EORTC QLQ-CX24 questionnaire score
IMRT:术后调强放疗;3D-CRT:三维适形放疗.

表8 2组性生活情况的比较
IMRT:术后调强放疗;3D-CRT:三维适形放疗.
3 讨 论
针对具有不良因素的早期宫颈癌术后患者,本研究分析了各种可能影响预后的因素。结果显示:IMRT组5年生存率及3年无复发生存率均为85%,优于3D-CRT组,与Folkert等研究结果相仿[9]。而不同淋巴结转移个数的5年生存率及3年无复发生存率分布不同,无盆腔淋巴结转移组优于有盆腔淋巴结转移组,而淋巴结仅1个转移组优于2个及以上转移组。Kasuyai G等研究结果为:早期宫颈癌伴有1个盆腔淋巴结转移的5年生存率为71%,优于有2个淋巴结转移的(58%)和≥3个淋巴结转移的(51%)(P<0.05)[10]。本研究中,1个淋巴结转移的5年生存率为68%,但≥2个淋巴结转移的5年生存率为43%,较其下降,考虑Goro等研究中的病例均采用术后CCRT模式[10],故5年生存率高。美国国家癌症研究所(national cancer institute,NCI)已将以顺铂为基础的CCRT列为高危早期宫颈癌和局部晚期宫颈癌的标准治疗方案。研究报道:FIGO分期ⅠB1~ⅡB期宫颈癌术后患者中,具有高危因素或≥2个中危因素的,采用CCRT的治疗模式,有助于提高预后[11]。然而化疗亦有毒副反应,Valec等报道CCRT较单纯放疗血液学毒性反应明显增加,3度以上骨髓抑制为单纯放疗的2~10倍[12]。本研究中,148例患者均未采用CCRT的治疗模式,而5年总生存率及2年无复发生存率均在80%以上。其中盆腔淋巴结转移数目≥2个的5年生存率下降为43%。因此根据个体化治疗原则,对于盆腔淋巴结转移数目≥2个者可采用CCRT,以期获得更好的疗效。
从生存质量角度分析,通过EORTC QLQ-30生存质量及EORTC QLQ-CX24宫颈癌模块问卷调查,分析2组放疗后生存质量的差别。Cai等已对中文版问卷的可信度和效度进行验证,表明中文版的EORTC QLQ-30和EORTC QLQ-CX24问卷可作为一个可靠和有效的临床研究工具来研究中国宫颈癌患者的生存质量[13]。本研究结果显示:在EORTC QLQ-30生存质量问卷部分,IMRT组放疗后出现的恶心、呕吐、腹泻、疲倦、气促的症状较3D-CRT组轻,导致的结果是躯体功能、角色功能及总体生存质量要优于3D-CRT组。Vaz和Ahlberg等研究结果也证实此观点[14-15]。在EORTC QLQ-CX24宫颈癌模块问卷部分,IMRT组潮热出汗的更年期症状较3D-CRT组轻(P<0.05),考虑该结果除了放射靶区及放疗剂量的影响外,还与手术方式有关,对此还需做进一步分层分析。而更年期症状将会影响患者性生活的满意度[16]。在外阴部不适反应方面,IMRT组较3D-CRT组明显,但2种放疗技术造成患者性生活质量的差别无统计学意义。对于放疗造成的经济负担,IMRT组较3D-CRT组显著,符合实际情况,但不影响患者的情绪及社会功能,与Magorzata等研究结果相符[17]。然而随着时间的推移,放疗导致的副反应将更加明显,例如淋巴水肿、性功能及阴道功能等,存活15年的患者较存活10年及5年的明显[18]。因此,本研究还需根据患者生存时间做纵向分析,并采用前瞻性研究,以进一步考量放疗对早期宫颈癌患者生存质量的影响。
癌症治疗的两个主要目标:一是治愈或延长生存时间,二是改善生存质量[19]。关于宫颈癌患者生存质量的研究非常重要,可用于确定宫颈癌的治疗效果,还是协助指导有关进一步治疗决策的有用工具[20]。具有不良预后因素的早期宫颈术后患者,辅助IMRT与3D-CRT比较:IMRT提高了局部控制率,延长生存时间,获得较好的总体生存质量。因此IMRT可作为早期宫颈癌术后辅助放疗的理想选择。
[1]Suh D H,Kim J W,Aziz M F,etal. Asian society of gynecologic oncology workshop[J].GynecolOncol,2010,21(3):137-150.
[2]Pieterse Q D,Trimbos J B,Dijkman A,etal. Postoperative radiation therapy improves prognosis in patients with adverse risk factors in localized, early-stage cervical cancer: a retrospective comparative study[J].IntJGynecolCancer,2006,16(3):1112-1118.
[3]Song C,Kim H J,Wu H G,etal. 20-year experience of postoperative radiotherapy in ⅠB-ⅡA cervical cancer patients with intermediate risk factors:Impact of treatment period and concurrent chemotherapy[J].GynecolOncol,2012,124(1):63-67.
[4]Loiselle C,Koh W J. The emerging use of IMRT for treatment of cervical cancer[J].NatlComprCancNetw,2010,8(12):1425-1434.
[5]Barnas E,Skret-Magier1o J,Skret A,etal. The quality of life of women treated for cervical cancer[J].EuropeanJOncologyNursing,2012,16(1):59-63.
[6]Ashing-Giwa K T,Lim J,Tang J,etal. Surviving cervical cancer:does health related quality of life influence survival[J]?GynecologicOncology,2010,118(1):35-42.
[7]Seibaek L,Petersen L K. Self-valued health in Danish women after cervix cancer surgery a retrospective questionnaire study[J].EuropeanJOncologyNursing,2007,11(2):183-186.
[8]Magorzata M,Suchocka L,Urbanski K,etal. Quality of life in cervical cancer patients treated with radiation therapy[J].JClinicalNursing,2012,22(5-6):690-697.
[9]Folkert M R,Shih K K, Abu-Rustum N R,etal. Postoperative pelvic intensity-modulated radiotherapy and concurrent chemotherapy in intermediate and high-risk cervical cancer[J].GynecolOncol,2013,128(2):288-293.
[10]Kasuyai G,Ogawa K,Iraha S,etal. Postoperative radiotherapy for uterine cervical cancer:impact of lymph node and histological type on survival[J].AnticancerReserrch,2013,33(5):2199-2204.
[11]Sedlis A,Bundy B N,Rotman M Z,etal. A randomized trial of pelvic radiation therapy versus no further therapy in selected patients with stage IB carcinoma of the cervix after radical hysterectomy and pelvic lymphadenectomy:A gynecologic oncology group study[J].GynecolOncol,1999,73(2):177-183.
[12]Valec L,Tiernry J F,Stewart L A,etal. Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer:a systematic review and meta—analysis of individual patient data from 18 randomized trials[J].ClinOnce1,2008(35):5802-5812.
[13]Cai H H,Guo H M,Guan X L,etal. Validation of the European organization for research and treatment of cancer cervical cancer module for Chinese patients with cervical cancer[J].PatientPreferenceandAdherence,2013,7(1):1061-1066.
[14]Vaz A F,Pinto A M,Conde D M,etal. Quality of life of women with gynecologic cancer:associated factors[J].ArchivesofGynecologyandObstetrics,2007,276(6):583-589.
[15]Ahlberg K,Ekman T,Gaston-Johanson F,etal. The experience of fatigue, other symptoms and global quality of life during radiotherapy for uterine cancer[J].InternationalJNursingStudies,2005,42(4):377-386.
[16]Seibaek L,Petersen L K. Self-valued health in Danish women after cervix cancer surgery-a retrospective questionnaire study[J].EuropeanJOncologyNursing,2007,11(2):183-186.
[17]Pasek M,Suchocka L,Urbanski K.Quality of life in cervical cancer patients treated with radiation therapy[J].JClinicalNursing,2012,22(5-6):690-697.
[18]Le Borgne G,Mercier M,Woronoff A S,etal. Quality of life in long-term cervical cancer survivors:A population-based study[J].GynecologicOncology,2013,129(1):222-228.
[19]Penson R T,Wenzel L B,Vergote I,etal. Quality of life considerations in gynecologic cancer[J].InternationalJGynecology&Obstetrics,2006,95(1):247-257.
[20]Shing-Giwa K T,Lim J,Tang J,etal. Surviving cervical cancer:does health-related quality of life influence survival[J].GynecologicOncology,2010,118(1):35-42.
(编辑:张慧茹)
Analysis of Prognosis and Quality of Life of 148 Patients with Early Cervical Cancer after Surgery and Postoperative Radiation Treatment
HE Qing, ZHANG Weijian
Department of Radiotherapy, The First Affiliated Hospital of Fujian Medical University,Fuzhou 350005,China
ObjectiveTo retrospectively analyze the quality of life and prognosis of early stage postoperative cervical cancer patients who received intensity-modulated radiotherapy (IMRT) or three-dimensional conformal radiotherapy (3D-CRT), so as to explore if IMRT could improve the therapeutic gain ratio of these patients.Methods148 postoperative cervical cancer cases, with International Federation of Gynecology and Obstetrics (FIGO) stagesⅠB~ⅡA and poor prognostic factors, were collected.Of all 148 cases, 100 underwent postoperative IMRT, 48 underwent postoperative 3D-CRT.Univariate regression analysis were performed to assess the prognosis factors.All patients overall survival (OS) and relapse-free survival (RFS) were calculated by Kaplan-Meier test.Quality of life between the two groups were compared with Wilcoxon rank sum test and χ2test.Results5-year OS were 85% and 68% for IMRT group and 3D-CRT group respectively (P=0.005); 3-year RFS were 85% and 70% (P=0.042) respetively.5-year OS for the numbers of pelvic lymph node metastasis of 0, 1, 2 and more, were 90%, 68%, 43% respectively (P=0.000);3-year RFS were 83%,71%,57% (P=0.003) respetively.Quality of life for the IMRT group surpassed that for the 3D-CRT group (P=0.03), in terms of physical function, role function and overall quality of life.ConclusionsIMRT compared with 3D-CRT can reduce the recurrence rate, improve the overall survival rate and quality of life for the early stage postoperative cervical cancer patients with poor prognostic factors.The pelvic lymph node metastasis is a significant prognostic factor for OS and RFS of these patients.
uterine cervical neoplasms; prognosis; radiotherapy, conformal; radiotherapy, intensity-modulated; quality of life
2015-11-07
福建医科大学 附属第一医院放疗科,福州350005
何清(1978-),女,主治医师
张纬建. Email:zwj9090@126.com
R619.2; R730.55; R737.33; R739.9; R815
A
1672-4194(2016)02-0107-06

