D9602-A方案长春新碱及更生霉素治疗儿童低风险胚胎型横纹肌肉瘤的疗效分析
蔡炜嵩,马赛男,王 倩,陈欢欢,吴 荣
D9602-A方案长春新碱及更生霉素治疗儿童低风险胚胎型横纹肌肉瘤的疗效分析
蔡炜嵩*,马赛男,王倩,陈欢欢,吴荣
目的提高对横纹肌肉瘤的认识,明确风险分组原则。探讨应用COG(儿童肿瘤协作组)D9602-A方案治疗我国儿童低风险组胚胎型横纹肌肉瘤的疗效及安全性。方法回顾性分析我院近年来收治的3例低风险胚胎型横纹肌肉瘤儿童患者资料,评估应用D9602-A方案长春新碱联合更生霉素治疗后的疗效及不良反应。结果3例患儿均一般状态良好,无瘤生存。结论应用COG D9602-A方案治疗我国儿童低风险胚胎型横纹肌肉瘤疗效确切,患者耐受良好。
横纹肌肉瘤;化疗;长春新碱;更生霉素
0 引言
儿童横纹肌肉瘤是中胚层来源的软组织恶性肿瘤,约占0~14岁、15~19岁儿童癌症的3.5%、2%。整体发病率约为0.000 45%,超过一半的患者在10岁以内发病。主要病理亚型为胚胎型、腺泡型和未分化型,其中胚胎型横纹肌肉瘤最常见,约占横纹肌肉瘤的60%~70%。发病高峰为0~4岁,男∶女为1.5∶1[1-5]。横纹肌肉瘤的预后主要取决于肿瘤原发部位、肿瘤大小、分组和病理学亚型。胚胎型横纹肌肉瘤是一种在形态学和生物学上再现胚胎性横纹肌特点的原始间叶肉瘤[5-8]。对于低风险胚胎型横纹肌肉瘤,国际横纹肌肉瘤研究组IRSG的D9602(1997-2004)方案比较了长春新碱、更生霉素两药联合方案以及两药再加环磷酰胺三药方案的治疗效果(两组需要放疗的患者均加放射治疗)。经过长期的随访,于2011年在《肿瘤临床(JCO)》上发表了试验结果[9]。结果表明,加用环磷酰胺组和不加环磷酰胺组的5年无进展生存率和总生存率类似,均超过80%,两治疗组比较差异无统计学意义。
目前尚无基于我国儿童临床研究得出的针对胚胎型横纹肌肉瘤的详细风险分级及治疗指南,因此,本研究参照儿童肿瘤协作组(Children′s Oncology Group,COG)的D9602-A方案对我院收治的3例胚胎型横纹肌肉瘤低风险组患者进行了治疗和随访。现报道如下。
1 病例资料
病例1:男,11个月,于2013年7月以“发现右侧阴囊肿物1.5个月”为主诉入院。彩超显示右侧阴囊内4.9 cm×4.4 cm×2.6 cm大小实性肿物,边界模糊,内呈低回声,血流信号丰富,肿物与右睾丸分界不清。MRI检查见右侧阴囊内等T1 混杂稍长T2影像,与睾丸界限不清,未见局部及腹膜后淋巴结肿大。手术中见肿物位于睾丸附睾之间,边缘受浸润,睾丸、附睾完整性良好,肿物无包膜,送冰冻,结果为间叶源性恶性。行右侧睾丸高位性根治术。探查局部未见肿大淋巴结,未行腹膜后淋巴结清扫。术后病理:(右阴囊)胚胎型横纹肌肉瘤。按照COG分组标准诊断患者为T1N0M0,Ⅰ期,1组,低风险组。
病例2:男,4岁,患儿2015年1月以“发现左侧阴囊肿物1周”在当地医院就诊,完善术前检查诊断为左阴囊肿物,肿物直径1.5 cm,于2015年1月28日行全麻下腹腔镜左侧内环口结扎+左睾丸鞘膜肿物切除术,术后病理提示胚胎型横纹肌肉瘤(中间型)。遂于全麻下二次手术行左阴囊内容物切除术及局部淋巴结清扫。术后复查影像未见肿瘤残留。按照COG分组标准诊断患者为T1N0M0,Ⅰ期,1组,低风险组。
病例3:女,6岁,2012年10月以“发现左眼睑肿胀眉弓部及眼部突出4 d,加重1 d”来我院就诊。三维超声:左眼层次结构清晰,左眼晶体、玻璃体回声均匀,左眼球后方可见2.5 cm×1.7 cm×1.8 cm实性肿物,边界模糊,内呈低回声,CDFI可检出丰富血流信号。CT:左侧眼球后方眶内可见软组织块影,与视神经及眼外肌界限不清楚,密度较均匀,CT值约35 IU。眼球周围软组织未见特殊改变。眶骨无侵袭破坏影像。左眶球后占位病变,注意除外小圆细胞恶性肿瘤(如横纹肌肉瘤、原始神经外胚层肿瘤)可能。建议增强MR检查。增强MRI:左眼球后方眶内一软组织肿块影,边界清,较大截面大小:2.8 cm×1.4 cm×1.9 cm,视神经受压移位,眼外肌界限清楚,可见强化。于全麻下行左眶内肿物摘除术,术后病理回报示:(左眼眶)胚胎型横纹肌肉瘤。按照COG分组标准诊断患者为T1N0M0,Ⅰ期,1组,低风险组。
以上3例患者参照D9602-A方案应用长春新碱及更生霉素化疗,治疗顺利,未出现Ⅲ级以上化疗不良反应。术后随访至今,目前患者均无瘤生存,状态良好。
2 讨论
在美国,1975-2010年儿童癌症死亡率降低了50%。对于低于15岁儿童的横纹肌肉瘤,5年生存率从53%提高到67%,15~19岁青少年5年生存率由30%提高到51%[10]。横纹肌肉瘤的治疗主要包括手术、放疗、化疗三部分,儿童肿瘤协作组COG和欧洲的治疗不完全相同,总的原则和趋势是提高疗效,减轻不良反应。因此对于患者的风险分层治疗非常重要。
COG软组织肉瘤委员会的TNM分期中提到了横纹肌肉瘤的有利发病部位和不利发病部位,其中有利发病部位包括:眼眶,非脑膜旁的头颈部位,除肾脏膀胱前列腺外的泌尿生殖道,胆道。不利的发病部位指除有利发病部位以外的任何部位。根据TNM情况和发病部位将手术前肿瘤分为1~4期,结合外科手术和病理镜下情况又分为术后Ⅰ~Ⅳ组。见表1、表2。根据术前分期和外科病理分组、组织学类型,将横纹肌肉瘤分为低风险组、中风险组、高风险组[11-12]。国际横纹肌肉瘤研究组(Intergroup Rhabdomyosarcoma Study Group,IRSG)根据先前的研究将患者分配到不同的治疗组来决定治疗方案。近年来,IRSG与2个大型儿科肿瘤治疗合作组(国际肾母细胞瘤研究组以及来自COG的研究组)合并,因此,新的儿童软组织肉瘤治疗方案是由COG软组织肉瘤委员会(COG-STS)来决定的[12-13]
横纹肌肉瘤风险分组过程包括以下步骤:①评估分期(TNM 1、2、3、4期):确定原发部位、肿瘤大小(最大直径)和有无区域淋巴结转移和/或远隔转移。②评估局部肿瘤分组(Ⅰ、Ⅱ、Ⅲ、Ⅳ组):由外科手术/活检术后情况决定,并且根据病理对边缘和淋巴结疾病进行评估。③评估风险组(低、中、高):根据分期、分组和病理。最终将患者分入低、中、高风险组[11-15]。见表3。
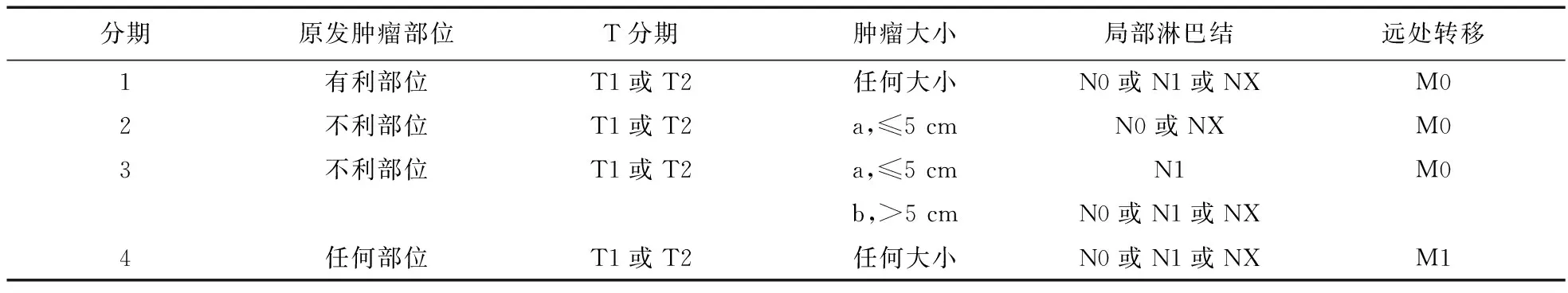
表1 儿童肿瘤协作组软组织肉瘤委员会:术前分期系统
注:T1.肿瘤局限于解剖学原发部位(非侵袭性),T2.肿瘤扩展和/或固定于周围组织(侵袭性);a.肿瘤最大直径≤5 cm,b.肿瘤最大直径>5 cm;N0.无临床局部淋巴结侵袭,N1.临床局部淋巴结侵袭,NX.局部淋巴结未检,无信息;M0.无转移,M1.转移
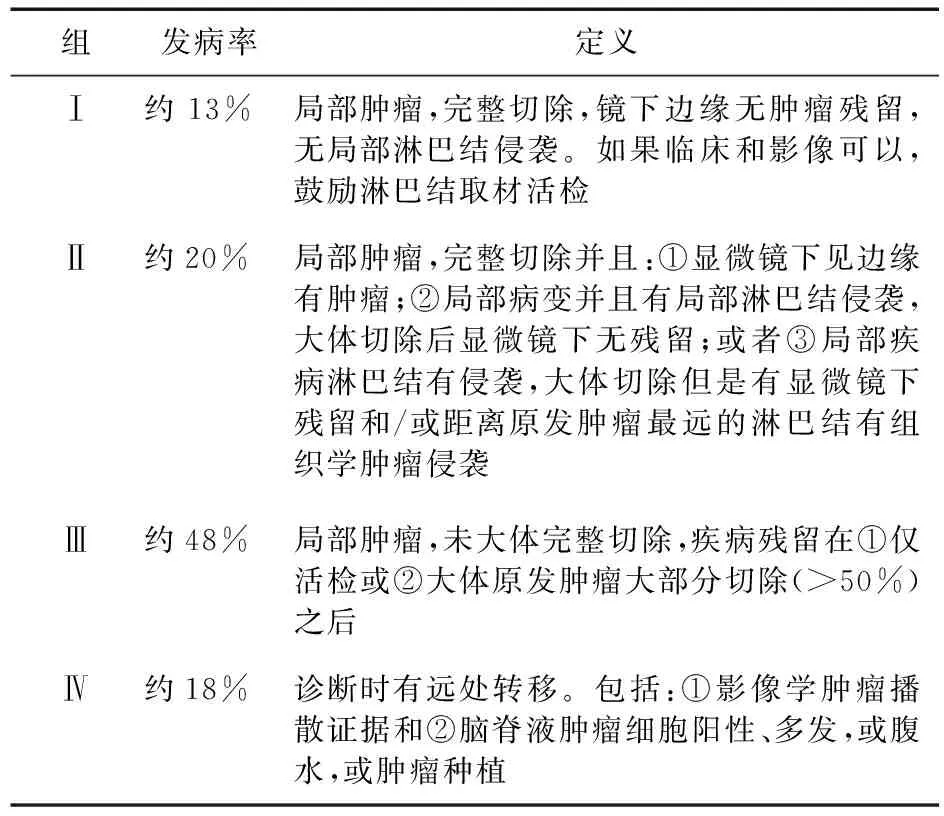
表2 儿童肿瘤协作组软组织肉瘤委员会:外科病理分组系统
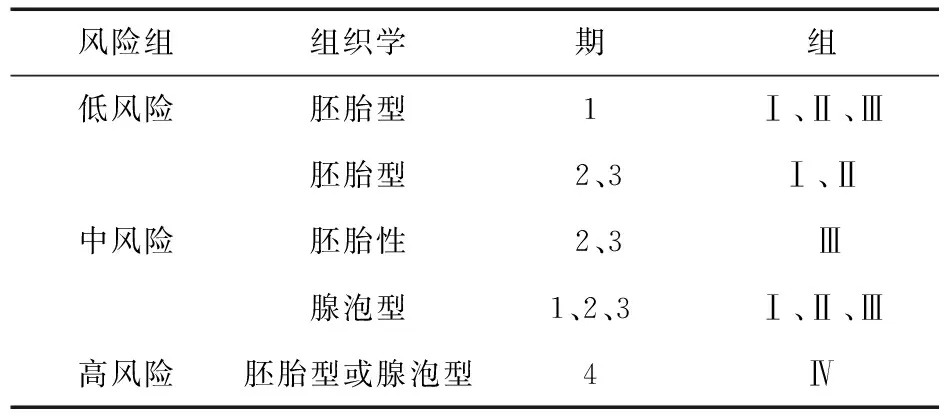
表3 儿童肿瘤协作组软组织肉瘤委员会:横纹肌肉瘤风险分组
既往研究表明,对于部分局部胚胎型横纹肌肉瘤的患者,经过长春新碱,更生霉素,加或不加环磷酰胺,加或不加放疗,5年无进展生存率为78%~89%,总生存率高于90%[9]。对于低风险组胚胎型横纹肌肉瘤的部分患者,仅应用长春新碱和更生霉素两药联合的方案(不加环磷酰胺)在国际上逐渐得到认可,D9602-A方案采用长春新碱加更生霉素45周的化疗方案(如有肿瘤残留加用放疗),5年无进展生存率为89%。取得了非常确切的疗效。见表4。

表4 D9602(1997-2004)A方案
注:长春新碱:<1岁,0.025 mg/kg;1~3岁,0.05 mg/kg;≥3岁,1.5 mg/m2(最大剂量2 mg)。更生霉素:<1岁,0.025 mg/kg;≥1岁,0.045 mg/kg(最大剂量2.5 mg)。放疗患者需要调整化疗方案。第12周开始重复0~11周方案,共4次,第45周化疗全部结束
本组3例患者中,2例原发部位在睾丸旁、1例原发部位在眼眶周围,3例低风险组胚胎型横纹肌肉瘤患者,按照D9602-A方案应用长春新碱联合更生霉素化疗,治疗顺利,无一例出现3~4级血液学及非血液学毒性反应。目前最长随访时间超过3年,最短为1年,患者一般状态良好,未出现肿瘤复发转移。
在我国,儿童胚胎型横纹肌肉瘤病理诊断明确后,可参照COG软组织肉瘤委员会的风险分组原则进行分组,低风险组患儿可以参照COG D9602-A方案进行治疗。本研究结果表明,应用长春新碱联合更生霉素治疗低风险胚胎型横纹肌肉瘤疗效确切,患者耐受良好。期待针对我国儿童横纹肌肉瘤的大样本临床研究能够开展,为我国横纹肌肉瘤患儿的治疗提供更多的依据。另外,针对不同分子病理分型的靶向治疗和个体化治疗也是未来的重要研究方向[16-22]。
[1]Gurney JG,Severson RK,Davis S,et al.Incidence of cancer in children in the United States.Sex-,race-,and 1-year age-specific rates by histologic type[J].Cancer,1995,75(8):2186-2195.
[2]Ries LA,Kosary CL,Hankey BF,et al.SEER cancer statistics review,1973-1996[EB/OL].http://seer.cancer.gov/archive/csr/1973_1999/.[2015-3-3]
[3]Ognjanovic S,Linabery AM,Charbonneau B,et al.Trends in childhood rhabdomyosarcoma incidence and survival in the United States,1975-2005[J].Cancer,2009,115(18):4218-4126.
[4]Malempati S,Rodeberg DA,Donaldson SS,et al.Rhabdomyosarcoma in infants younger than 1 year:a report from the Children's Oncology Group[J].Cancer,2011,117(15):3493-3501.
[5]夏佳东,章宜芬,陈赟,等.睾丸胚胎性横纹肌肉瘤临床诊治(附3例报告)[J].现代肿瘤医学,2013,21(4):805-808.
[6]王磊,张谦,范应中,等.睾丸及睾丸旁胚胎型横纹肌肉瘤三例诊疗报告及文献复习[J].中华小儿外科杂志,2015,36(5):383-386.
[7]吴昕,李平,谢莉,等.鼻部胚胎型横纹肌肉瘤13例临床分析[J].临床耳鼻咽喉头颈外科杂志,2008,22(6):338-341.
[8]刘建民,梁平,卿超群.化疗联合放射治疗鼻腔胚胎型横纹肌肉瘤1例[J].实用医学杂志,2011,27(6):938.
[9]Raney RB,Walterhouse DO,Meza JL,et al.Results of the Intergroup Rhabdomyosarcoma Study Group D9602 protocol,using vincristine and dactinomycin with or without cyclophosphamide and radiation therapy,for newly diagnosed patients with low-risk embryonal rhabdomyosarcoma:a report from the Soft Tissue Sarcoma Committee of the Children′s Oncology Group[J].J Clin Oncol,2011,29(10):1312-1318.
[10]Smith MA,Altekruse SF,Adamson PC,et al.Declining childhood and adolescent cancer mortality[J].Cancer,2014,120(16):2497-2506.
[11]Weiss AR,Lyden ER,Anderson JR,et al.Histologic and clinical characteristics can guide staging evaluations for children and adolescents with rhabdomyosarcoma:a report from the Children′s Oncology Group Soft Tissue Sarcoma Committee[J].J Clin Oncol,2013,31(26):3226-3232.
[12]Lawrence W Jr,Gehan EA,Hays DM,et al.Prognostic significance of staging factors of the UICC staging system in childhood rhabdomyosarcoma:a report from the Intergroup Rhabdomyosarcoma Study(IRS-II)[J].J Clin Oncol,1987,5(1):46-54.
[13]Lawrence W Jr,Anderson JR,Gehan EA,et al.Pretreatment TNM staging of childhood rhabdomyosarcoma:a report of the Intergroup Rhabdomyosarcoma Study Group.Children's Cancer Study Group.Pediatric Oncology Group[J].Cancer,1997,80(6):1165-1170.
[14]Raney RB,Anderson JR,Barr FG,et al.Rhabdomyosarcoma and undifferentiated sarcoma in the first two decades of life:a selective review of Intergroup Rhabdomyosarcoma Study Group experience and rationale for Intergroup Rhabdomyosarcoma Study V[J].J Pediatr Hematol Oncol,2001,23(4):215-220.
[15]Breneman JC,Lyden E,Pappo AS,et al.Prognostic factors and clinical outcomes in children and adolescents with metastatic rhabdomyosarcoma-a report from the Intergroup Rhabdomyosarcoma Study IV[J].J Clin Oncol,2003,21(1):78-84.
[16]Renshaw J,Taylor KR,Bishop R,et al.Dual blockade of the PI3K/AKT/mTOR (AZD8055) and RAS/MEK/ERK (AZD6244) pathways synergistically inhibits rhabdomyosarcoma cell growth in vitro and in vivo[J].Clin Cancer Res,2013,19(21):5940-5951.
[17]Yan S,Li Z,Thiele CJ.Inhibition of STAT3 with orally active JAK inhibitor,AZD1480,decreases tumor growth in neuroblastoma and pediatric sarcomas in vitro and in vivo[J].Oncotarget,2013,4(3):433-445.
[18]Szewczyk B,Skrzypek K,Majka M.Targeting MET receptor in rhabdomyosarcoma:rationale and progress[J].Curr Drug Targets,2015,9.[Epub ahead of print]
[19]Megiorni F,McDowell HP,Camero S et al.Crizotinib-induced antitumor activity in human alveolar rhabdomyosarcoma cells is not solely dependent on ALK and MET inhibition[J].J Exp Clin Cancer Res,2015,6(34):112.
[20]American Society of Clinical Oncology.American Society of Clinical Oncology 2013 Educational Book May 31- June 4,2013[C].2013:420-424.
[21]Hopman S,Merks J,Eussen H,et al.Structural genome variations in individuals with childhood cancer and tumour predisposition syndromes[J].Eur J Cancer,2013,49(9):2170-2178.
[22]Geoerger B,Kieran MW,Grupp S,et al.Phase II trial of temsirolimus in children with high-grade glioma,neuroblastoma and rhabdomyosarcoma[J].Eur J Cancer,2012,48(2):253-262.
Efficacy of vincristine and dactinomycin chemotherapy according to D9602-A regimen in the treatment of children with low-risk embryonal rhabdomyosarcoma
CAI Wei-song*,MA Sai-nan,WANG Qian,CHEN Huan-huan,WU Rong
(Department of Oncology,Shengjing Hospital of China Medical University,Shenyang 110004,China)
ObjectiveTo further understand the rhabdomyosarcoma and make the risk grouping criteria clear,and to evaluate the therapeutic effect and safety of vincristine and dactinomycin chemotherapy according to D9602-A regimen in the treatment of children with low-risk embryonal rhabdomyosarcoma in China.MethodsThe data of three pediatric patients with low-risk embryonal rhabdomyosarcoma treated with vincristine and dactinomycin chemotherapy according to D9602-A regimen in our hospital in recent years were retrospectively analyzed,and the efficacy and side effects were evaluated.ResultsThree cases were all disease-free alive till now with good general performance.ConclusionVincristine and dactinomycin chemotherapy according to D9602-A regimen has good effect and good tolerance in pediatric patients in China with low-risk embryonal rhabdomyosarcoma.
Rhabdomyosarcoma;Chemotherapy;Vincristine;Dactinomycin
2015-12-28
中国医科大学附属盛京医院肿瘤科,沈阳 110004
10.14053/j.cnki.ppcr.201608006

