血管紧张素Ⅱ在缺氧诱导的人肺成纤维细胞表型转化及胶原合成中的作用
刘珊珊 王浩彦 周秀梅
·基础研究·
血管紧张素Ⅱ在缺氧诱导的人肺成纤维细胞表型转化及胶原合成中的作用
刘珊珊王浩彦周秀梅
目的:探讨血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)在缺氧诱导的人肺成纤维细胞(human lung fibroblast,HLF)表型转化及胶原合成中的作用。方法:在缺氧条件下培养HLF-1细胞株,将细胞分为AngⅡ组、AngⅡ+替米沙坦(TST)组和对照组。采用免疫荧光法检测HLF-1细胞α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达水平;采用Western blot法检测HLF-1细胞Ⅰ型胶原(collagen typeⅠ,Col-Ⅰ)蛋白的表达水平。结果:AngⅡ组HLF-1细胞α-SMA和Col-Ⅰ蛋白的表达水平较对照组明显上调,AngⅡ+TST组α-SMA和Col-Ⅰ蛋白的表达水平较AngⅡ组明显下降。结论:AngⅡ/血管紧张素Ⅱ1型受体信号通路可诱导缺氧性HLF表型转化以及胶原合成。
血管紧张素Ⅱ;血管紧张素Ⅱ1型受体;缺氧;人肺成纤维细胞;表型转化;Ⅰ型胶原蛋白
缺氧性肺动脉高压是肺动脉高压的常见类型,其发病机制目前尚未完全阐明。缺氧性肺血管重构(hypoxia pulmonary vascular remodeling,HPVR)在缺氧性肺动脉高压的形成中起关键作用。越来越多的证据表明,肺血管外膜成纤维细胞增殖活化、胶原纤维等细胞外基质合成增加是HPVR形成的重要环节。
成纤维细胞的主要功能是分泌胶原蛋白,是细胞外基质的主要来源细胞。血管紧张素Ⅱ(AngⅡ)是肾素-血管紧张素系统(RAS)的重要效应分子。研究发现,在肺动脉高压的发病机制中,AngⅡ作为一种细胞因子促进肺血管重构[1-2]。
本研究在体外缺氧条件下培养人肺成纤维细胞(human lung fibroblast,HLF),观察缺氧条件下AngⅡ及血管紧张素Ⅱ 1型受体(AT1R)对HLF表型转化及Ⅰ型胶原(collagen type Ⅰ,Col-Ⅰ)蛋白合成的影响,初步探讨缺氧条件下人肺血管外膜成纤维细胞胶原合成调控的机制。
1 材料和方法
1.1材料
HLF-1细胞株由中国科学院上海生命科学研究院细胞资源中心提供。小鼠抗人α-tubulin(T-6074)抗体、AngⅡ、替米沙坦(telmisartan,TST)购自Sigma-Aldrich公司。山羊抗人Col-Ⅰ蛋白抗体(sc-25974)、驴抗山羊IgG-HRP抗体(sc-2304)、山羊抗小鼠IgG-HRP抗体(sc-2302)购自Santa Cruz Biotechnology公司。Triton X-100购自福州迈新生物技术开发有限公司。Alexa Fluor 488山羊抗兔IgG抗体(A11008)购自Life Technologies公司。细胞核与细胞质蛋白抽提试剂盒购自杭州碧云天生物技术研究所。
1.2方法
1.2.1HLF-1细胞的培养及分组HLF-1细胞在37℃、5%CO2的培养箱中静置培养。当细胞生长至融合状态时,用0.25%胰蛋白酶消化细胞,并进行传代培养。取第3~6代细胞用于后续实验。实验前将培养基更换成无血清的DMEM培养基培养24 h,使细胞生长处于静止状态。
缺氧条件下细胞的培养过程如下:在指定时间内,将HLF-1细胞置于37℃、体积浓度93% N2、5%CO2、2%O2的培养箱中培养。在缺氧暴露开始和结束时用测氧仪监测培养箱中的氧浓度。
按实验要求将HLF-1细胞随机分为下列3组。(1)对照组:加入DMSO;(2)AngⅡ组:用AngⅡ(1.0 μmol/L)处理HLF-1细胞1 h;(3)AngⅡ+TST组:用AngⅡ(1.0 μmol/L)处理HLF-1细胞1 h,然后加入TST(50 μmol/L)培养1 h。
1.2.2Western blot采用细胞核与细胞质蛋白抽提试剂盒提取细胞蛋白成分。蛋白质经变性、电泳、转膜、封闭后分别加入Col-Ⅰ抗体(1∶500)和抗α-tubulin抗体(1∶5 000),4℃孵育过夜。洗膜后加入辣根过氧化酶(HRP)标记的二抗(1∶2 000),室温孵育2 h。洗膜后加入增强的化学发光试剂ECL显色,X线胶片曝光。将胶片扫描后,测定各条带光密度值。将目的条带与α-tubulin光密度值的比值作为蛋白的相对表达量。
1.2.3免疫荧光法室温下用含4%多聚甲醛的PBS溶液固定HLF-1细胞,之后用含0.1% Triton X-100的PBS液孵育细胞,Tris-HCl缓冲液冲洗 2次后加入5%山羊血清100 μL,室温下孵育5 min。Tris-HCL缓冲液冲洗2次。加入100 μL兔抗人α-平滑肌肌动蛋白(α-SMA)抗体(1∶200),4℃孵育过夜。Tris-HCL缓冲液冲洗3次后,加入100 μL Alexa Fluor 488标记的山羊抗兔IgG抗体(1∶100),室温下孵育30 min。冲洗后加入含有DAPI的封片剂包埋。采用Nikon TiE 2 000共聚焦荧光显微镜获取图像,并测量α-SMA蛋白的平均荧光强度值。
1.3统计学分析
采用SPSS 17.0软件进行统计学分析,所有数据以均数±标准差表示。多组数据的比较采用F 方差检验,两组数据的比较采用t 检验,以P< 0.05为有统计学差异。
2 结果
2.1α-SMA蛋白的表达
Ang Ⅱ组α-SMA蛋白的平均荧光强度明显高于DMSO组,Ang Ⅱ+TST组α-SMA蛋白的平均荧光强度较Ang Ⅱ组明显下降(P<0.01,见图1、表1)。
2.2Col-Ⅰ蛋白的表达
AngⅡ组Col-Ⅰ蛋白的表达较DMSO组明显升高;AngⅡ+TST组Col-Ⅰ蛋白的表达较AngⅡ组明显下降(P<0.01,见图2、表1)。
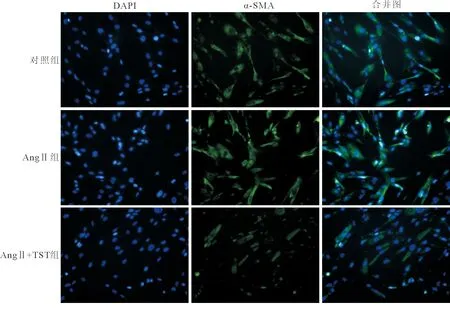
图1 各组HLF-1细胞α-SMA蛋白的表达(×400)
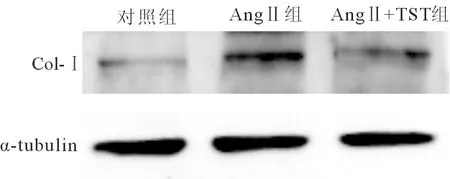
图2 各组细胞Col-Ⅰ蛋白的表达

组别α-SMACol-Ⅰ/α-tubulin对照组1.13±0.1522.21±2.25AngⅡ组3.02±0.21(1)79.63±9.07(1)AngⅡ+TST组1.71±0.41(2)30.16±5.76(2)
注:与对照组比较,(1)P<0.01;与AngⅡ组比较,(2)P<0.01
3 讨论
缺氧性肺血管收缩和HPVR是缺氧性肺动脉高压的两大主要病理生理基础。HPVR在缺氧性肺动脉高压的形成中起关键性作用,肺血管壁细胞增殖、管壁增厚、管腔狭窄是HPVR的主要病理特征[3]。
血管外膜主要由疏松结缔组织构成,成纤维细胞是血管外膜最主要的细胞成分,其主要功能是分泌胶原等细胞外基质成分。以往对HPVR的研究多集中在肺血管内皮细胞和中层平滑肌细胞,而忽略了肺血管外膜改变在HPVR中的作用。越来越多的证据表明,在低氧条件下,肺血管外膜成纤维细胞的增殖活化、表型转化是影响HPVR形成的另一重要环节。在低氧暴露的早期,血管外膜就发生了明显的重构变化,表现为外膜成纤维细胞的增殖活化[4]。
组织中的成纤维细胞可活化和表型转化为肌成纤维细胞[5-6]。肌成纤维细胞是介于成纤维细胞和平滑肌细胞之间的间充质来源细胞。在低氧条件下,血管外膜成纤维细胞可转化为肌成纤维细胞,后者在形态和功能上与肺动脉平滑肌相似,具有收缩和迁移的功能;肌成纤维细胞同时仍有成纤维细胞的功能和特性,且其合成细胞基质的能力强于成纤维细胞,是合成细胞基质、胶原的主要细胞。α-SMA是肌成纤维细胞的特征性标志蛋白,是研究成纤维细胞表型转化为肌成纤维细胞的特异性标志物。
Ang Ⅱ是RAS重要的效应物质,循环中以及局部自分泌或旁分泌的AngⅡ主要通过与其受体结合,在不同靶组织和器官中发挥生物活性作用[7-8]。有文献报道,血管外膜存在AngⅡ受体,经AngⅡ灌注的SD大鼠的胸主动脉血管外膜胶原蛋白沉积增多[9]。
Ang Ⅱ可促进血管成纤维细胞增生并表达Col-Ⅰ,从而促进血管结构性重构的发生[10]。Ang Ⅱ的绝大多数生物学作用都是由AT1R介导的。
本实验体外培养HLF细胞,模拟缺氧性肺动脉高压的慢性缺氧环境,检测AngⅡ/AT1R信号通路对缺氧性HLF-1细胞Col-Ⅰ蛋白表达及肌成纤维细胞特征性标志物α-SMA蛋白表达的影响。结果显示,AngⅡ可显著促进HLF-1细胞表达α-SMA和Col-Ⅰ,加入AT1R阻滞剂TST后,HLF-1细胞α-SMA和Col-Ⅰ蛋白的表达受到显著抑制。
由此推测,作为RAS的重要效应分子,AngⅡ通过AT1R途径参与了缺氧性HLF细胞胶原合成的调控,并可能在肺动脉高压血管重构的发生、发展中起重要作用。AngⅡ不仅可以直接促进缺氧性HLF-1细胞Col-Ⅰ蛋白的合成,而且可以促进HLF-1细胞向肌成纤维细胞的转化,促进肺血管外膜结构和功能的变化,进一步导致血管壁增厚变硬、管腔狭窄和血管重构。
缺氧性HLF细胞胶原的合成过程复杂,涉及多种细胞、细胞因子及信号转导通路。本研究未探讨RAS其他组分在此过程中的作用,且本研究为体外实验,有一定的局限性。
[1]Jeffery TK,Wanstall JC.Pulmonary vascular remodeling:a target for therapeutic intervention in pulmonary hypertension [J].Pharmacol Ther,2001,92(1):1-20.
[2]Mandegar M,Fung YC,Huang W,et al.Cellular and molecular mechanisms of pulmonary vascular remodeling:role in the development of pulmonary hypertension [J].Microvasc Res,2004,68(2):75-103.
[3]田真,蔡鑫,唐碧双.孔钾通道TASK1与缺氧性肺血管收缩的研究进展[J].国际心血管病杂志,2013,40(4):236-239.
[4]Stenmark KR,Fagan KA,Frid MG.Hypoxia-induced pulmonary vascular remodeling:cellular and molecular mechanisms [J].Circ Res,2006,99(7):675-691.
[5]Willis BC,duBois RM,Borok Z.Epithelial origin of myofibroblasts during fibrosis in the lung [J].Proc Am Thorac Soc,2006,3(4):377-382.
[6]李秀,刘巍.肌成纤维细胞在心肌梗死后重构中的作用及机制[J].国际心血管病杂志,2014,41(2):88-90.
[7]De Gasparo M,Catt KJ,Inagami T,et al.The angiotensin Ⅱ receptors [J].Pharmacol Rev,2000,52(3):415-472.
[8]Filippatos G,Tilak M,Pinillos H,et al.Regulation of apoptosis by angiotensin Ⅱ in the heart and lungs [J].Int J Mol Med,2001,7(3):273-280.
[9]Sun Y,Ramires FJ,Weber KT.Fibrosis of atria and great vessels in response to angiotensin Ⅱ or aldosterone infusion [J].Cardiovasc Res,1997,35(1):138-147.
[10]陶婷,朱鼎良,龚兰生.血管紧张素Ⅱ对血管外膜成纤维细胞Ⅰ型胶原合成及其mRNA表达的影响[J].中国病理生理杂志,2000,16(5):405-408.
(收稿:2015-12-15修回:2016-04-04)
(本文编辑:梁英超)
Effect of angiotensin Ⅱ on hypoxia-induced phenotype switch and collagen synthesis of human lung fibroblasts
LIU Shanshan1,WANG Haoyan2,ZHOU Xiumei1.
1.Department of Respiratory Medicine,Beijing Fengtai Hospital,Beijing100071; 2.Department of Respiratory Medicine,Beijing Friendship Hospital,Capital Medical University,Beijing100050,China
Objective:To explore the effect of angiotensin Ⅱ(AngⅡ) on hypoxia-induced phenotype switch and collagen synthesis of human lung fibroblasts (HLF).Methods:The HLF-1 cell line was cultured in hypoxic condition,and randomly divided into three groups:control group,AngⅡ group,and AngⅡ+ telmisartan (TST) group.The α-smooth muscle actin (α-SMA )protein expression levels were measured by immunofluorescence localization analysis.The collagen type Ⅰ (Col-Ⅰ) protein expression levels were detected by Western blot.Results:The expression levels of α-SMA and Col-Ⅰ in hypoxic HLF-1 cells were significantly increased after AngⅡ treatment and the effect was significantly inhibited by telmisartan,an angiotensin Ⅱ type 1 receptor inhibitor.Conclusion:AngⅡ/angiotensin Ⅱ type 1 receptor can induce phenotype switch and collagen synthesis in hypoxic HLF.
Angiotensin Ⅱ; Angiotensin Ⅱ type 1 receptor; Hypoxia; Human lung fibroblast; Phenotype switch; Collagen typeⅠ
100071北京丰台医院呼吸科(刘珊珊,周秀梅);100050首都医科大学附属北京友谊医院呼吸科(王浩彦)
刘珊珊,Email:liushanshan721cn@126.com
10.3969/j.issn.1673-6583.2016.04.011

