酸性电镀液铜含量测定方法的绿色化
韩迎春,俞亚冕,周锦兰
(1.华中科技大学化学与化工学院,武汉 430074;2.昆明理工大学冶金与能源工程学院,昆明 650093)
酸性电镀液铜含量测定方法的绿色化
韩迎春1,俞亚冕2,周锦兰1
(1.华中科技大学化学与化工学院,武汉430074;2.昆明理工大学冶金与能源工程学院,昆明650093)
酸性电镀液,铜含量,光度法,绿色化,淀粉
电镀铜已被广泛应用于家用电器、电子产品、日用五金、汽车配件、摩托车配件和塑料电镀中[1]。其工艺多样,最常用的有酸性光亮镀铜、氰化镀铜和焦磷酸镀铜[2-3]。酸性光亮镀铜因镀液成分简单且稳定、电流效率高、镀层光亮整平、沉积速度快、成本相对较低、工艺操作维护方便等优点,已成为取代氰化物镀铜和焦磷酸盐镀铜的主要镀种[4]。该工艺镀铜的镀层质量与镀液中铜离子及氯离子浓度密不可分。铜离子浓度一般应控制在76~88g/L范围内[5]。若含量过高,铜盐则容易在阳极表面形成结晶析出,造成阳极钝化;而含量过低,则上镀速率慢,电流小,容易触氢,致使结晶粗糙,使镀层光亮度下降。氯离子是酸性镀铜中不可缺少的无机酸离子,其浓度一般要求为80~120mg/L,缺少或含量过低都不能获得理想的光亮铜镀层,含量过高时会产生麻点[6-8]。严格控制工艺规范是维护电镀液的重要手段,因此,酸性光亮镀铜体系的铜离子与氯离子浓度的有效测定极为必要。有关氯离子的检测,查阅文献[9],本文的重点是酸性光亮镀铜液中铜离子含量的测定方法。
电镀液中铜含量测定方法有电感耦合等离子发射光谱(ICP-AES)与原子吸收光谱法[10-11]、光度法[11-13]、碘量法[14]与极谱法[15]。ICP-AES与原子吸收光谱法具有选择性强、灵敏度高等优点,但是仪器较为贵重,难以在本科学生开展课外创新活动中普及。碘量法与极谱法均存在操作烦琐等不足,分光光度法因仪器普及和容易操作等特点非常适应在大学生课外研究中使用。光度法测铜常用的显色剂有二乙氨硫代甲酸钠(DDTC)、双环己草酰二腙(BCO)与新亚铜灵(2,9-二甲基-1,10-菲啰啉)等。文献[12-13]分别报道了在碱性条件下,用柠檬酸三铵作掩蔽剂,用BCO显色测铜的分析方法。但铜与BCO生成络合物的稳定性常小于其与DDTC的络合产物,导致显示速度较慢,检出限量较高,并且在应用中有BCO法测定结果偏低的报道。国标采用DDTC或新亚铜灵与铜显色测量的方法测定,实验经显色、三氯甲烷或四氯化碳萃取水相中不稳定的DDTC(新亚铜灵)与铜的络合物、测定分析3步完成。三氯甲烷有较大的毒性,用其萃取污染环境,不符合绿色化要求。基于现状,探究准确、高效、环境友好的测定方法极为必要。
本文介绍一种以DDTC为显色剂,柠檬酸铵与乙二胺四乙酸二钠(EDTA)同作掩蔽剂,氨水与柠檬酸铵组成缓冲溶液,淀粉作稳定剂,水相分光光度法直接测铜,实现了测定方法的绿色化。
1 实验部分
1.1仪器与试剂
仪器:UV2550紫外可见分光光度计,日本岛津公司;AA300原子吸收光谱仪,PERKINELMER公司。
试剂:所有试剂均为分析纯(上海国药)。
铜标准储备液(100.0μg/mL):准确称量0.393 0gCuSO4·5H2O置于烧杯中,加入30mLH2SO4(3mol/L),用蒸馏水溶解后,转移至1000mL容量瓶中,定容,摇匀后备用。
氨水-柠檬酸铵(NH3·H2O—Cit)缓冲溶液:将150g柠檬酸铵以蒸馏水溶解后,加入浓氨水100mL,稀释至1000mL,用酸度计加以校准。
0.01mol/LEDTA溶液:称取3.72gEDTA,溶于适量蒸馏水中,稀释至1000mL,备用。
DDTC试剂(10g/L):称取1g铜试剂,溶于100mL氢氧化钠(0.01mol/L)溶液中,滤去不溶物备用。
淀粉溶液(5g/L):将2.5g可溶性淀粉以少许蒸馏水拌匀,慢慢加到已充分沸腾的500mL蒸馏水中,再加入0.2g硼酸,2mLAgNO3(0.01mol/L)溶液,继续微沸5min,冷却,备用。
1.2标准曲线的绘制
铜标准溶液(10.0μg/mL):用1.0mL的移液枪吸取1.0mL铜标准储备液于10mL的容量瓶中,加入0.3mLH2SO4(3mol/L),以蒸馏水稀释至刻度。将铜标准溶液(10.0μg/mL)分1.0,2.0,3.0,4.0,5.0,6.0 ,7.0,8.0mL于9只10mL的容量瓶中,在每只容量瓶中依次加入1.0mLNH3·H2O-Cit缓冲液、1.0mL0.01moL/LEDTA溶液、1.0mL5g/L淀粉溶液、1.0mL10g/LDDTC溶液,每加入一种溶液后立即摇匀,以蒸馏水定容。
将上述标准溶液显色后,以试样空白为参比溶液,用紫外分光光度计扫描,测得该体系的最大吸收波长λ为450nm。在该波长处,分别测定不同铜标准溶液的吸光度。以吸光度为纵坐标,铜的质量浓度为横坐标作图,得到测定铜的标准曲线。
1.3试样预处理
准确量取某电镀厂酸性光亮镀铜液5.0mL于50mL烧杯中,加入25mL蒸馏水、2mL浓硝酸和0.5mL高氯酸,于电热板上加热至微沸,保持5min,冷却后转入1000mL容量瓶中,用蒸馏水定容。
1.4实验方法
准确量取预处理镀铜液100μL于10.0mL容量瓶中,加入5.0mL蒸馏水后,依次加入1.0mLNH3·H2O-Cit缓冲液、1.0mL0.01mol/LEDTA溶液、1.0mL5g/L淀粉溶液、1.0mL10g/LDDTC溶液,再以蒸馏水定容,每加一种溶液后要立即摇匀。显色后,以试样空白为参比,用1cm比色皿在450nm波长下测定其吸光度。
2 结果与讨论
2.1实验条件的优化
铜含量测定受体系pH值、选择的吸收波长、显色剂的用量及显色时间等多种因素的影响,本实验从如下几方面进行了优化。
2.1.1不同波长下待测物质的吸收率
按实验方法操作,以水为参比液,在350 ~600nm范围内测试了Cu2 +离子浓度为3.2μg/mL的DDTC络合物在不同波长下的吸光度,结果如图1所示。结果表明,λ在448 ~ 453nm之间试样体系有最大吸光度。故本实验选择450nm作为体系的检测波长。

图1 吸收光谱图
2.1.2体系pH值的影响
二乙氨硫代甲酸钠萃取光度法是标准方法[11]。在氨性介质中(pH值在8.0~10.0范围内) ,Cu2 +离子与DDTC生成黄棕色配位化合物。参考标准方法,实验中配制了pH值分别为7.5,8.0,8.5,9.0,9.5和10.0的系列待测溶液,按实验方法测定其吸光度。结果表明,当pH值在7.5~9.5之间时,反应溶液的吸光度基本稳定,故本实验选用pH值8.5的NH3·H2O-Cit缓冲体系。
2.1.3增溶剂的选取
2.1.4显色剂的用量
在7只10mL的容量瓶中,分别加入3.0mL10.0μg/mL铜标准溶液、1.0mLNH3·H2O-Cit缓冲液、1.0mL0.01mol/LEDTA溶液和1.0mL5g/L淀粉溶液后,依次加入0.50、0.75、 1.00、 1.25、 1.50、 1.75和2.00mL10g/LDDTC溶液,以蒸馏水定容后测定吸光度,实验结果见如图2所示。
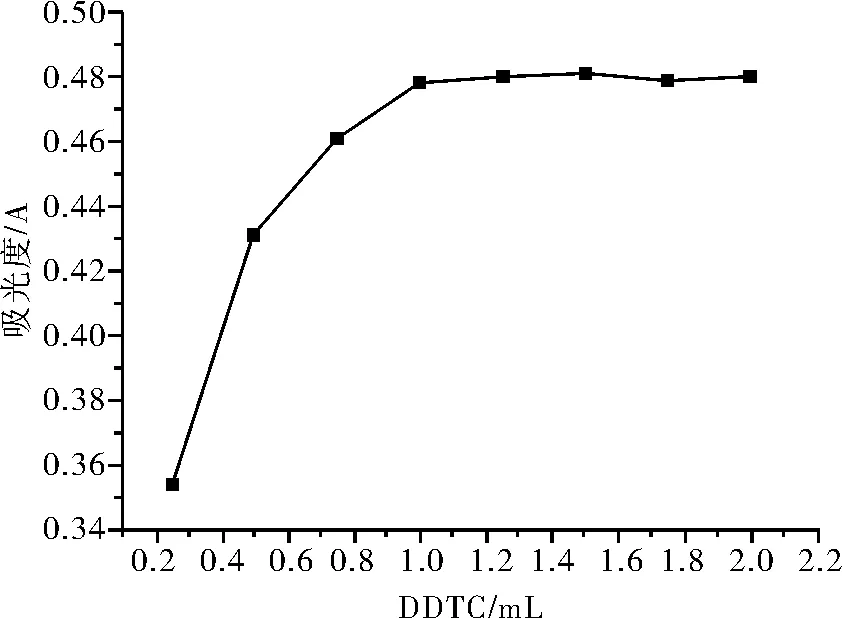
图2 显色剂的用量与络合物吸光度的关系
由图可知,当显色剂的用量加到1.0mL时,体系的吸光度达到最大值,进一步加大用量,吸光度基本保持不变,故实验中选取加入1.0mL的显色剂。
2.2线性范围
在450nm处测得不同浓度铜标准的吸光度分别为0.130,0.311,0.478,0.662,0.876,1.014,1.241,1.375,以吸光度为纵坐标,以铜的质量浓度为横坐标作图,铜标准曲线如图3所示。

图3 标准曲线图
由图可知,在此体系中,溶液吸光度(y)与溶液中铜的浓度(x)的线性关系为y=-0.052 71+0.180 8x,线性相关系数r= 0.998 05。铜离子浓度在 1.0~8.0μg/mL的范围内符合朗伯-比尔定律。
2.3重现性与加标回收率

表1 酸性电镀液的铜含量及加标回收实验测定结果
2.3试样分析
2.3.1试样预处理条件的选择
酸性光亮电镀液中需添加含硫类光亮剂,其硫化物会与铜离子发生作用,会干扰检测,同时镀液可能含有少量一价铜,如不将其转化为二价铜也会影响检测结果。实验时尝试了用浓硝酸、浓硝酸与高氯酸混合液消除有机物与一价铜的干扰。实验结果表明,浓硝酸与高氯酸混合液消除干扰更有效,故选用浓硝酸与高氯酸混合液作为消化液。
2.3.2酸性电镀液铜含量测定
将消化液稀释到一定的浓度后,按标准溶液的水相光度测定方法,测定某电镀厂提供的4种不同电镀液中铜含量。为鉴定本实验所有方法的可靠性,同时用原子吸收光谱法测定4种电镀液中的铜含量,两种测定方法每组实验均重复3次。结果如表2所示。

表2 酸性电镀液的铜含量
实验结果显示,两种方法的测定结果基本一致。由此说明新的实验方法对电镀液的铜含量分析十分有效。
3 结束语
国标采用DDTC与铜显色的光度法测铜[11],实验经显色、三氯甲烷或四氯化碳萃取水相中不稳定的DDTC与铜的络合物、分析测试3个步骤。三氯甲烷有较大的毒性,用其萃取污染环境,不符合绿色化要求;同时萃取步骤带来了实验的烦琐与操作误差。本文方法采用淀粉作稳定剂,水相DDTC与铜的络合物不需萃取分离,直接用水性光度法测定,实现了测定方法的绿色化。方法操作简单,测定快速,准确度高,重现性好,无污染。
[1]邓正平,邹伟红,赵国鹏,等.酸性镀铜光亮剂的开发[J].电镀与精饰,2009(31):13-16.
[2]LANDOITD.Electrodepositionscienceandtechnologyinthelastquartterofthetwentiethcentury[J].ElectrochemicalSociety,2002(149):9-20.
[3]刘烈炜,郭讽,田炜,等.酸性镀铜添加剂及其工艺的发层回顾[J].材料保护,2001(34):19-20.
[4]高泉涌,赵国鹏,胡耀红.酸性镀铜添加剂研究进展[J].电镀与涂饰,2010(29):26-29.
[5]李立清,李敏,杨丽钦,等.酸性光亮镀铜工艺中非光亮因素对镀层质量的影响[J].电镀与环保,2013(33):21-23.
[6]奚兵.酸性光亮铜镀层不亮因素[J].电镀与环保,2011(31):48-50.
[7]杨胜奇.稀土在金属表面处理工艺中的应用技术[J].材料保护,2008(41):81-84.
[8]袁诗璞,何永强.酸性光亮镀铜液中过多氯离子的去除[J].电镀与涂饰,2013(32):17-21.
[9]韩迎春,周锦兰.酸性镀铜液中氯离子含量的测定[J].实验技术与管理,2013(10):44-46.
[10]彭义华,张优珍,徐艳,等.ICP-AES测定电镀污泥中的Ag、Cu、Ni[J].化工环保,2008(28):369-372.
[11]无锡市环境科学研究所.GB21900-2008,电镀污染物排放标准[S].江苏:无锡市环境科学研究所,2008.
[12]郭崇武.BCO光度法测定碱性镀锌液中微量铜[J].电镀与环保,1992(12):27-28.
[13]刘定富,王华,龙霞.电镀污泥酸浸出液中铜含量的测定[J].无机盐工业,2010(42):60-62.
[14]吴健君.Lix984萃取分离碘量法测定电镀污泥中铜[J].广东化工,2013(40):141.
[15]秦淑琪,何英.测定电镀液中铜、锡的新方法[J].西北师范大学学报(自然科学版),2005(41):52-53.
[16]刘福岭.食品物理与化学分析方法[M].北京:中国轻工业出版社,1987.
Green Method of Determination of Copper Ions in Acid Plating Bath
HAN Yingchun,YU Yamian,ZHOU Jinlan
(1.SchoolofChemistryandChemicalEngineering,HuzhongUniversityofScienceandTechnology,Wuhan430074,China;2.FacultyofMetallurgicalandEnergyEngineering,KunmingUniversityofScienceandTechnology,Kunming650093,China)
acidplatingbath;contentofcopperions;photometry;greening;starch
2015-02-11;修改日期: 2015-03-11
韩迎春(1974-),女,硕士,工程师,主要从事分析化学方面的研究。
O645
Adoi:10.3969/j.issn.1672-4550.2016.04.052

