60Co-γ射线诱变提高长枝木霉菌株利用糖蜜酒精废液产生物量能力
李 玮,曹慕明,陈国品,谢蜀豫,李 献,毕方方,韦俏娜,丁 苏(.广西壮族自治区农业科学院葡萄与葡萄酒研究所,广西 南宁 530007;.广西大学 行健文理学院,广西 南宁 530004)
60Co-γ射线诱变提高长枝木霉菌株利用糖蜜酒精废液产生物量能力
李玮1,曹慕明1,陈国品1,谢蜀豫1,李献2,毕方方2,韦俏娜2,丁苏2*
(1.广西壮族自治区农业科学院葡萄与葡萄酒研究所,广西 南宁 530007;2.广西大学 行健文理学院,广西 南宁 530004)
该研究采用60Co-γ射线辐射的方法,对生物防治菌株长枝木霉(Trichoderma longibrachiatum)JK-15进行诱变育种,以提高其利用甘蔗糖蜜酒精废液产菌体和孢子的能力。经过平板初筛和摇瓶复筛,获得了能够利用单一的甘蔗糖蜜酒精废液大量生成生物量的系列优良突变株,并通过平板对峙试验验证了各突变株的对灰霉病菌的生物防治效果,最终得到优良突变菌株CM-5,其在平板培养基上生长速率达到42.33mm/d,在50m L液体培养体系中生物量(以细胞干质量计)达到2.22 g,平板对峙抑菌率达到66.7%,较出发菌株均有显著提高。经过5次传代培养,菌株CM-5生长速率和抑菌率仍保持较高且稳定,表明其遗传性状稳定。该研究对长枝木霉在炎热地区的生物防治应用具有重要的推动作用。
长枝木霉;诱变;60Co-γ射线辐射;生物防治;微生物育种
木霉(Trichoderma)是一类具有较强生物防治功效的丝状真菌,其具有生长迅速、能分泌多种抑菌物质、能够对植物病原菌进行重寄生等生理特性,因而广泛地用于多种植物病害的生物防治[1-3]。但从自然环境中筛选得到的大多数野生木霉难免存在最适温度区间较小、定殖能力不稳定、抑菌广谱性较差、培养制备商品菌剂成本高等不足。为了解决这些问题,需要研究人员通过长期的微生物育种工作改良野生菌株的缺陷[4-7]。诱变育种是一种简便有效的微生物育种方法,丝状真菌进行诱变育种时通常采用处理孢子而非菌丝的手段,以期能更容易地获得突变菌株的单菌落纯培养物,但真菌微生物孢子具有较厚的孢子壁,对亚硝酸等化学诱变具有显著的阻挡作用,从而影响诱变的效果。相比而言,γ射线、离子注入等物理诱变因子对于孢子壁的穿透能力更强,更适宜应用于对真菌孢子进行诱变处理。在丝状真菌诱变育种过程中,为了减少细胞壁对于诱变剂的阻挡作用,通常先将孢子进行预培养活化,使其萌发[15];也可以将孢子或菌丝体的细胞壁进行酶解,制备成原生质体细胞[16],再利用亚硝酸、紫外线等理化诱变剂处理,以达到提高诱变效果的目的。60Co-γ射线照射是一种优良的物理诱变方法,它具有穿透能力极强的特点,因而将其应用于丝状真菌的诱变育种时,无需进行孢子预培养或原生质体制备,简便高效。
在前期研究中,本课题组从自然环境中筛选获得了对葡萄灰霉病和溃疡病具有较好生物防治效果的野生长枝木霉(Trichoderma longibrachiatum)JK-15。但在研究工作中,菌株JK-15表现出对高温耐受性较差、在廉价的甘蔗糖蜜酒精废液培养基中菌丝体生长及产孢子能力偏弱等缺点,这不利于其在广西等我国南部地区的实际生产和应用。本研究采用60Co-γ射线对木霉孢子进行物理诱变处理,对长枝木霉JK-15进行选育改良,以提高其利用甘蔗糖蜜酒精废液大量生产木霉菌剂的性能,研究结果对于利用华南地区甘蔗制糖工业副产品—糖蜜酒精发酵液制备廉价生防菌剂,并将其应用于葡萄灰霉病防治方面具有重要意义。
1 材料与方法
1.1料与试剂
1.1.1株及原材料
长枝木霉JK-15:由广西农业科学院葡萄与葡萄酒研究所筛选并保藏;灰霉病菌(Botrytiscinerea):由广西农业科学院葡萄与葡萄酒研究所从广西葡萄产区病果中分离并保藏;甘蔗糖蜜酒精废液:取自广西南宁市明阳糖厂。
1.1.2养基
斜面及普通平板培养基采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,去离子水1 000m L,pH自然。
筛选平板培养基:将甘蔗糖蜜酒精废液稀释至2°Bx,加入15~20 g/L琼脂。
液体发酵培养基:将甘蔗糖蜜酒精废液稀释至2°Bx即为液体发酵培养基。
1.2器与设备
EBA 21型高速离心机:德国Hettich zentrifugen公司;J2-21高速冷冻离心机:美国Bechman公司;SPX-250型生化培养箱:上海跃进医疗仪器厂;HVE-50自动灭菌锅:日本HIRAYAMA公司;振荡培养箱:上海苏坤仪器设备有限公司;SW-CJ-1F超净工作台:苏州安泰空气技术有限公司;OLYMPUSCX 41光学显微镜:日本OLYMPUS公司。
1.3法
1.3.1种活化
将保藏的长枝木霉JK-15斜面上的孢子用生理盐水洗下制备成浓度为105个/m L的单孢子悬浮液,稀释涂布于PDA平板上,30℃培养36 h,挑取生长迅速、表面长满绿色孢子的单菌落接种于PDA斜面上,30℃培养3 d,至斜面培养基表面长满孢子。
1.3.2子悬浮液制备
取长满孢子的斜面菌种,用0.9%无菌NaCl溶液将孢子洗下,倒入盛有玻璃珠的三角瓶中,常温条件下200 r/min振荡1 h,使孢子充分分散,用4层无菌擦镜纸过滤,用血球计数板计数并调节孢子悬浮液浓度为106个/m L。
1.3.360Co-γ射线诱变方法
辐射操作由广西南宁神州辐照公司代为进行,选择0.4~2.6 kGy的辐射剂量范围进行试验,按已报道研究的试验方法[8]进行诱变处理,并将平板上单菌落面积大于出发菌株的突变株视为正突变株,计算致死率和正突变率[9]。致死率和正突变率的计算公式如下:

1.3.4变菌株的筛选
将经过诱变的孢子悬浮液进行梯度稀释后涂布于筛选平板上,37℃培养2 d,挑取与出发菌株相比在筛选平板上长势旺盛、菌落扩散快、产孢子量较多的突变菌株单菌落进行斜面保藏,并测定其单菌落直径(mm),同时将其接种于盛有50m L液体发酵培养基的250m L三角瓶中,于37℃、160 r/min振荡培养2 d,抽滤收集菌丝体,于105℃烘干至恒质量后称质量,即为菌体干质量(dry cellweight,DCW),生物量通常可采用细胞干质量表示,生物量(以细胞干质量计)高的突变菌株即为正突变株。
各正突变株采用平板对峙法验证其对灰霉病菌的生物防治效果[10]。将木霉菌株和灰霉病菌分别用无菌牙签接种于筛选平板上,两接种点距离5 cm,以未接种木霉的灰霉病菌平板为空白对照,28℃恒温培养,于36 h和48 h分别测量实验组平板及对照平板中灰霉病菌的菌落直径,记录其生长状况,评估抑菌级别,计算抑菌率。与出发菌株JK-15相比生物防治效果未退化且产孢子丰富的正突变株即为目标优良突变菌株。拮抗系数的分级标准(5级):Ⅰ木霉菌丝占平皿的100%;Ⅱ木霉菌丝占平皿的2/3以上;Ⅲ木霉菌丝占平皿的2/3以下,1/3以上;Ⅳ木霉菌丝占平皿的1/3以下;Ⅴ病原菌丝占平皿的100%。抑菌率的计算式公式如下:

1.3.5变菌株遗传稳定性试验
将选定的优良突变株在斜面培养基上连续接种传代5次,分别测定各代菌株在平板上的生长速率及平板对峙抑菌率[11]。各代菌株的生长速率计算公式如下:

2 结果与分析
2.1适辐射剂量的选择
60Co-γ射线的辐射剂量显著影响微生物诱变育种的效果,辐射剂量过低时,微生物的致死率较低,产生显著突变的机率也较低,从而影响诱变育种的效率;辐射剂量过高时,微生物致死率较高,产生显著突变的机率也较高,但其中目标性状改善的正突变菌株较少。因此,需要通过预试验选择出适宜的诱变辐射剂量,以提高诱变获得正突变菌株的可能性。长枝木霉JK-15在辐射剂量0.4~2.6 kGy区间内的致死率及正突变率结果见图1。

图1 60Co-γ射线辐射剂量对长枝木霉JK-15的致死率及正突变率的影响Fig.1 Effectof60Co-γradiation dosage on the letha lity rate and positivemutation rate of T.longibrachiatum JK-15
由图1可知,在辐射剂量为1.4 kGy时,正突变率达到最高,为7.7%,此时相应的致死率为55.9%,已有研究表明,一般最适诱变条件下的致死率达到80%~90%[12-14],本实验的最适诱变条件下的致死率相对较低,可能是因为较高的诱变强度容易破坏微生物细胞的代谢平衡,从而影响其生长速率,因此本研究中生长较快的正突变株更多的出现在较低诱变强度的条件下。因此,将辐射剂量1.4 kGy定为最适诱变剂量应用于后续工作。
2.2变菌株的筛选
通过平板初筛挑取50株菌落直径大小比出发菌株大25%以上、分生孢子密集的突变菌株进行摇瓶培养复筛,结果如图2所示。
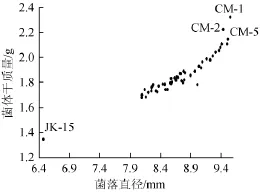
图2 平板培养菌落直径与液体摇瓶培养菌体干质量的相关性Fig.2 Correla tion of colony diameter of p late cultivation with cell dry mass o f liquid shake flask culture
由图2可知,突变菌种的菌落直径和菌体干质量均大于出发菌株JK-15的菌落直径和菌体干质量,且各突变株在平板上的单菌落直径与其液体摇瓶培养所得的菌体干质量呈现良好的正相关,说明菌株在平板上菌落的大小能较好地反映出其在液体发酵时产生的生物量,即液体发酵生物量大的菌株,其在平板上的菌落相应较大。根据这一现象,在今后的育种工作中,可以直接根据平板菌落的大小筛选生物量大的突变株,而不需要逐一对其进行液体发酵测试。从本实验诱变获得的突变株中,选择生物量较高的5株,重新编号为CM-1~CM-5并用于后续试验,它们在平板上的菌落直径和液体培养获得的菌体干质量分别达到9.61mm/2.410 g、9.55mm/2.321 g、9.41mm/2.109 g、9.51mm/ 2.145 g和9.44mm/2.222 g,而出发菌株JK-15仅为6.47mm/ 1.345 g。
2.3板对峙试验
通过观察各菌株在与灰霉病菌进行平板对峙试验时的表现差异,能够初步判断各菌株的生物防治性能的差异。30℃培养36 h时各突变株与出发菌株JK-15的平板对峙试验结果如图3所示。由图3可知,当平板对峙试验进行到36 h时,各突变菌株的菌落大小已显著大于出发菌株JK-15。同时,JK-15的菌落呈白色,表面几乎未有绿色的分生孢子出现,而各突变菌株的菌落表面均已布满大量绿色分生孢子,表明筛选所得各突变株的抑菌性能与出发菌株JK-15相当甚至更优,产孢子能力显著强于出发菌株JK-15。
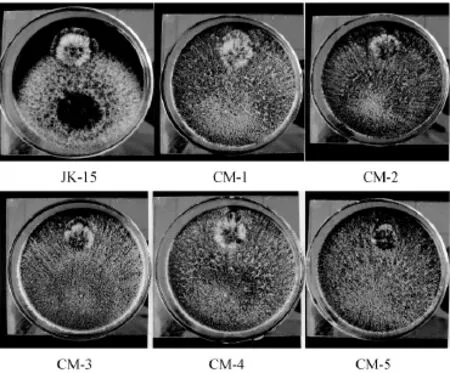
图3 出发菌株JK-15与突变株的平板对峙试验结果对比Fig.3 Result com parison of originalstrain JK-15 and mutant strains in tablet confrontation tests
平板对峙试验培养至48 h时,出发菌株JK-15与各突变株的菌落均侵染并完全覆盖灰霉病菌菌落,木霉菌落占领整个平板。各菌对灰霉菌的抑制率和抑菌级别见表1。
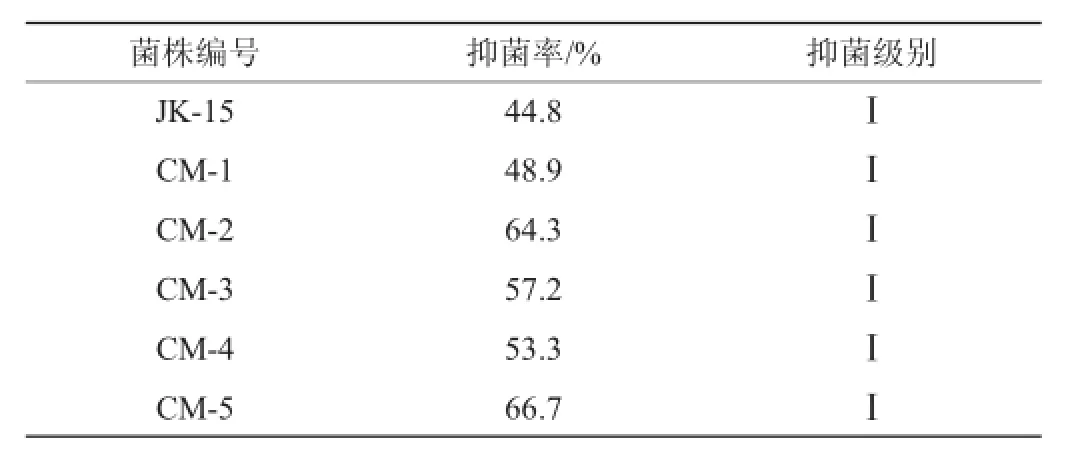
表1 出发菌株JK-15与突变株的平板对峙试验中对灰霉病菌的抑菌率Table 1 Bacte riostasis rate of original stra in JK-15 and m utant strains on B.cinerea in tablet confrontation tests
由表1可知,突变菌株CM-5的抑菌率最高,为66.7%。霉菌的抑菌级别达到Ⅰ级。
2.4变株遗传稳定性
对选定的优良突变株在斜面培养基上连续接种传代5次,通过测定各代的生长速率及平板对峙抑菌率,考察各突变株的遗传稳定性,试验结果如表2所示。
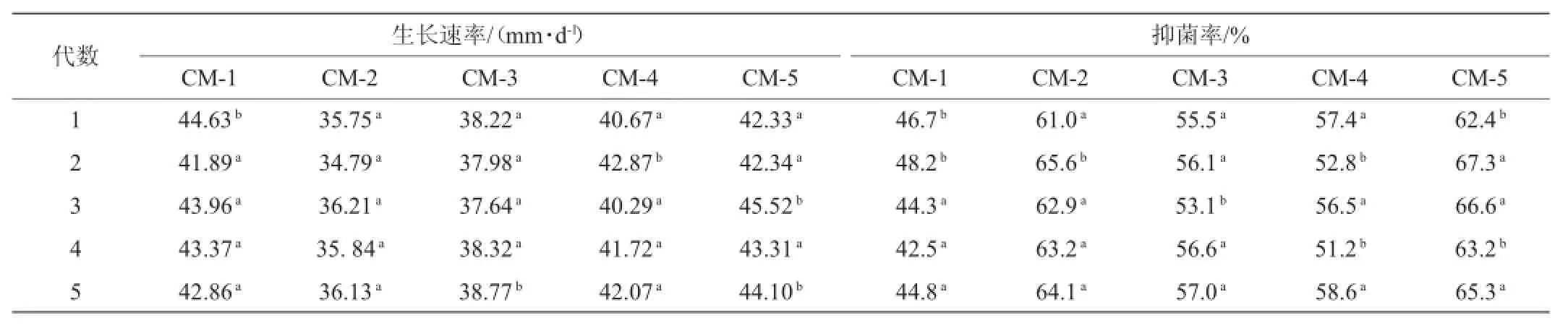
表2 突变菌株遗传稳定性试验结果Table 2 Tests resu lts of the genetic stability ofmutant strains
由表2可知,各突变株的生长速率及其抑菌率在传代过程中稳定在一个较小的波动区间内,未随传代过程出现持续性的下降。其中,CM-5的生长速率为42.33~45.52mm/d,抑菌率为62.4%~67.3%,均为各突变株中最高值,因此将其选定为遗传较稳定且性能最优的突变菌株。
3 结论
本研究采用60Co-γ射线辐射方法对长枝木霉JK-15进行诱变育种,以提高其利用单一的甘蔗糖蜜酒精废液大量生产木霉菌剂的能力。结果表明,突变菌株CM-5的综合表现最为优良,其在平板上生长速率达到42.33mm/d,50 m L液体培养体系中生物量(以细胞干质量计)达到2.222 g,平板对峙抑菌率达到66.7%,较出发菌株分别提高了45.9%、65.2%和48.9%。经过5次传代培养,其生长速率和抑菌率均未出现持续性衰退,表明其遗传性状较稳定。
[1]MATARESE F,SARROCCO S,GRUBERS,etal.Biocontrolof Fusarium head blight:interactions between Trichoderma and mycotoxigenic Fusarium[J].M icrobiol,2012,158(Pt1):98-106.
[2]YANG X M,CHEN L H,YONG X Y,etal.Formulations can affect rhizosphere colonization and biocontrol efficiency of Trichoderma harzianum SQR-T037 against Fusarium w iltof cucumbers[J].Biol Fer t Soils,2011,47(3):239-248.
[3]JOHNRP,TYAGIRD,PRÉVOSTD,etal.Mycoparasitic Trichoderma viride asabiocontrolagentagainst Fusarium oxysporum f.sp.adzuki and Pythium arrhenomanes and as a grow th promoter of soybean[J].Crop Prot,2010,29(12):1452-1459.
[4]尹婷,徐秉良,梁巧兰,等.耐药性木霉T2菌株的筛选、紫外诱变与药剂驯化[J].草业学报,2013,22(2):117-122.
[5]周文臣,詹晓北,朱莉,等.农药多抗性哈茨木霉的常压室温等离子体诱变[J].生物技术通报,2015,31(5):214-223.
[6]鲁海菊,刘云龙.哈茨木霉强根际定殖能力菌株的筛选[J].中国生物防治,2008,24(2):138-142.
[7]田连生,李贵香,高玉爽.紫外光诱导木霉产生对速克灵抗药性菌株的研究[J].中国植保导刊,2006,26(6):18-20,14.
[8]于春生,张雨竹,张凤娇,等.紫外-氯化锂复合诱变哈茨木霉产生多菌灵抗药性菌株的研究[J].植物保护,2015,41(5):79-84.
[9]王燕.热-紫外灭活双亲原生质体融合选育米曲霉新菌株的研究[J].中国酿造,2008,27(13):42-44.
[10]陈桂光,李玮,齐辉连,等.黑曲霉低聚异麦芽糖高产菌株的诱变选育[J].食品工业科技,2011,32(8):185-187.
[11]易菊阳,梁钰婷,陆兵,等.高产α-葡萄糖苷酶黑曲霉的微波选育及发酵条件优化[J].食品科学,2014,35(15):145-150.
[12]朱萍萍,凌健,席亚东,等.蔬菜土传病害生防木霉菌株资源的筛选及其防治效果评价[J].中国蔬菜,2015,35(8):28-33.
[13]李贵香,高海霞,田连生,等.拮抗木霉耐多菌灵菌株的筛选[J].生物技术,2006,16(6):29-32.
[14]潘丽霞,杨登峰,黄世勇,等.利用木糖产油酵母的微波诱变选育[J].中国酿造,2009,28(3):62-64.
[15]LIU Z Y,ZHANG D X,HUA Z Z,etal.Improvement of laccase production and its properties by low-energy ion implantation[J].Bioproc Biosyst Eng,2010,33(8):639-646.
[16]ZHANG X,ZHANG R,YANG T,et al.Mutation breeding of acetoin high producing Bacillus subtilis blocked in 2,3-butanediol dehydrogenase[J].W or ld JM icrobiol Biotechnol,2013,29(10):1783-1789.
Improvement of biomass production capacity of Trichoderma longibrachiatum using molasses alcohol wastewater by60Co-γ mutagenesis
LIWei1,CAOMuming1,CHENGuopin1,XIEShuyu1,LIXian2,BIFangfang2,WEIQiaona2,DING Su2*
(1.Viticulture and W ine Research Institute,GuangxiAcademy ofAgricultural Sciences,Nanning 530007,China;2.Xingjian CollegeofScience and Liberal Arts,GuangxiUniversity,Nanning 530004,China)
Biocontrolstrain Trichoderma longibrachiatum JK-15wasmutagenized by 60Co-γradiation to improve cellgrowth and spore production capacity of the strain using cane sugarmolasses alcoholwastewater.Seriesof excellentmutant strainswhich could use single sugar canemolassesalcoholwaste liquid to produce biomass was obtained by flat prelim inarily screening and shake flask secondary screening.The biocontrol effectof the mutantstrainson Botrytiscinerea wasverified by tablet confrontation tests.Finally theoptimalmutantstrain CM-5 wasobtained.The grow th velocity of the strain reached to 42.33mm/d on the flatmedium,and biomass(celldrymass)of the strain reached to 2.22 g in 50m l liquid culturesystem,thebacteriostasis rate reached to 66.7%,which improved significantly compared with original strain.The grow th rateand bacteriostatic rate of strain CM-5 still remained high and stableafter5 generation passage,which indicated that the strain CM-5 had stablegenetic traits.The study had important promoting effect forbiocontrolapplicationsof T.longibrachiatum in hotareas.
Trichoderma longibrachiatum;mutation;60Co-γradiation;biocontrol;m icrobialbreeding
Q939.96
0254-5071(2016)01-0082-04
10.11882/j.issn.0254-5071.2016.01.018
2015-11-13
广西自然科学基金(2013GXNSFBA019074);广西大学行建文理学院科研基金(2013ZKLX03)
李玮(1984-),男,副研究员,博士,研究方向为微生物工程。
丁苏(1985-),女,讲师,硕士,研究方向为微生物工程。

