野黄芩素对内毒素血症大鼠急性肺损伤的保护作用
王彪,袁海军,袁娜,张文超,刘珺(.南华大学附属第二医院 急诊科,湖南 衡阳 400;.南华大学附属第一医院耳鼻喉科,湖南 衡阳 400)
论著
野黄芩素对内毒素血症大鼠急性肺损伤的保护作用
王彪1,袁海军1,袁娜1,张文超1,刘珺2
(1.南华大学附属第二医院 急诊科,湖南 衡阳 421001;2.南华大学附属第一医院耳鼻喉科,湖南 衡阳 421001)
目的观察野黄芩素对脂多糖诱导的急性肺损伤的保护作用。方法将大鼠静脉内注射脂多糖(30mg/kg)以诱导急性肺损伤。1 h后分别静脉注射不同浓度的黄芩素(0.1、0.5和1.0mmol/kg),酶联免疫吸附试验法检测血浆中肿瘤坏死因子α,白细胞介素6和白细胞介素10的浓度;还原法检测肺组织中亚硝酸盐/硝酸盐的含量;实时定量聚合酶链式反应和蛋白免疫印迹法(W estern blot)分别检测一氧化氮合成酶和血红素氧合酶-1 mRNA及蛋白的表达;HE染色观察病理学改变情况。结果0.5和1.0mmol/kg的黄芩素能减少大鼠血浆中肿瘤坏死因子α和白细胞介素6含量,并能进一步增加白细胞介素10水平。脂多糖注射后肺组织中一氧化氮合成酶蛋白表达和血浆中一氧化氮含量显著增加,而黄芩素处理后一氧化氮合成酶和一氧化氮水平明显减少。脂多糖能诱导血红素氧合酶-1表达,但黄芩素处理后能进一步上调血红素氧合酶-1表达水平。血红素氧合酶-1抑制剂锡原卟啉处理后可消除黄芩素对细胞因子及一氧化氮合成酶表达的影响。此外,黄芩素还能减少肺组织水肿及中性粒细胞渗出。结论黄芩素可能通过诱导血红素氧合酶-1表达来减轻脂多糖诱导的急性肺损伤。
野黄芩素;急性肺损伤;血红素氧合酶1
急性肺损伤(acute lung injury,ALI)是一种以巨噬细胞、中性粒细胞过度活化为特征的临床综合征,病理学上表现为炎症相关蛋白酶和活性氧类过度释放以及肺内出血而引起微血管和组织损伤、水肿和纤维蛋白沉积[1]。与急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)一样,多种细胞因子与炎症相关介质参与本病的发生与发展过程,如肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)和白细胞介素6(IL-6),高迁移率族蛋白B1(high mobility groupbox 1 protein,HMGB1)、一氧化氮合成酶(nitric oxide synthase,iNOS)和一氧化氮(nitric oxide,NO)等[2]。血红素氧合酶-1(heme oxygenase-1,HO-1)是催化血红素分解为Fe2+,胆绿素和一氧化碳CO的限速酶。研究表明,HO-1及其代谢产物对中性粒细胞、巨噬细胞和淋巴细胞介导的炎症反应具有一定的抑制作用[3]。促炎细胞因子、HMGB1以及氧化应激均可上调HO-1表达。HO-1缺陷型小鼠中,往往伴随有更高的氧化应激水平与高死亡率。而给予低剂量CO诱导HO-1表达后,可显著降低大鼠脂多糖(lipopolysachrides,LPS)诱导的肺损伤和致死性内毒素休克。这表明HO-1对ALI的炎症反应与氧化应激具有一定的负向调控作用[4]。野黄芩素(Scutellarein,SCT)是从黄芩中分离出的一种黄酮类化合物单体。体外研究表明,SCT具有一定的抗炎与抗氧化活性,并能抑制核转录因子κB(nuclear factorκB,NF-κB)的激活[5-6]。但SCT对ALI是否也具有保护作用目前仍不明确。本研究旨在探究LPS诱导的ALI动物模型中,SCT能否调控炎症因子与介质的分泌,并观察其是否与HO-1的诱导表达有关。
1 材料与方法
1.1材料与试剂
SCT纯度98%,锡原卟啉(Sn-protopor phyrin,SnPP)购自美国Sigma-Aldrich公司,抗HO-1多克隆抗体,抗鼠β-actin购自美国Santa Cruz公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记免疫球蛋白G(immunoglobulin G,IgG)抗体购自英国Abcam公司,Bradford蛋白浓度测定试剂盒购自美国Bio-Rad公司,肿瘤坏死因子α(tumor necrosis factor Alpha,TNF-α),白细胞介素 1β(interleukin-1β,IL-1β) 和白细胞介素 10(interleukin-10,IL-10)酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)检测试剂盒购自深圳新博盛生物科技有限公司,蛋白酶抑制剂购自瑞士Roche公司,cDNA逆转录试剂盒购自美国Applied Biosystems公司,RNA提取试剂盒购自美国GIBCO BRL公司。雄性8~10周龄SPF级Wistar大鼠[动物许可证号:SCXK(湘)2015-0001,体重260~290 g]购自南华大学实验动物中心。
1.2仪器与设备
Imark酶标仪购自美国Bio-Rad公司,LightCycle480实时定量聚合酶链式反应(polymerase chain reaction,PCR)仪购自瑞士Roche公司,Mini-PROTEAN电泳仪购自美国 Bio-Rad公司,Bio-Rad Trans-Blot半干转印仪购自美国Bio-Rad公司,Fuji DRI-CHEM FDC 3000全自动干式生化分析仪购自日本Fuji Photo Film公司。
1.3试验方法
1.3.1ALI模型的建立与实验分组Wistar大鼠于(23±1)℃、(55±5)℃环境下给予正常饲料喂养。本研究符合该校实验动物伦理委员会批准。大鼠采用1.5 g/kg的乌拉坦腹腔内注射麻醉后,参照参考文献提供的方法建立体外ALI模型,并根据不同的实验目的分为6组,每组10只大鼠。①对照组:大鼠于4h内持续颈静脉滴注9ml生理盐水,在滴注生理盐水1 h后经股静脉注入2m l林格氏液。②LPS组:将LPS(30 mg/kg)溶解于9m l生理盐水中,4 h内通过颈静脉滴入。滴注1 h后,大鼠同时给予2ml林格氏液;③SCT干预组:LPS滴入1 h后,同时滴入不同浓度SCT(0.1、0.5和1.0 mmol/kg,用林格氏液溶解);④SnPP干预组:在LPS滴入前6 h腹腔注射30mg/kg SnPP,其他同SCT干预组。
1.3.2细胞因子测定大鼠处理结束后获取其血清,采用ELISA测定TNF-α,IL-6和IL-10浓度。根据试剂盒提供的操作步骤,在包被有相应细胞因子抗体的微孔板中加入100μl待血清,37℃孵育2 h。经洗涤后,按照试剂盒的步骤分别加入一抗、二抗孵育。显色后,测定450nm处的吸光度值,并根据标准曲线计算TNF-α,IL-6和IL-10的浓度。
1.3.3亚硝酸盐/硝酸盐的测定获取处理后的大鼠血浆30μl,加入60μl 95%乙醇4℃孵育30min以去沉淀血浆蛋白。14 000 r/min离心5min随后加入1mol/L氯化氢HCl(含0.8%氯化钒VCl3),使其将样本中的亚硝酸盐/硝酸盐还原为一氧化氮NO,并用Sievers一氧化氮分析仪测量其浓度,通过与标准的硝酸钠溶液进行比较,从而间接反应亚硝酸盐/硝酸盐的含量。
1.3.4实时定量PCR检测iNOS和HO-1mRNA表达用Trizol试剂提取大鼠肺组织总RNA并测量其浓度。取2μg RNA将其逆转录为cDNA。设计并合成HO-1,iNOS与β-actin引物,其中HO-1引物序列分别为:5'-CGTGCAGAGAATTCTGAGTTC-3'(正向引物)和5’-AGACGCTTTACGTAGTGCTG-3'(反向引物);iNOS:5'-GCAGGTTGAGGATTACTTCTT CCA-3'(正向引物)和5'-GCCCTTTTTTGCTCCATAG GAAA-3'(反向引物);β-actin:5'-CCTGTATGCCTC TGGTCGTA-3'(正向引物)和5'-CCATCTCTTGCTCG AAGTCT-3'(反向引物)。将上述cDNA产物置于Miniopticon实时定量PCR仪器上,设置反应条件:95℃预变性10min,95℃变性10 s、61℃退火20 s、72℃延伸10 s,共35个循环。通过比较iNOS和HO-1和β-actin的Ct值,计算其相对倍数表示(2-ΔΔCt)。
1.3.5蛋白免疫印迹法(W estern blot)检测蛋白表达将肺组织中加入含蛋白酶抑制剂的Cocktails并制成匀浆。采用Pierce公司提供的RAPI蛋白提取试剂盒提取总蛋白,并用Bradford法测定蛋白浓度。并获取20μl蛋白用于SDS-聚丙烯酰胺凝胶电泳,随后采用半干转印方法将其转印至硝酸纤维素膜上。纤维素膜用5%牛血清白蛋白室温封闭2 h,随后分别用相应的一抗和二抗孵育,增强化学发光法显影、拍照。
1.3.6病理组织学分析肺组织用10%福尔马林固定,用石蜡包埋后制备成厚度为4μm的切片后用苏木精和曙红染色,并基于组织水肿和中性粒细胞渗出对肺组织的病理损伤进行评分(损伤程度分为0~3级)[7],最终分数为水肿和渗出评分之和。
1.3.7乳酸脱氢酶检测LPS处理6 h后,获取大鼠血浆,全自动生化仪上测定其乳酸脱氢酶(lactate dehydrogenase,LDH)含量。
1.4统计学方法
采用SPSS 17.0统计软件进行数据分析,计量数据用均数±标准差()表示,多组间比较用方差分析,组间比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1SCT对血浆TNF-α,IL-6和IL-10水平的影响
对照组大鼠血浆中TNF-α,IL-6和IL-10浓度较低。给予LPS注射后,其含量显著增高。同时给予不同浓度的SCT处理后,TNF-α和IL-6有所降低,而IL-10明显增高,各组经单因素方差分析,差异有统计学意义(P=0.000)。其中,0.1mmol/kg SCT组中TNF-α与IL-6的水平,与LPS组比较,差异无统计学意义(t=0.186和0.261,P=0.726和0.624);而IL-10水平与LPS组比较,差异有统计学意义(t=4.954,P=0.000)。若给予SnPP处理后,可显著消除SCT对TNF-α,IL-6和IL-10的影响(与1.0 mmol/kg SCT组比较,t值分别为3.268、3.917和4.415,P=0.002,0.000和0.000)。见附表。
2.2SCT对血浆硝酸盐/亚硝酸盐含量及肺iNOS蛋白表达的影响
LPS注射后6 h,血浆硝酸盐/亚硝酸盐含量明显增高。与LPS组比较,不同浓度SCT(0.1、0.5和1.0 mmol/kg)处理后可明显抑制该效应。Western blot结果显示,对照组大鼠肺组织匀浆中iNOS蛋白表达较低,而LPS可显著诱导iNOS蛋白表达。虽然SCT 0.1mmol/kg和SCT 0.5mmol/kg并不能明显影响iNOS的表达,但1.0mmol/kg SCT处理后,iNOS表达水平显著减少。而同时给予SnPP处理后,可消除SCT对iNOS的抑制效应。见图1。
附表 不同浓度SCT对ALI大鼠血浆细胞因子水平的影响 ()

附表 不同浓度SCT对ALI大鼠血浆细胞因子水平的影响 ()
IL-10/(pg/m l)对照组 31.5±11.7 15.5±8.1 22.3±5.2 LPS组 858.4±51.3 106.6±12.8 486.8±26.4 SCT组(0.1mmol/kg) 858.4±51.3 96.5±9.7 902.4±44.2 SCT组(0.5mmol/kg) 476.2±18.2 62.5±10.7 752.6±36.2 SCT组(1.0mmol/kg) 465.6±29.4 45.3±8.2 978.5±25.6 SnPP+SCT组(1.0mmol/kg) 85.4±33.6 78.1±6.5 589.1±37.5 F值 17.832 13.052 25.564 P值 0.000 0.000 0.000组别TNF-α/(ng/m l)IL-6/(ng/ml)
2.3SCT对肺HO-1mRNA和HO-1蛋白表达的影响
与对照组比较,大鼠注射LPS后肺HO-1mRNA表达增高。不同浓度SCT处理后HO-1mRNA水平进一步(P<0.05),HO-1蛋白表达与qPCR结果类似。见图2。
2.4SCT对肺组织病理变化的影响
LPS所致的ALI以水肿和炎症细胞浸润为主要特征。光学显微镜结果表明,肺脏正常组织学评分为1。注射LPS后不仅引起肺泡间质弥漫性水肿,同时引起肺泡含气空间明显减少,其组织学评分为5。1.0mmol/kg SCT处理LPS大鼠后,肺组织学评分降低至3分。见图3。
2.5SCT对LPS诱导所致细胞损伤的影响
LPS处理6h后,血浆中LDH的水平显著高于对照组(P<0.05)。而0.1、0.5和1.0mg/kg剂量SCT处理后,可显著降低血浆LDH的水平增加(P<0.05),但不同剂量SCT对LDH的影响差异无统计学意义。而SnPP预处理后可逆转SCT对LDH的抑制效应(P<0.05)。见图4。
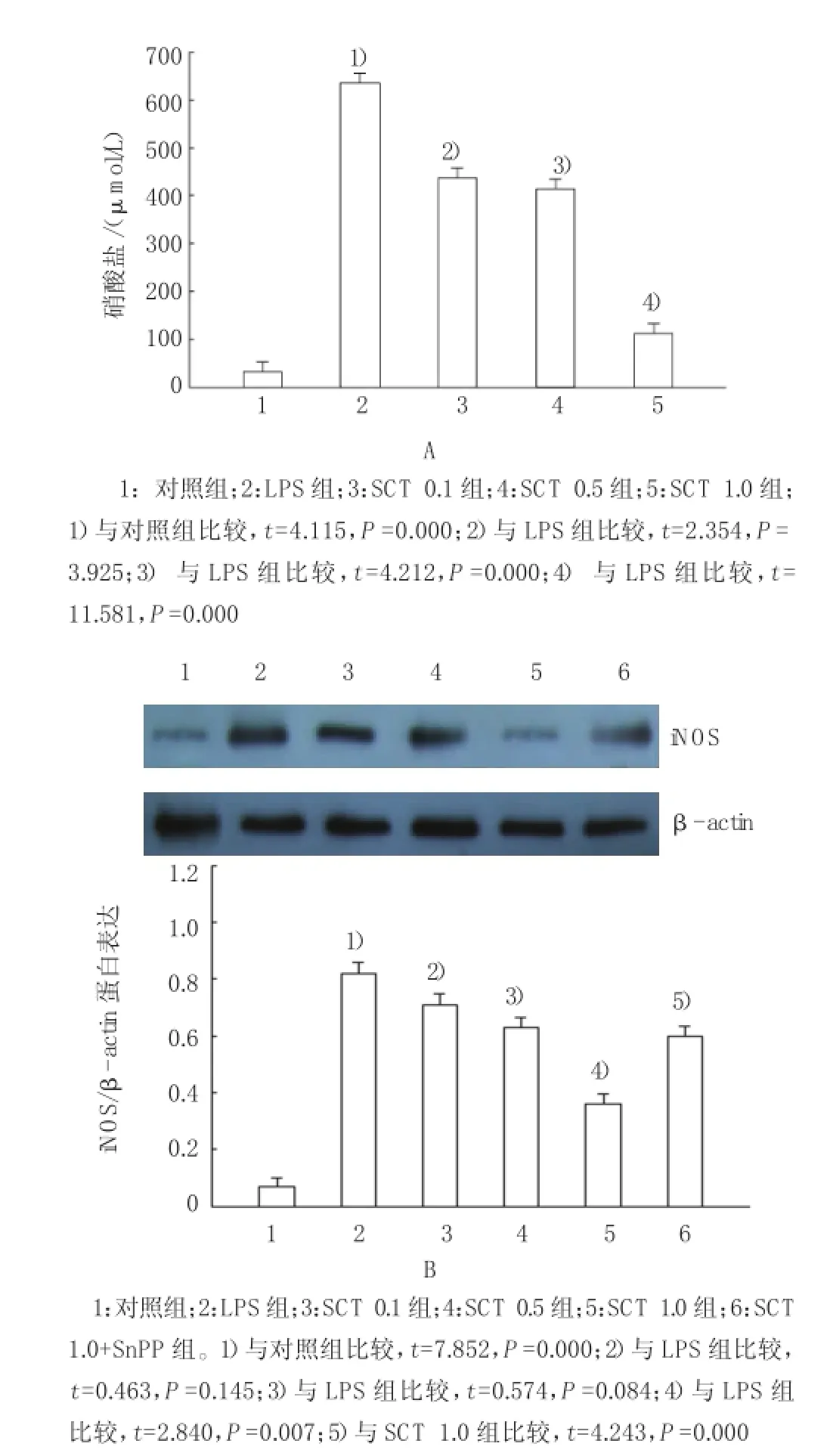
图1 SCT对血浆硝酸盐/亚硝酸盐含量及肺iNOS蛋白表达的影响
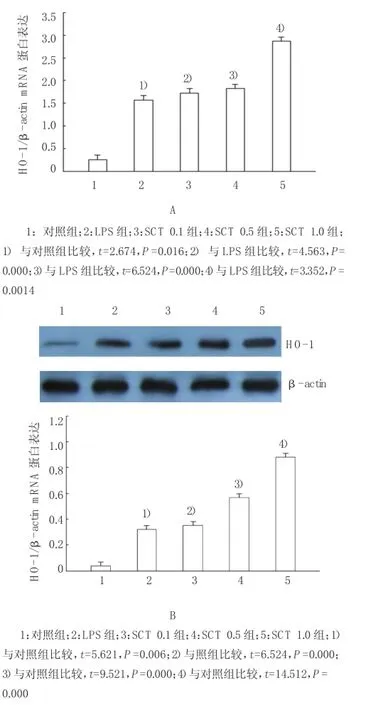
图2 SCT对肺HO-1 m RNA和HO-1蛋白表达的影响
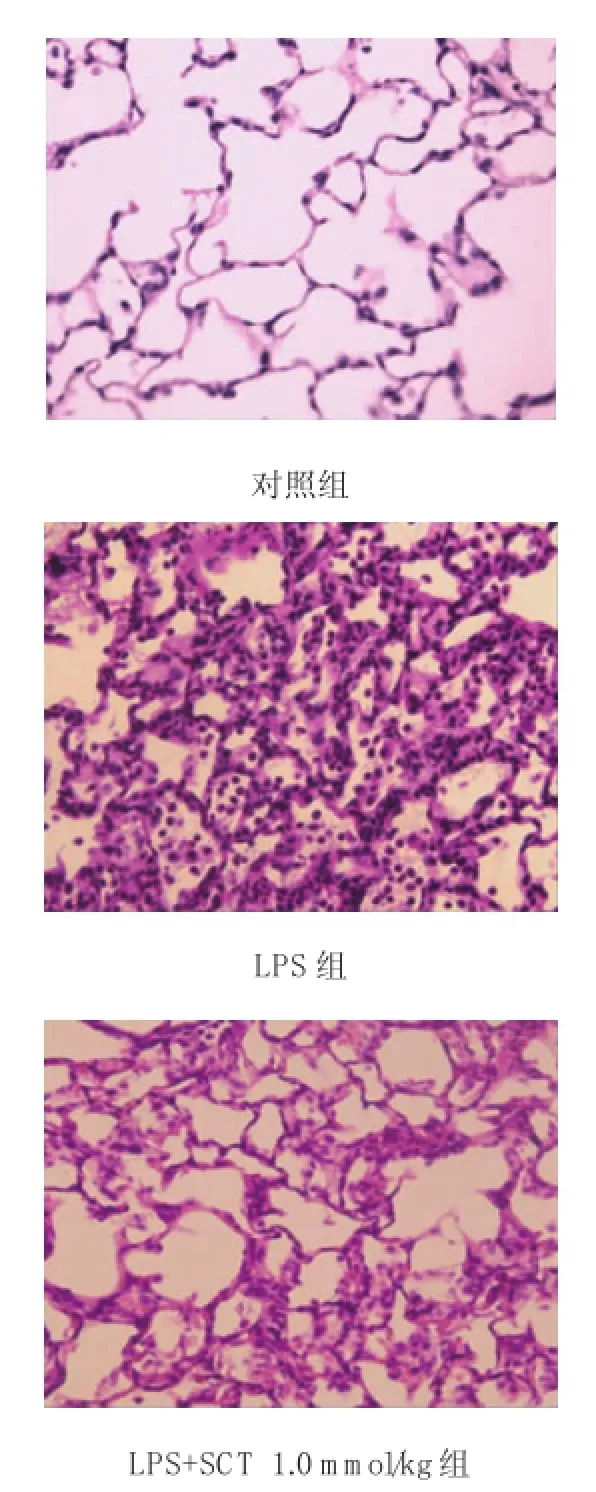
图3 SCT对肺组织病理变化的影响 (×200)
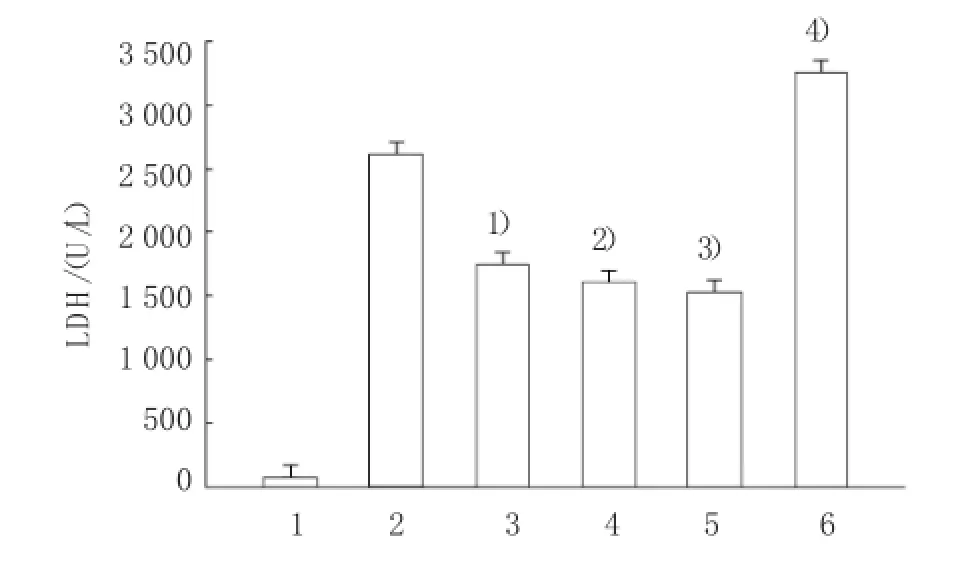
图4 SCT对LPS诱导所致细胞损伤的影响
3 讨论
ALI和ARDS一样,其病理生理学改变是广泛性肺泡毛细血管损伤,导致其透性增加而引起肺水肿和中性粒细胞渗出,从而导致呼吸功能受损和低氧血症发生。因此,抑制肺部炎症反应强度是治疗ALI的重要途径。有研究表明,SCT具有多种药理学活性,包括抗炎、抗氧化应激损伤等效应[5]。本研究采用不同浓度SCT处理ALI大鼠后,发现它能降低ALI大鼠血浆中IL-6的浓度,同时也能增加IL-10的水平。IL-6是一种促炎细胞因子,它在启动炎症反应和休克早期高凝状态发挥至关重要作用。而IL-10对炎症具有抑制作用,它能负向调控微生物所致的感染性休克[8-9]。本研究结果也显示,SCT能下调巨噬细胞中iNOS的表达与TNF-α的分泌。iNOS是催化L-精氨酸为NO的限速酶,是一种诱导型酶类。生理条件下细胞内iNOS活性很低。LPS、细胞因子等因素可显著上调其表达水平,并产生高浓度的NO。NO可诱导细胞内产生大量cGMP,后者对血管平滑肌细胞具有舒张作用,同时NO也能影响血管对其他活性分子的敏感性,从而进一步降低血压、加重休克的发生[10]。此外,NO可产生过氧亚硝酸盐,它具有细胞毒性[11]。本研究也发现,SCT处理后,细胞内亚硝酸盐含量也明显减少,这表明SCT能明显抑制由LPS诱导的亚硝酸盐/硝酸盐形成,最终抑制NO的产生。
IL-10的另一个重要生物学作用是能上调HO-1的表达。HO-1是催化血红素降解为一氧化碳CO、铁离子Fe2+和胆绿素的限速酶,它在机体的炎症反应与氧化应激中发挥细胞保护作用[12]。HO-1主要是通过其代谢产物来发挥作用。CO和胆绿素不仅可抑制巨噬细胞中iNOS的转录表达和TNF-α生成,同时也能增加抗炎症细胞因子IL-10的表达,形成正反馈而调控炎症反应。如有研究显示给予HO-1诱导剂CoPP能明显抑制TNF-α和HMGB11的表达,从而缓解LPS所致ALI的病情[13]。此外,HO-1缺陷型小鼠IL-10水平降低,但IL-6产生增加,并且对内毒素的敏感性大大增强[14]。这些结果证明HO-1能负向调节IL-6、正向调节IL-10的分泌,从而减少内毒素所致器官损伤。本研究也证实,SCT处理后,大鼠肺组织中HO-1的表达水平明显增高,而采用其抑制剂SnPP处理后,可明显消除SCT对细胞因子分泌以及iNOS和LDH的抑制作用,这表明SCT最终可能通过上调HO-1的表达而参与其对ALI的保护作用。
HO-1的调控机制非常复杂,丝裂原活化蛋白激酶、核转录因子Nrf2以及活性氧类均是诱导其表达的重要因素[12,15]。有研究显示,SCT可以影响丝裂原活化蛋白激酶的活性[16],因此它可能参与HO-1表达的调控,但这仍有待进一步研究。此外,在本研究当中笔者使用的SCT剂量范围相对较窄。大剂量SCT或整个实验过程中持续输注SCT可能更为有效。总之,本研究证实SCT能有效改善LPS所致的ALI,其细胞保护作用可能归因于其抑制TNF-α、IL-6的分泌以及iNOS的表达,以及促进IL-10和HO-1表达有关。
[1]BOSMANN M,WARD P A.Protein-based therapies for acute lung injury:targeting neutrophil extracellular traps[J].Expert Opin Ther Targets,2014,18(6):703-714.
[2]ASCHNER Y,ZEMANS R L,YAMASHITA C M,et al.Matrix metalloproteinases and protein tyrosine kinases:potential novel targets in acute lung injury and ARDS[J].Chest,2014,146(4): 1081-1091.
[3]GULLA A,EVANS B J,NAVENOT JM,et al.Heme oxygenase-1 gene promoter polymorphism is associated with the development of necrotizing acute pancreatitis[J].Pancreas,2014,43(8): 1271-1276.
[4]CAO TH,JIN SG,FEI D S,et al.Artesunate protects against sepsis-induced lung injury via heme oxygenase-1 modulation[J]. Inflammation,2016:39(2):651-652.
[5]SUNG N Y,KIM M Y,CHO JY.Scutellarein reduces inflammatory responses by inhibiting src kinase activity[J].Korean J Physiol Pharmacol,2015,19(5):441-449.
[6]SANG Z,LI Y,QIANG X,et al.Multifunctional scutellarin-rivastigmine hybrids with cholinergic,antioxidant,biometal chelating and neuroprotective properties for the treatment of Alzheimer's disease[J].Bioorg Med Chem,2015,23(4):668-680.
[7]SU C F,YANG F L,CHEN H I.Inhibition of inducible nitric oxide synthase attenuates acute endotoxin-induced lung injury in rats[J].Clin Exp Pharmacol Physiol,2007,34(4):339-346.
[8]BELPERIO JA,KEANE M P,LYNCH JP,et al.The role of cytokines during the pathogenesis of ventilator-associated and ventilator-induced lung injury[J].Semin Respir Crit Care Med,2006,27(4):350-364.
[9]STRIETER R M,KUNKEL S L.Acute lung injury:the role of cytokines in the elicitation of neutrophils[J].J Investig Med,1994,42(4):640-651.
[10]ARORA K,SINHA C,ZHANG W,et al.Altered cGMP dynamics at the plasma membrane contribute to diarrhea in ulcerative colitis[J].Am J Pathol,2015,185(10):2790-2804.
[11]WANG L,TANEJA R,RAZAVI H M,et al.Specific role of neutrophil inducible nitric oxide synthase in murine sepsis-induced lung injury in vivo[J].Shock,2012,37(5):539-547.
[12]LV H,YU Z,ZHENG Y,et al.Isovitexin exerts anti-inflammatory and anti-oxidant activities on lipopolysaccharide-induced acute lung injury by inhibiting MAPK and NF-κB and activating HO-1/Nrf2 pathways[J].Int J Biol Sci,2016,12(1):72-86.
[13]GONG Q,YIN H,FANG M,et al.Heme oxygenase-1 upregulation significantly inhibits TNF-alpha and HMGB11 releasing and attenuates lipopolysaccharide-induced acute lung injury in mice[J].Int Immunopharmacol,2008,8(6):792-798.
[14]KAPTURCZAK M H,WASSERFALL C,BRUSKO T,et al. Heme oxygenase-1 modulates early inflammatory responses:evidence from the heme oxygenase-1-deficient mouse[J].Am J Pathol,2004,165(3):1045-1053.
[15]YEH C H,YANG J J,YANG M L,et al.Rutin decreases lipopolysaccharide-induced acute lung injury via inhibition of oxidative stress and the MAPK-NF-κB pathway[J].Free Radic Biol Med,2014,69:249-257.
[16]PAN Z,ZHAO W,ZHANG X,et al.Scutellarin alleviates interstitial fibrosis and cardiac dysfunction of infarct rats by inhibiting TGF-β1expression and activation of p38-MAPK and ERK1/2[J].Br J Pharmacol,2011,162(3):688-700.
(张蕾编辑)
Protective effect of scutellarein on acute lung injury in endotoxem ic rats
BiaoWang1,Hai-jun Yuan1,Na Yuan1,Wen-chao Zhang1,Jun Liu2
(1.Department of Emergency,the Second Affiliated Hospital of Nanhua University,Hengyang,Hunan 421001,China;2.Departmentof Otorhinolaryngology,the First Affiliated Hospital of Nanhua University,Hengyang,Hunan 421001,China)
Objective To observe the protective effect of scutellarein on acute lung injury(ALI)in endotoxem ic rats.M ethods Rats were administered LPS(30 mg/kg)by intravenous infusion to induce ALI.Scutellarein(0.1,0.5 and 1.0 mmol/kg)was given 1 h after LPS initiation.Levels of TNF-α,IL-6 and IL-10 in serum and levels of nitrite/nitrate production weremeasured by ELISA and reduction method respectively.Expression of the mRNA and protein of iNOSand HO-1 were detected by qPCR and Western blot,respectively.The tissue injury was analyzed by histopathology.Results Scutellarein(0.5 and 1.0mmol/kg)attenuated plasma levels of TNF-αand IL-6 caused by LPS,and increased IL-10 levels compared with the LPS group.At 6 h after LPS initiation,the expression of iNOS protein in lung and the lever of NO in plasma weremarkedly increased,which were reduced by scutellarein(1.0 mmol/kg).LPS caused a significant HO-1 induction,whereas administration of scutellarein(1.0 mmol/kg)significantly induced higher HO-1 expression compared with the LPSgroup.The beneficial effects of scutellarein on cytokines and iNOS expression were reversed with HO-1 inhibitor SnPP.The edema and infiltration of neutrophils into lungs was reduced by scutellarein.Conclusions Scutellarein may induce the expression of HO-1 to alleviate LPS-induced ALI.
scutellarein;acute lung injury;hemeoxygenase-1
R 453.9;R-332
A
10.3969/j.issn.1005-8982.2016.12.004
1005-8982(2016)12-0015-06
2016-03-28
刘珺,E-mail:liujunusc@sina.com;Tel:13786431102

