促红细胞生成素后处理对大鼠肾脏缺血再灌注损伤的保护作用
孙倩倩,程远,孟晓华,史国辉
(华北理工大学附属医院,1.肾内科,2.心胸外科,河北 唐山 063000)
论著
促红细胞生成素后处理对大鼠肾脏缺血再灌注损伤的保护作用
孙倩倩1,程远2,孟晓华1,史国辉1
(华北理工大学附属医院,1.肾内科,2.心胸外科,河北 唐山 063000)
目的探讨促红细胞生成素(EPO)后处理对大鼠肾脏缺血再灌注损伤(IRI)的保护作用。方法将18只健康雄性SD大鼠随机分为假手术组(Sham组)、缺血再灌注损伤组(IR I组)及EPO后处理组(EPO组)。采用全自动生化分析仪检测血清尿素氮(BUN)及肌酐(Cr)含量;用HE染色观察病理组织学变化;用免疫组织化学法检测肾组织中HSP70的表达。结果IR I组血清BUN及C r含量较Sham组明显升高,EPO后处理组血清BUN及Cr含量介于Sham组和IRI组之间;HE染色检测发现IRI组肾小管上皮细胞坏死明显;肾小管管腔扩张,EPO后处理组较IR I组肾小管上皮坏死明显减轻;免疫组织化学检测发现HSP70在EPO后处理组表达最强,Sham组表达明显降低,IRI组表达则介于前两者之间。结论EPO后处理能增强缺血再灌注损伤过程中HSP-70的表达量,因而有助于减轻肾脏的缺血再灌注损伤。
肾脏;后处理;缺血再灌注损伤;热休克蛋白70;大鼠
急性肾损伤(acute kidney injury,AKI)是临床上常见的急危重症,具有较高的发病率和死亡率[1],而肾脏缺血再灌注损伤(ischemia reperfusion injury,IRI)是AKI的常见病因。临床上肾脏缺血再灌注损伤发生隐匿且病程发展迅速,往往很难做到及时预防。短时间内快速完成血流重建是挽救器官缺血损伤最好的方法,但往往在恢复血流时易导致再灌注损伤。因此,研究提高机体内在的保护机制从而减轻肾脏缺血再灌注损伤的方法具有重要的临床意义。近年来,对肾脏缺血再灌注损伤保护作用的研究多集中在缺血预处理(ischemic preconditioning,IP),缺血预处理已经被证实能够减轻肾缺血后再灌注损伤[2]。目前最新研究表明,再灌注最初的几分钟是决定肾缺血最终结局的关键时间段[3],所以,与缺血预处理相比,对再灌注前进行干预的缺血后处理(ischemic postconditioning,IPO),可能具有更强的可操作性和更好的应用前景。
激活的白细胞及活性氧进入缺血组织,出现显著的呼吸爆发,产生大量自由基为引起组织器官缺血再灌注损伤的原因之一。文献[4]报道通过诱导热休克蛋白在血管壁的表达,抑制了白细胞的浸润及血管内皮细胞的损伤。
促红细胞生成素(erythropoietin,EPO)临床主要用于治疗肾性贫血以及肿瘤等各种慢性疾病所伴发的贫血,近年来研究发现,EPO有抗氧化、抑制炎症反应和抗凋亡等功能[5],对多种组织脏器(如脑、心、肾等)的IRI均有保护作用。目前,相关研究表明EPO预处理对肾脏IRI具有保护作用[6],但EPO后处理是否可以通过抗氧化机制保护肾脏尚不清楚。本实验通过建立大鼠IRI模型,探讨EPO后处理对大鼠肾脏IRI的保护机制,现报道如下。
1 材料与方法
1.1一般资料
8周龄健康雄性SD(Sprasue-Dawley)大鼠18只(华北理工大学动物中心提供),体重在240~280 g之间,清洁级;饲料为华北理工大学动物中心提供的钴60灭菌饲料。
1.2仪器与试剂
注射用重组人促红细胞生成素(rhEPO)3 000 IU/支(沈阳三生制药厂,批号:201502028S);Benckman全自动生化仪;Olympus显微镜;HSP70免疫组织化学SABC试剂盒购自武汉博士德生物工程有限公司。
1.3方法
健康雄性SD大鼠18只按随机数字表法分成3组,每组6只:假手术组(Sham组)、缺血再灌注损伤组(IRI组)和EPO后处理组。Sham组仅开腹,切除右肾,游离左侧肾脏,分离肾蒂但不夹闭,45 min后关腹。IRI组手术操作与Sham组相同,仅在切除右肾和游离左肾之后,将左肾动脉夹闭45min再开放血管。EPO后处理组缺血45min,于再灌注前5min rhEPO(3 000 IU/kg)腹腔注射。以上3组持续再灌注24 h后留取血清及肾组织标本。
采用Benckman全自动生化仪测定各组大鼠肾功能指标尿素氮(BUN)、肌酐(Cr);肾组织石蜡包埋后切片,行HE染色,Olympus显微镜下观察肾组织病理学改变;采用免疫组织化学法对HSP70在大鼠肾组织内的表达进行分析。
1.4统计学方法
应用SPSS 17.0统计软件进行数据分析,结果以均数±标准差()表示,组间比较采用单因素方差分析,在方差分析有意义的基础上,再采用LSD-t检验法进行两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1肾功能检测结果
IRI组大鼠BUN、Cr水平显著高于Sham组(P<0.05),EPO后处理组BUN、Cr水平显著低于IRI组(P<0.05),见表1。
2.2HE染色显微镜观察结果
HE染色显示,Sham组大鼠肾组织结构未见明显异常;各组肾小球光镜下未见明显病理改变,IRI组肾小管结构异常,肾间质水肿,大量炎症细胞浸润,肾小管上皮细胞坏死,扩张管型形成;EPO后处理组肾小管上皮轻度水肿,炎症细胞少见,管型罕见,病理损伤程度显著轻于IRI组,见图1。
表1 EPO后处理对肾脏缺血再灌注大鼠血浆BUN和Cr含量的影响 (n=6,)

表1 EPO后处理对肾脏缺血再灌注大鼠血浆BUN和Cr含量的影响 (n=6,)
注:1)与Sham组比较,P<0.05;2)与IRI组比较,P<0.05
组别 尿素氮(mmol/L)Sham组 6.91±0.24 IRI组 13.73±0.761)肌酐(μmol/L)52.19±3.39 121.47±9.821)EPO后处理组F值P值73.08±4.261)2)180.318 0.000 9.01±0.501)2)248.082 0.000
2.3免疫组织化学法观察结果
采用DAB染色,并行核复染,阳性结果为棕黄色颗粒。结果发现HSP70阳性表达主要在细胞质,肾小球为阴性。Sham组中均无或少见HSP70表达,EPO后处理组HSP70表达最强,IRI组HSP70表达稍强于Sham组,但明显弱于EPO后处理组,见图2。

图1 各组大鼠肾脏病理HE染色比较 (×400)
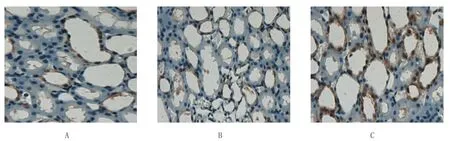
图2 各组大鼠肾脏免疫组织化学比较 (×400)
3 讨论
肾脏缺血再灌注损伤是指肾重新获得血流后,通过各种途径最终导致细胞膜损伤,线粒体丧失功能,最后细胞死亡,肾脏功能受损[7]。近年来研究表明,造成肾缺血再灌注损伤的主要机制有:氧自由基增多、炎症反应、免疫反应、细胞内钙超载、能量代谢障碍及某些激素代谢失调等[8-10]。其中,氧化是肾脏IR最重要的病理机制之一。
EPO是由CHO细胞发酵表达的有生物活性的蛋白,其最主要的功能就是促进红系细胞的生长和分化,增加红细胞的数量,纠正贫血,除此之外,EPO还可以发挥调节因子的作用使机体对缺氧产生适应。最近几年研究发现,EPO可与机体其他各处的EPO受体结合,发挥直接的组织保护作用,其通过抗氧化凋亡、促进新生血管形成、抑制过度炎症反应等对心、脑、肾脏缺血再灌注损伤产生保护作用[11-14]。但目前尚未有研究表明EPO后处理对肾脏IRI的影响。
热休克蛋白(heat shock proteins,HSPs)是细胞在受到外来刺激后诱导合成的一组细胞内蛋白质,具有维持细胞蛋白自稳,提高细胞对应激原的耐受性,保持细胞内环境的稳定性,起到保护细胞的作用[15]。HSP70是分子量约为70 kD的蛋白,在热刺激、炎症、缺血和缺氧等情况下都可以诱导产生,对缺血和缺氧较敏感,它对细胞有明确的内源性保护作用而成为HSPs中最受关注、研究最深入的一种[16-17]。国内外多项研究表明热休克蛋白70在缺血、缺氧及缺血再灌注中能通过抑制氧化应激、抵抗炎性因子对器官产生保护作用。其中,KIM等[18]证明,药物诱导HSP70生成增加可以明显减轻肾损伤。
本研究中与Sham组比较,IRI组大鼠光镜下观察肾组织损伤严重,肌酐和尿素氮水平明显升高,符合AKI病理表现,说明成功制备肾IRI动物模型。EPO后处理组与IRI组比较,大鼠肾小管上皮细胞坏死,炎症细胞浸润及管型明显减少,肌酐和尿素氮水平显著下降。除上述病理学及血清学表现外,免疫组织化学结果显示:Sham组可见无或少见HSP70表达,IRI组HSP70表达稍强,与Sham组比较,差异显著,但明显弱于EPO后处理组,差异有统计学意义。根据EPO后处理组HSP70表达明显增强的研究结果,提示EPO可以促进HSP70的表达,其机制可能是EPO对肾缺血细胞在转录和翻译水平上调HSP70的表达,从而使HSP70合成增加,增强肾脏对缺血及氧化损伤的抵抗力,从而减少大鼠肾缺血再灌注损伤。
综上所述,EPO可以通过诱导HSP70生成增加,抑制肾小管上皮细胞氧化应激、减轻肾脏缺血,对肾脏产生保护作用。而EPO后处理由于其较缺血预处理有更好的可操作性及安全性,可望作为一种新型治疗手段应用于临床。
[1]PALEVSKY P M,MOLITORIS B A,OKUSA M D,et al.Design of clinical trials in acute kidney injury:report from an NIDDK workshop on trial methodology[J].Clin J Am Soc Nephrol,2012,7(5):844-850.
[2]JIANG S H,LIU C F,ZHANG X L,et al.Renal protection by delayed ischaemic preconditioning is associated with inhibition of the inflammatory response and NF-kappaB activation[J].Cell Biochem Funct,2007,25(3):335-343.
[3]SERVIDDIO G,ROMANO A D,GESUALDO L,et al.Postconditioning is an effective strategy to reduce renal ischaemia/reperfusion injury[J].Nephrol Dial Transplant,2008,23(4):1504-1512.
[4]苏南湘,祖雄兵.黄芪对大鼠肾缺血再灌注损伤保护作用机制研究[J].中国现代医学杂志,2004,14(8):142.
[5]LOMBARDERO M,KOVACS K,SCHEITHAUER BW.Erythropoietin:a hormone with multiple functions[J].Pathobiology,2011,78(1):41-53.
[6]陈超豪,钱辉军,张茨,等.促红细胞生成素联合缺血预处理对肾缺血再灌注损伤的保护作用[J].武汉大学学报(医学版),2014,35(4):515-518.
[7]成月英.肾脏缺血再灌注损伤发病机制研究进展 [J].齐鲁医学杂志,2014,29(1):87-89.
[8]MKADDEM S B,PEDRUZZI E,WERTS C,et al.Heat shock protein gp96 and NAD(P)H oxidase 4 play key roles in Toll-like receptor 4-activated apoptosis during renal ischemia/reperfusion injury[J].Cell Death and Differentiation,2010,17(9):1474-1485.
[9]MKADDEM SB,WERTS C,GOUJON JM,et al.Heat shock protein gp96 interacts with protein phosphatase5 and controls toll-like receptor 2(TLR2)-mediated activation of extracellular signal-regulated kinase(ERK)1/2 in post-hypoxic kidney cells[J].J Biol Chem,2009,284(18):12541-12549.
[10]WANG Y,JI H X,ZHENG J N,et al.Protective effect of selenite on renal ischemia/reperfusion injury through inhibiting ASK1-MKK3-p38 signal pathway[J].Redox Rep,2009,14(6): 243-250.
[11]WANG R,WU X,LIANG J,et al.Intra-artery infusion of recombinant human erythropoietin reduces blood-brain barrier disruption in rats following cerebral ischemia and reperfusion[J]. Int J Neurosci,2014,125(9):1-27.
[12]SHIMODA M,SAWADA T,IWASAKI Y,et al.Erythropoietin strongly protects the liver from ischemia-reperfusion injury in a pig model[J].Hepatogastroenterology,2009,56:470-475.
[13]BOGOYEVITCH M A.An update on the cardiac effects of erythropoietin cardioprotection by erythropoietin and the lessons learnt from studies in neuroprotection[J].Cardiovasc Res,2004,S63(2):208-216.
[14]方平,黄静,杨天德.大鼠脑组织缺血再灌注后促红细胞生成素对神经元的保护[J].中国临床康复,2005,9(17):80-82.
[15]LUO D L,ZHOU J H,LIU B H,et aI.Changes and significance of HSP70 in Iiver with secondary hepatic injury in the earIy stage in rats after severe trauma[J].Chin J Emerg Med,2002,11(2):98-100.
[16]毛渭东,孙少华.乌司他丁对大鼠肾脏机械性损伤后肾脏HSP70、IL-6表达的早期影响[J].四川大学学报(医学版),2008,39(4):591-594.
[17]ZHANG P L,LUN M,SCHWORER C M,et al.Heat shock protein expression is highly sensitive to ischemia-reperfusion injury in rat kidneys[J].Ann Clin Lab Sci,2008,38(1):57-64.
[18]YEH C H,HSU S P,YANG C C,et al.Hypoxic preconditioning reinforces HIF-alpha-dependent HSP70 signaling to reduce ischemic renal failure-induced renal tubular apoptosis and autophagy[J].Life Sci,2010,86(3/4):115-123.
(张蕾编辑)
Effect of erythropoietin postconditioning on renal ischem iareperfusion injury in rats
Qian-qian Sun1,Yuan Cheng2,Xiao-hua Meng1,Guo-hui Shi1
(1.Department of Nephrology,Tangshan North China University of Science and Technology Affiliated Hospital,Tangshan,Hebei063000,China;2.Departmentof Cardio-thoracic Surgery,Tangshan North China University of Science and Technology Affiliated Hospital,Tangshan,Hebei 063000,China)
Objective To investigate the effectoferythropoietin(EPO)postconditioningon renal ischemia-reperfusion injury(IRI)in rats.M ethods A total of 18male Sprasue-Dawley(SD)ratswere random ly allocated to three groups: Sham group,ischemia-reperfusion injury(IRI)group,EPO postconditioning group,respectively.Serum blood urea nitrogen(BUN)and creatinine(Cr)were analyzed with automatic biochemical analyzer.Histopathological changes were observed with HE staining.The expression of HSP70 in kidney was checked by immunohistochemistry.Results Serum BUN and serum Cr in IRI group were significantly higher than those in Sham group,while levels of serum BUN and serum Cr in EPO postconditioning group were between the Sham group and IRIgroup.Significant necrosis of tubular epithelial cells and tubular lumen expansion in hematoxylin were found in IRIgroup.Compared with IRI group,tubular necrosis significantly reduced in EPO postconditioning group.Immunohistochemistry showed that the expression of HSP70 in EPO postconditioning group was the strongest,and significantly decreased in the Sham group,and IRIgroup was between them.Conclusions EPO postconditioning enhances the expression of HSP70 after IRI,which helps to reduce kidney injury.
kidney;postconditioning;ischemia-reperfusion injury;HSP70;rats
R 692;R 332
A
10.3969/j.issn.1005-8982.2016.12.003
1005-8982(2016)12-0011-04
2016-01-19
史国辉,E-mail:saint40@sina.com

