禾谷炭疽菌CFEM效应子的生物信息学鉴定与转录分析
井忠英, 王国梁, 刘文德
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
禾谷炭疽菌CFEM效应子的生物信息学鉴定与转录分析
井忠英,王国梁*,刘文德*
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京100193)
植物病原真菌效应子是指可以改变寄主植物细胞结构或者细胞功能的分泌蛋白或其他小分子物质。效应子对病原真菌的侵入、扩展以及致病发挥着至关重要的作用,是植物病原真菌与寄主的互作不断演化的必然结果。真菌特有的CFEM(commoninseveralfungalextracellularmembraneprotein)蛋白对于病原真菌的致病性起重要作用,一些能够被分泌到胞外的CFEM蛋白被证明是病原真菌效应子。由禾谷炭疽菌(Colletotrichum graminicola)引起的玉米炭疽病是玉米上的重要病害,常年造成严重损失。本研究运用生物信息学工具对禾谷炭疽菌中的CFEM蛋白进行信号肽分析和亚细胞定位分析,进而通过转录分析明确禾谷炭疽菌CFEM蛋白的表达时期。分析结果表明,该病原真菌编码32个CFEM蛋白,其中22个具有信号肽并可分泌至胞外,为分泌蛋白。转录分析表明,10个CFEM分泌蛋白于病菌侵染时附着胞形成期表达,2个CFEM分泌蛋白于侵染后的活体寄生阶段表达,1个于死体寄生阶段表达,其余9个CFEM分泌蛋白在病菌侵染时期的3个阶段均稳定表达。结合生物信息学和转录分析结果,我们预测这22个CFEM分泌蛋白为禾谷炭疽菌致病相关的效应子(简称CFEM效应子)。明确禾谷炭疽菌中CFEM蛋白数量,预测病菌致病相关的CFEM效应子组成,可为开展病原真菌CFEM蛋白介导的病菌—寄主互作研究奠定基础,并为玉米炭疽病的防治和抗性育种研究提供参考。
禾谷炭疽菌;CFEM效应子;生物信息学分析
玉米是世界三大作物之一,也是目前中国第一大粮食作物。每年作物病害都会造成严重的经济损失,直接威胁世界粮食安全[1-3]。据统计,玉米丝黑穗病以及大斑病、小斑病是危害我国玉米生产的3种主要病害,但随着耕作方式的转变以及全球气候、生态的改变,十余种次要病害逐年加重[4-5],部分病害有上升为主要病害的趋势,已成为制约玉米生产的重要因素。目前玉米炭疽病已在我国各玉米种植区普遍发生,其病原菌是半活体寄生菌禾谷炭疽菌(Colletotrichum graminicola),其侵染阶段分为附着胞形成期、活体寄生和死体寄生3个阶段。该病原真菌仅危害玉米,不危害其他禾本科作物[6-7]。基因组学和分子生物学的快速发展以及2008年该菌全基因组信息的公布,极大地促进了禾谷炭疽菌—玉米的互作研究,为揭示病原菌的侵染致病机制和寄主植物的抗病反应机理,以及制定该病害的有效防控措施奠定了基础。
病菌效应子在病原真菌和寄主的互作中发挥着至关重要的作用,其直接影响病菌的侵入、扩展蔓延和病害发生[8-10]。病原真菌效应子主要为病菌分泌蛋白,少部分为病菌分泌的其他小分子物质,由病菌分泌至寄主细胞间或细胞内[11],继而与寄主相应靶标互作,引起寄主细胞结构或功能的改变[12]。病原真菌效应子一般具有如下3方面特征:(1)一般通过胞吐的方式由病菌分泌至体外,故效应子N端氨基酸序列具有信号肽[11,13];(2)真菌效应子一般不具有膜蛋白的跨膜螺旋结构域及GPI(glycosylphosphatidyli-nositol)锚定位点;(3)效应子一般在病原真菌侵染阶段表达,尤其是活体或死体寄生阶段[14]。
CFEM(commoninseveralfungalextracellularmembraneprotein)蛋白仅存在于真菌中,且常见于真菌的胞外膜蛋白[15],并因此而得名。该蛋白结构域约有60个氨基酸,共有8个半胱氨酸。研究证实CFEM蛋白与病菌致病性密切相关,白假丝酵母(Candida albicans)[16]以及粗球孢子菌(Coccidioides immitis)[17]等病原真菌中均已发现致病相关的CFEM蛋白。半活体寄生菌稻瘟病菌(Magnapothe oryzae)已发现致病相关的CFEM效应子[18],但目前尚无禾谷炭疽菌(C.graminicola)致病相关CFEM效应子的报道。因此,本文利用生物信息学方法分析禾谷炭疽菌CFEM蛋白。通过对CFEM蛋白进行信号肽分析,亚细胞定位分析,结合转录分析结果,预测禾谷炭疽菌CFEM效应子组成,将为进一步研究该菌CFEM效应子的功能奠定基础。
1 材料与方法
1.1材料
利用已发表的稻瘟菌(M. oryzae)胞外受体信号分子CFEM蛋白ACI1[19]的CFEM结构域氨基酸序列进行Blastp(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)搜索禾谷炭疽菌全基因组数据库(http:∥www.broadinstitute.org/annotation/genome/colletotrichum_group/MultiHome.html)。根据是否存在CFEM结构域的典型特征,共鉴定到32个C.graminicolaCFEM蛋白,并从禾谷炭疽菌全基因组数据库中调取这32个CFEM蛋白的氨基酸序列,供进一步的生物信息学分析。
试验所用玉米品种‘Mo17’由中国农业科学院作物科学研究所王晓鸣研究员提供。禾谷炭疽菌(C.graminicola)M2菌株由美国TexasA&MUniversity的MartinDickman教授惠赠。
1.2方法
1.2.1生物信息学分析
使用ExPASy平台的在线软件SignalP4.1Server(http:∥www.cbs.dtu.dk/services/SignalP/)和TargetP1.1(http:∥www.cbs.dtu.dk/services/TargetP/)分别预测蛋白质氨基酸序列的N端信号肽和亚细胞定位。按要求输入fasta格式的32个氨基酸序列,N信号肽分析选择默认设置,而亚细胞定位分析时organismgroup选择non-plant,其他为默认设置。
1.2.2转录分析
玉米‘Mo17’3叶1心期为最佳接种时期,菌株M2孢子浓度为(5~6)× 105个/mL,分别于接种后20h(附着胞形成阶段,PA)、36h(活体寄生阶段,BP)、64h(死体寄生阶段,NP)取样。提取野生型禾谷炭疽菌M2侵染时期表达RNA,反转录为cDNA,RT-PCR扩增获得3个表达时期的CFEM蛋白基因。RNA提取及反转录为cDNA的方法按O′Connell等[20]所述,所有CFEM蛋白基因克隆片段均构建至Peasy-T载体(购自北京全式金生物技术有限公司)并送北京六合华大基因科技有限公司测序,测序结果与基因注释完全一致。所有引物皆由北京六合华大基因科技有限公司合成;RNA提取方法参见QIGEN公司RNeasePlantMinikit试剂盒使用说明;反转录参见Promega公司M-MLV反转录体系说明。
2 结果与分析
2.1禾谷炭疽菌CFEM蛋白信号肽分析
信号肽是分泌蛋白的基本特征。因此,本文首先对禾谷炭疽菌中所有的CFEM蛋白信号肽预测,初步确定禾谷炭疽菌CFEM分泌蛋白的组成。由SignalP4.1Server在线软件对该菌CFEM蛋白进行信号肽预测分析的结果显示,32个CFEM蛋白中有22个CFEM蛋白N端氨基酸序列具有信号肽,其信号肽序列为N端15~28个氨基酸(表1)。信号肽可引导蛋白精确地定位于胞内线粒体、叶绿体或通过分泌系统分泌至胞外[21]。因此,需进一步明确CFEM蛋白的亚细胞定位,从而排除胞内CFEM蛋白或膜蛋白。
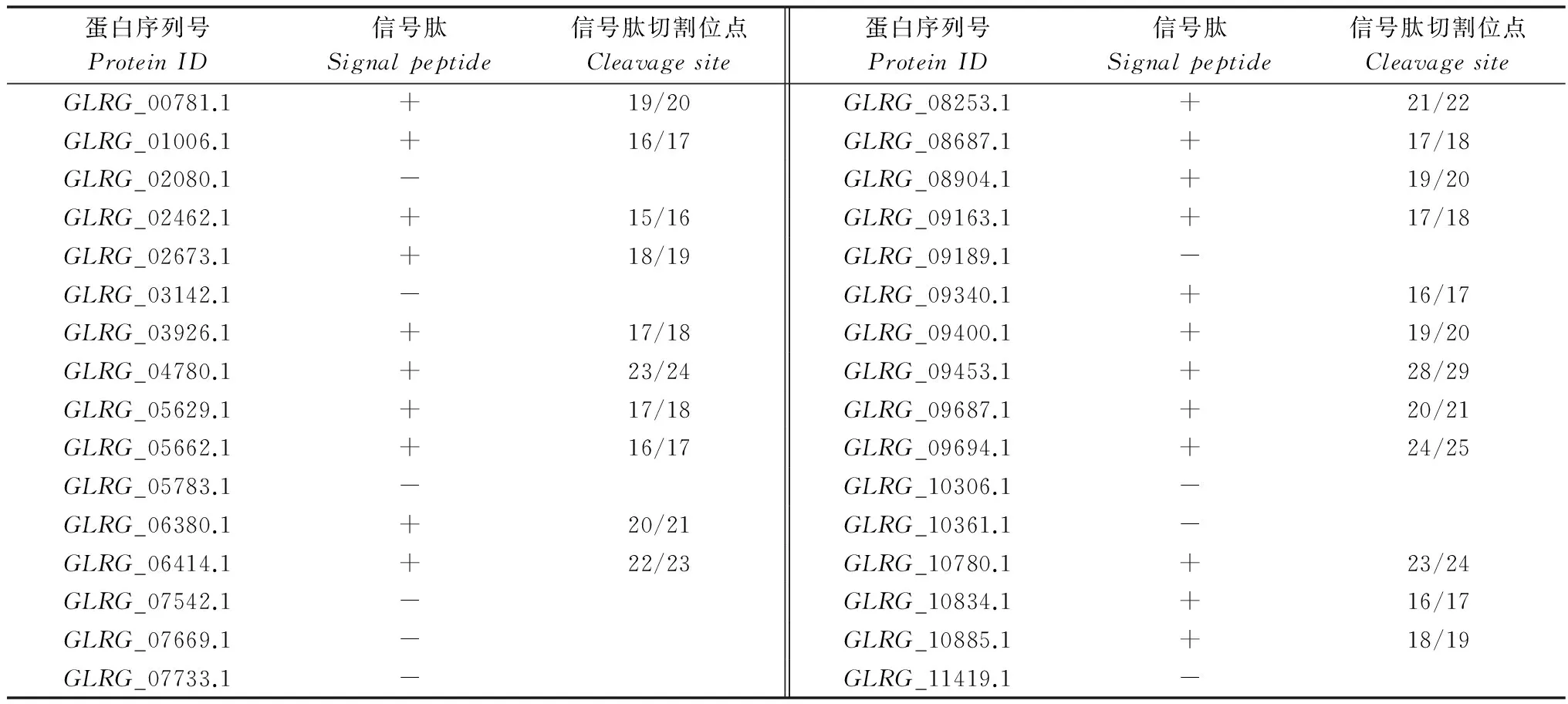
表1 禾谷炭疽菌CFEM蛋白信号肽分析1)Table 1 Bioinformatic analysis of signal peptide of CFEM proteins in Colletotrichum graminicola
1) +表示该基因表达的蛋白具有信号肽;-表示该基因表达的蛋白不具有信号肽。
+indicatestheproteinhassignalpeptidesequences;-indicatestheproteinhasnosignalpeptidesequences.
2.2禾谷炭疽菌CFEM蛋白亚细胞定位分析
继信号肽分析之后,本文利用TargetP软件对22个具信号肽CFEM蛋白进行亚细胞定位分析,进一步明确CFEM胞外分泌蛋白的组成。预测结果表明,22个具有信号肽CFEM蛋白通过分泌途径分泌至胞外的得分值≥0.672。其中,除GLRG_08904.1、GLRG_10834.1定位可信度略低(RC=4)外,其余20个CFEM蛋白的定位预测可信度皆较高(RC≤2)。因此,22个具有信号肽CFEM蛋白均为分泌蛋白,可通过禾谷炭疽菌分泌途径分泌至胞外(表2)。

表2 22个具信号肽的CFEM蛋白的亚细胞定位预测分析1)Table 2 Subcellular localization prediction of CFEM proteins in Colletotrichum graminicola
续表2Table2(Continued)

蛋白序列号ProteinID细胞器定位得分值SubcellularlocalizationpredictionvaluesmTPSPOtherLocRC蛋白序列号ProteinID细胞器定位得分值SubcellularlocalizationpredictionvaluesmTPSPOtherLocRCGLRG_06380.10.0560.8620.039S1GLRG_10780.10.0370.9740.021S1GLRG_06414.10.0190.9700.046S1GLRG_10834.10.0630.6720.316S4GLRG_08253.10.1140.7930.034S2GLRG_10885.10.0370.9550.042S1
1) RC:可信度等级,估算亚细胞定位预测最大值和次值之间的差距(diff)。RC=1~5,1:diff≥0.800;2:0.800>diff≥0.600;3:0.600>diff≥0.400;4:0.400>diff≥0.200;5:diff<0.200。RC值越低,定位越准确,RC=1定位预测最可靠。mTP:线粒体定位;S:分泌途径;SP:该蛋白含有信号肽,可通过分泌途径分泌至胞外,为分泌蛋白;Other:其他定位;Loc:预测定位结果。
RC:Reliabilityclass,from1to5,where1indicatesthestrongestprediction. RCisameasureofthesizeofthedifference(diff)betweenthehighest(winning)andthesecondhighestoutputscores.Thereare5reliabilityclasses,definedasfollows: 1, diff ≥ 0.800; 2, 0.800 > diff ≥ 0.600; 3, 0.600 > diff ≥ 0.400; 4, 0.400 > diff ≥ 0.200;5, diff<0.200.Thus,thelowerthevalueofRC,thesafertheprediction;mTP:Mitochondrionlocalization,i.e.thesequencecontainsmTP,amitochondrialtargetingpeptide;S:Secretionpathway;SP:Signalpeptide;Other:Anyotherlocalization;Loc:Predictionoflocalization.
2.3禾谷炭疽菌CFEM分泌蛋白的转录分析
禾谷炭疽菌侵染玉米的过程可以分为3个阶段,分别是“附着胞形成阶段(in plantaappressoria,PA)、活体寄生阶段(biotrophicphase,BP)、死体寄生阶段(necrotrophicphase,NP)”。已知病原真菌侵染阶段表达的分泌蛋白更有可能与病菌的致病密切相关,为此,继亚细胞定位分析之后,我们对已鉴定的禾谷炭疽病菌22个CFEM分泌蛋白做相应的转录分析,即利用病原真菌接种寄主植物,获取侵染时期3个阶段的RNA和cDNA,继而借助RT-PCR分析所有CFEM分泌蛋白的表达情况。RT-PCR分析结果表明,9个CFEM分泌蛋白在禾谷炭疽菌3个时期均有表达;10个CFEM分泌蛋白在禾谷炭疽菌侵染玉米过程的附着胞形成阶段特异表达;GLRG_08904.1、GLRG_09163.1在禾谷炭疽菌形成初级侵染菌丝的活体寄生阶段特异表达;GLRG_05629.1在禾谷炭疽菌形成次级侵染菌丝、诱导寄主细胞凋亡的死体寄生阶段特异表达(表3)。因此,22个CFEM分泌蛋白皆可在禾谷炭疽菌侵染阶段表达,我们预测这22个基因均为禾谷炭疽菌CFEM效应子。
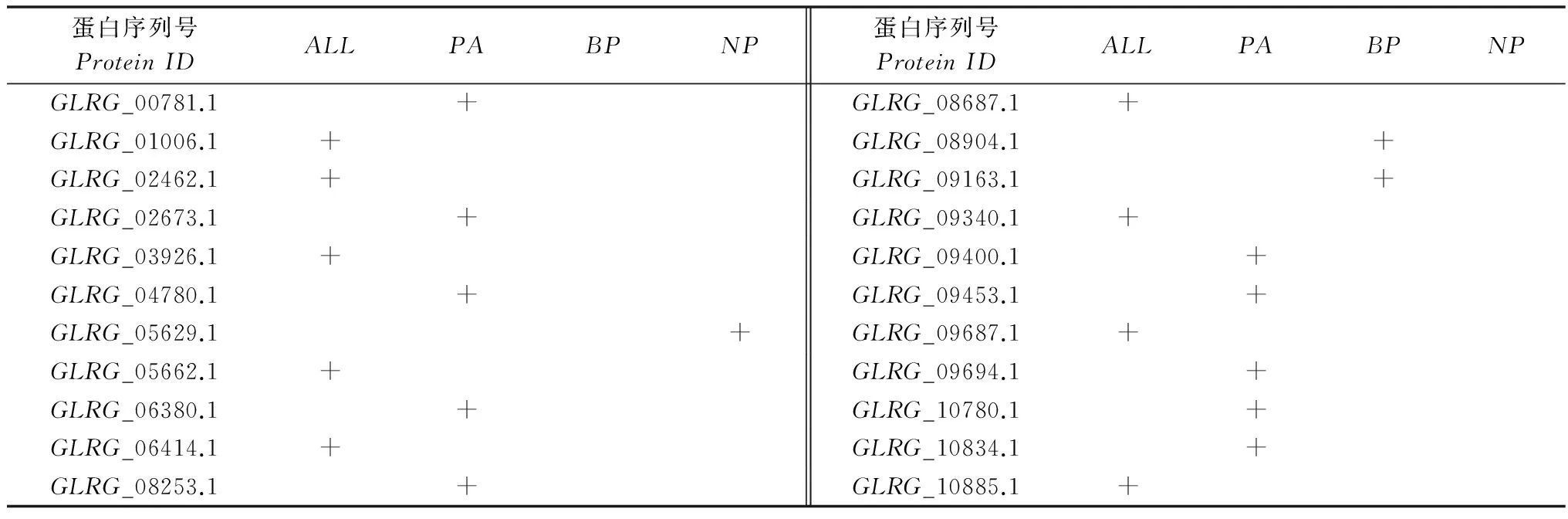
表3 CFEM效应子转录分析1)Table 3 Transcriptional analysis of Colletotrichum graminicola CFEM effectors
1)PA:附着胞形成阶段表达的CFEM效应子;BP:活体寄生阶段表达的CFEM效应子;NP:死体寄生阶段表达的CFEM效应子;ALL:以上3个阶段均表达的CFEM效应子;+表示效应子在该时期表达。
PA:In plantaappressoriumphase;BP:Biotrophicphase;NP:Necrotrophicphase;ALL:Allthesethreeinfectionphase,includingPA,BPandNP;+meansthiscandidateeffectorexpressedinthisphase.
3 讨论
病原真菌与寄主植物的互作一直是近年来的研究热点,其中效应子诱导的免疫反应ETI(effector-triggeredimmunity)和效应子诱导的感病反应ETS(effector-triggeredsusceptibility)的研究报道尤其之多。禾谷炭疽菌侵染寄主植物时,其附着胞在病原真菌侵染初期吸附于寄主植物表面,通过膨压直接穿透寄主表面;随后病原真菌的侵染菌丝(初级侵染菌丝及次级侵染菌丝)在寄主细胞内蔓延扩展,通过分泌大量的效应子对寄主的生理生化免疫防卫反应起到直接干扰作用,阻碍寄主相应受体靶标的功能执行,进而导致寄主免疫防卫体系紊乱,诱发ETS[22]。因此,效应子研究可以明晰病原真菌与寄主互作机理,为抗病育种和病害防治提供理论指导。
据报道,半活体寄生菌稻瘟菌约含61个CFEM蛋白[23],研究表明PTH11[24-26]、ACI1[19,27]及MoCDIP2[18]这3个CFEM基因均于附着胞形成期表达。ACI1为胞外受体信号分子,通过与MAC1的互作,参与cAMP信号传递,直接影响附着胞的形成,但与稻瘟菌营养生长和致病性无关[27]。与之相反,PTH11作为附着胞及芽管胞内信号分子[24]与附着胞的形成无关[25],而与稻瘟菌的致病性密切相关[24,26];MoCDIP2可诱导寄主细胞凋亡[18],是目前唯一鉴定到的稻瘟菌CFEM效应子。此外,研究证实白假丝酵母(C.albicans)的CFEM蛋白CSA1及粗球孢子菌(C.immitis)的CFEM蛋白AG2均为膜蛋白,能够调节菌丝生长及其致病性[16-17]。因此,推测CFEM蛋白可能为真菌细胞表面受体或信号分子,承接信号传递,从而影响真菌致病性。
随着基因组预测的快速发展,生物信息学分析逐渐成为一门基于计算机学、数学、物理学、生物学的交叉学科,在序列同源性分析、二级或三级结构域分析以及功能预测方面发挥重要作用,基于生物信息学分析的研究亦与日俱增[28-31],极大地促进了病原真菌效应子的预测和研究。禾谷炭疽菌是半活体寄生菌研究的模式物种,然而,尚无相关CFEM效应子的报道。因此,CFEM效应子功能的解读有助于加快病菌-寄主互作机理的研究步伐。效应子各具特色,无明显的结构特征。除Fusarium oxysporumf.sp. lycopersici中的Six1[32]外,同一属不同种的效应子亦不尽相同。但只要病原菌可以分泌该蛋白质至体外,并且该蛋白可影响寄主植物的生理反应,干扰寄主的免疫防卫反应,即是效应子。因此,信号肽成为效应子评判的重要指标[14]。因此,本文首先利用SignalP软件分析禾谷炭疽菌中32个CFEM蛋白,确定禾谷炭疽菌共有22个具信号肽CFEM蛋白。其次,利用TargetP软件分析是否所有的具信号肽CFEM蛋白皆可分泌至胞外,从而影响病菌与寄主的互作。Lee等及陈继圣等已用TargetP软件预测稻瘟菌(M. oryzae)和假丝酵母(C.albicans)基因组中的分泌蛋白,其预测结果与实际基本一致[21,33]。我们综合信号肽分析和亚细胞定位分析两方面的预测结果,推测禾谷炭疽菌C.graminicola共有22个CFEM分泌蛋白。然而,并非所有的分泌蛋白都与病菌的致病性相关,研究证实侵染阶段表达的分泌蛋白更有可能影响病菌致病性,即更有可能为效应子[14]。我们通过RT-PCR技术,确定禾谷炭疽菌(C.graminicola)22个CFEM分泌蛋白均在病菌的侵染阶段表达。其中,GLRG_08904.1、GLRG_09163.1以及GLRG_05629.1分别于病菌的活体寄生阶段和死体寄生阶段表达,与病菌的致病性关系可能更为密切。鉴于以上3个方面的分析,预测禾谷炭疽菌中存在22个CFEM效应子。本研究利用生物信息学的方法对禾谷炭疽菌所有CFEM蛋白质进行预测和分析,将为后续的功能研究(通过酵母蛋白分泌系统分析、基因敲除和突变体接种、烟草瞬时表达系统进行细胞凋亡筛选等试验)奠定坚实的基础。
[1]PennisiE.Armedanddangerous[J].Science, 2010, 327(5967): 804-805.
[2]FisherMC,HenkDA,BriggsCJ,etal.Emergingfungalthreatstoanimal,plantandecosystemhealth[J].Nature,2012,484(7393):186-194.
[3]LiuWende,LiuJinling,NingYuese,etal.RecentprogressinunderstandingPAMP-andeffector-triggeredimmunityagainstthericeblastfungusMagnaporthe oryzae [J].MolecularPlant,2013,6(3):605-620.
[4]王晓鸣,晋齐鸣,石洁,等.玉米病害发生现状与推广品种抗性对未来病害发展的影响[J].植物病理学报,2006,36(1):1-11.
[5]冀萍. 玉米病害的发生与防治[J]. 现代农业科技, 2011(19): 196-196.
[6]VargasWA,MartínJMS,RechGE,etal.PlantdefensemechanismsareactivatedduringbiotrophicandnecrotrophicdevelopmentofColletotrichum graminicolainmaize[J].PlantPhysiology, 2012, 158(3): 1342-1358.
[7]TorresMF,CuadrosDF,VaillancourtLJ.EvidenceforadiffusiblefactorthatinducessusceptibilityintheColletotrichum-maizediseaseinteraction[J].MolecularPlantPathology, 2014, 15(1): 80-93.
[8]DoddsPN,RathjenJP.Plantimmunity:towardsanintegratedviewofplant-pathogeninteractions[J].NatureReviewsGenetics, 2010, 11(8): 539-548.
[9]MaekawaT,KuferTA,Schulze-LefertP.NLRfunctionsinplantandanimalimmunesystems:sofarandyetsoclose[J].NatureImmunology, 2011, 12(9): 817-826.
[10]GassmannW,BhattacharjeeS.Effector-triggeredimmunitysignaling:fromgene-for-genepathwaystoprotein-proteininteractionnetworks[J].MolecularPlant-MicrobeInteractions, 2012, 25(7): 862-868.
[11]GiraldoMC,ValentB.Filamentousplantpathogeneffectorsinaction[J].NatureReviewsMicrobiology, 2013, 11(11): 800-814.
[12]KamounS.Acatalogueoftheeffectorsecretomeofplantpathogenicoomycetes[J].AnnualReviewofPhytopathology, 2006, 44: 41-60.
[13]TortoTA,LiShuang,StyerA,etal.ESTminingandfunctionalexpressionassaysidentifyextracellulareffectorproteinsfromtheplantpathogenPhytophthora [J].GenomeResearch, 2003, 13(7): 1675-1685.
[14]EllisJG,RafiqiM,GanP,etal.Recentprogressindiscoveryandfunctionalanalysisofeffectorproteinsoffungalandoomyceteplantpathogens[J].CurrentOpinioninPlantBiology, 2009, 12(4): 399-405.
[15]KulkarniRD,KelkarHS,DeanRA.Aneight-cysteine-containingCFEMdomainuniquetoagroupoffungalmembraneproteins[J].TrendsinBiochemicalSciences, 2003, 28(3): 118-121.
[16]LamarreC,DeslauriersN,BourbonnaisY.ExpressioncloningoftheCandida albicansCSA1geneencodingamycelialsurfaceantigenbysortingofSaccharomyces cerevisiaetransformantswithmonoclonalantibody-coatedmagneticbeads[J].MolecularMicrobiology, 2000, 35(2): 444-453.
[17]PengT,OrsbornKI,OrbachMJ,etal.Proline-richvaccinecandidateantigenofCoccidioides immitis:conservationamongisolatesanddifferentialexpressionwithspherulematuration[J].JournalofInfectiousDiseases, 1999, 179(2): 518-521.
[18]ChenS,SongkumarnP,VenuRC,etal.Identificationandcharacterizationofinplanta-expressedsecretedeffectorproteinsfromMagnaporthe oryzaethatinducecelldeathinrice[J].MolecularPlant-MicrobeInteractions,2013,26(2):191-202.
[19]KulkarniRD,DeanRA.Identificationofproteinsthatinteractwithtworegulatorsofappressoriumdevelopment,adenylatecyclaseandcAMP-dependentproteinkinaseA,inthericeblastfungusMagnaporthe grisea [J].MolecularGeneticsandGenomics, 2004, 270(6): 497-508.
[20]O′ConnellRJ,ThonMR,HacquardS,etal.LifestyletransitionsinplantpathogenicColletotrichumfungidecipheredbygenomeandtranscriptomeanalyses[J].NatureGenetics, 2012, 44(9): 1060-1065.
[21]LeeSA,WormsleyS,KamounS,etal.AnanalysisoftheCandida albicansgenomedatabaseforsolublesecretedproteinsusingcomputer-basedpredictionalgorithms[J].Yeast, 2003, 20(7): 595-610.
[22]PieterseCMJ,Leon-ReyesA,vanderEntS,etal.Networkingbysmall-moleculehormonesinplantimmunity[J].NatureChemicalBiology, 2009, 5(5): 308-316.
[23]KulkarniRD,ThonMR,PanHuaqin,etal.NovelG-protein-coupledreceptor-likeproteinsintheplantpathogenicfungusMagnaporthe grisea [J].GenomeBiology, 2005, 6(3):R24.
[24]RamanujamR,CalvertME,SelvarajP,etal.Thelateendosomalhopscomplexanchorsactiveg-proteinsignalingessentialforpathogenesisinMagnaporthe oryzae [J].PLoSPathogens, 2013, 9(8):e1003527.
[25]JinQingchao,DongHaitao,PengYouliang,etal.ApplicationofcDNAarrayforstudyingthegeneexpressionprofileofmatureappressoriaofMagnaporthe grisea [J].JournalofZhejiangUniversityScienceB:Biomedicine&Biotechnology, 2007, 8(2): 88-97.
[26]DeZwaanTM,CarrollAM,ValentB,etal. Magnaporthe griseaPth11pisanovelplasmamembraneproteinthatmediatesappressoriumdifferentiationinresponsetoinductivesubstratecues[J].ThePlantCell, 1999, 11(10): 2013-2030.
[27]DengJixin,DeanRA.CharacterizationofadenylatecyclaseinteractingproteinACI1inthericeblastfungus, Magnaporthe oryzae [J].TheOpenMycologyJournal, 2008, 2: 74-81.
[28]SalomonD,KinchLN,TrudgianDC,etal.MarkerfortypeVIsecretionsystemeffectors[J].ProceedingsoftheNationalAcademyofSciences, 2014, 111(25): 9271-9276.
[29]SoyerJL,ElGhalidM,GlaserN,etal.EpigeneticcontrolofeffectorgeneexpressionintheplantpathogenicfungusLeptosphaeria maculans [J].PLoSGenetics, 2014, 10(3):e1004227.
[30]WangChenfang,ZhangShijie,HouRui,etal.FunctionalanalysisofthekinomeofthewheatscabfungusFusarium graminearum [J].PLoSPathogens, 2011, 7(12):e1002460.
[31]HrabakEM,ChanCWM,GribskovM,etal.TheArabidopsisCDPK-SnRKsuperfamilyofproteinkinases[J].PlantPhysiology, 2003, 132(2): 666-680.
[32]vanderDoesHC,LievensB,ClaesL,etal.ThepresenceofavirulencelocusdiscriminatesFusarium oxysporumisolatescausingtomatowiltfromotherisolates[J].EnvironmentalMicrobiology, 2008, 10(6): 1475-1485.
[33]陈继圣, 郑士琴, 郑武, 等. 全基因组预测稻瘟菌的分泌蛋白[J]. 中国农业科学, 2006, 39(12): 2474-2482.
(责任编辑:杨明丽)
BioinformaticidentificationandtranscriptionalanalysisofColletotrichum graminicolaCFEMeffectorrepertoires
JingZhongying,WangGuoliang,LiuWende
(StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPests,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
Fungaleffectorsaresecretedproteinsorothermoleculesthatcanalterhostcellstructureandfunctions.Theyplayacrucialroleinfungalpathogenesisandaretheweaponsfrompathogensforthecontinuousbattlewithhostplants.Untilnow,itisunclearhowtheCFEM(commoninseveralfungalextracellularmembraneprotein)proteinsandeffectorsconstituteinColletotrichum graminicola,thecausalagentofmaizeanthracnosedisease.Inthisstudy,weperformedasystematicalbioinformaticandtranscriptionalexpressionanalysisoftheCFEMeffectorrepertoiresencodedintheC.graminicolagenome.Weidentified32 C.graminicolaCFEMproteins,with22CFEMsecretedproteinswhichshowedvariousexpressionpatternsatdifferentinfectionstages.Amongthesesecretedproteins, 10proteinsexpressedinin-plantaappressoriumstage,twoexpressedinbiotrophicstage,oneexpressedinnecrotrophicstage,andothernineexpressedinallofthesethreestages.Finally,weproposedthatthese22CFEMsecretedproteinsarecandidateeffectorsinC.graminicola.OurfindingsprovideasolidfoundationforthefutureinvestigationofCFEMeffectormediatedpathogen-hostinteraction,andalsowillfacilitatemaizeanthracnosepreventionandcontrolanddiseaseresistancebreeding.
Colletotrichum graminicola;CFEMeffector;bioinformaticanalysis
2014-12-10
2015-03-03
植物病虫害生物学国家重点实验室开放课题(SKLOF201508)
E-mail:wang.620@osu.edu;liuwende@caas.cn
S435.131.4
ADOI:10.3969/j.issn.0529-1542.2016.01.014

