扶正抗毒丸对不同分期HIV/AIDS患者的疗效分析
李 钦 王 莉 陆中云云南省中医中药研究院,云南昆明 650223
扶正抗毒丸对不同分期HIV/AIDS患者的疗效分析
李 钦 王 莉 陆中云
云南省中医中药研究院,云南昆明 650223
目的 探讨扶正抗毒丸对不同分期人类免疫缺陷病毒(HIV)/艾滋病(AIDS)患者的临床疗效。 方法 回顾性分析2005年6月~2014年10月到云南省中医药防治艾滋病试点项目各治疗点接受单纯中医药治疗的患者在服用扶正抗毒丸12、24、36个月时,用药前后症状体征总积分、卡洛夫斯基积分、CD4+T淋巴细胞计数变化情况。结果 症状体征总积分:ⅡA、Ⅲ期治疗12、24、36个月与治疗前比较明显降低(P<0.01);ⅡB期治疗12、24个月与治疗前比较明显降低(P<0.01)。卡洛夫斯基积分:ⅡA期治疗12、24个月与治疗前比较明显升高(P<0.01);ⅡB期治疗12、24、36个月与治疗前比较明显升高 (P<0.01);Ⅲ期治疗12个月与治疗前比较明显升高 (P<0.01)。CD4+T淋巴细胞计数:ⅡA期治疗12、24个月与治疗前比较明显降低(P<0.01);ⅡB期治疗12、24、36个月与治疗前比较明显升高(P<0.05);Ⅲ期治疗24个月与治疗前比较明显升高(P<0.01)。 结论 扶正抗毒丸对减少ⅡA、ⅡB、Ⅲ期艾滋病患者临床症状体征、提高生存质量具有一定作用,能够在一定程度上提高ⅡB、Ⅲ期患者的CD4+T淋巴细胞计数,但对HIV感染ⅡA期患者CD4+T淋巴细胞计数的增加作用可能在较长时间(36个月)使用后才能显现。
扶正抗毒丸;不同分期;人类免疫缺陷病毒;艾滋病;疗效
艾滋病(acquired immune deficiency syndrome,AIDS)由人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染所致,从AIDS在我国发现以来,中医一直在寻找AIDS治疗的“黄金切入点”[1-2]。目前,多数专家均认为,中医治疗AIDS应该以中医理论为指导,结合辨证论治,及早介入[3-4],但其早期介入效果如何?这一直是困扰着中医界的问题,也是我们充分发挥中医辨证论治及“既病防变”的优势,运用中医药治疗AIDS迫切需要说明的问题。云南省是中国AIDS疫情高发区之一[5-6],本研究通过对服用扶正抗毒丸进行治疗的三个不同分期(ⅡA、ⅡB、Ⅲ期)HIV/AIDS患者的临床疗效进行动态观察,探讨扶正抗毒丸治疗AIDS的切入点,现将研究结果报道如下:
1 资料与方法
1.1 一般资料
本研究所有数据资料来源于云南省中医药防治AIDS试点项目数据库,包含云南省2005年6月~2014年10月经当地疾控中心确诊为AIDS并参与云南省中医药防治AIDS试点项目的所有有效病例(删除信息不完全、重复+检测结果缺失等病例)。本研究提交云南省中药中药研究院伦理委员会审查通过,所有患者均为经医生劝说后仍拒绝接受高效抗反转录病毒治疗(highly active antiretroviral therapy,HAART)而寻求中医药治疗者。
1.2 诊断标准
1.2.1 证候诊断标准 参照国家技术监督局1997年颁布的中华人民共和国国家标准 《中医临床诊疗术语·证候部分》[7]、2002年版 《中药新药临床研究指导原则》[8]等相关的证候诊断标准,筛选出证属气阴两虚、脾肾不足、邪毒内蕴的患者。
1.2.2 AIDS分期标准 AIDS诊断及分期标准依据原卫生部2008年制订的中华人民共和国卫生行业标准《艾滋病和艾滋病病毒感染诊断标准》(WS293-2008)[9],根据患者的CD4+T淋巴细胞计数水平和临床表现将AIDS分为HIV原发感染期(ⅠA、ⅠB期)、HIV感染中期(ⅡA、ⅡB期)、HIV感染晚期(Ⅲ期,AIDS期),本研究只对ⅡA、ⅡB、Ⅲ期进行观察。
1.3 方法
口服扶正抗毒丸(云南省中药中药研究院附属医院,批号:20120201),1袋/次,4次/d。不同分期、治疗时间患者数有所不同,其中ⅡA期治疗12、24、36个月时患者数分别为187、77、42例,ⅡB期治疗12、24、36个月时患者数分别为234、112、35例,Ⅲ期治疗12、24、36个月时患者数分别为136、70、38例。
1.4 观察指标
回顾性分析云南省中医药防治AIDS试点项目数据库中证属气阴两虚、脾肾不足、邪毒内蕴患者服用扶正抗毒丸12、24、36个月时,用药前后的症状体征总积分、卡洛夫斯基积分、CD4+T淋巴细胞计数变化情况。
1.5 统计学方法
采用SPSS 20.0统计软件包软件进行数据统计。计量资料采用Kolmogorov-Smirnov方法检验变量是否服从正态性分布,使用Levenetest进行方差齐性检验,正态分布变量采用配对t检验法,非正态分布变量采用非参数秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 ⅡA期患者疗效分析
治疗12、24、36个月时,患者症状体征总积分与治疗前比较明显降低,差异有高度统计学意义(P<0.01);卡洛夫斯基积分治疗12、24个月与治疗前比较明显升高,差异有高度统计学意义(P<0.01),治疗36个月与治疗前比较虽有升高但差异无统计学意义 (P>0.05);CD4+T淋巴细胞计数治疗12、24个月与治疗前比较明显降低,差异有高度统计学意义(P<0.01),治疗36个月与治疗前比较虽有降低但差异无统计学意义(P>0.05)。见表1。
表1 ⅡA期患者症状体征积分、卡洛夫斯基积分、CD4+T淋巴细胞计数变化情况(±s)

表1 ⅡA期患者症状体征积分、卡洛夫斯基积分、CD4+T淋巴细胞计数变化情况(±s)
注:与治疗前比较,**P<0.01
时间 例数 症状体征积分(分)治疗前 治疗后卡洛夫斯基积分(分)治疗前 治疗后C D 4 + T淋巴细胞(个/ μ L)治疗前 治疗后1 2个月2 4个月3 6个月1 8 7 7 7 4 2 8 . 3 2 ± 3 . 9 8 9 . 9 2 ± 3 . 4 8 9 . 0 1 ± 4 . 0 5 2 . 3 4 ± 1 . 1 2 * * 2 . 8 3 ± 1 . 2 5 * * 3 . 0 1 ± 0 . 9 9 * * 9 0 . 0 9 ± 6 . 9 2 9 0 . 6 7 ± 7 . 9 7 9 0 . 9 1 ± 5 . 8 6 9 4 . 7 9 ± 5 . 6 6 * * 9 6 . 1 3 ± 4 . 8 5 * * 9 3 . 1 0 ± 5 . 8 3 5 0 5 . 9 9 ± 1 2 1 . 7 6 5 1 4 . 1 7 ± 1 2 7 . 2 6 5 1 3 . 5 6 ± 1 1 8 . 5 0 4 3 6 . 2 5 ± 1 8 1 . 6 9 * * 4 1 7 . 1 1 ± 1 5 8 . 0 0 * * 5 0 9 . 5 4 ± 1 9 1 . 1 1
2.2 ⅡB期患者疗效分析
患者症状体征总积分治疗12、24个月与治疗前比较明显降低,差异有高度统计学意义(P<0.01),治疗36个月与治疗前比较虽有降低但差异无统计学意义(P>0.05);卡洛夫斯基积分治疗12、24、36个月与治疗前比较明显升高,差异有高度统计学意义(P<0.01);CD4+T淋巴细胞计数治疗12、24、36个月与治疗前比较明显升高,差异有统计学意义(P<0.05)。见表2。
2.3 Ⅲ期患者疗效分析
患者症状体征总积分治疗12、24、36个月与治疗前比较明显降低,差异有高度统计学意义(P<0.01);卡洛夫斯基积分治疗12个月与治疗前比较明显升高,差异有高度统计学意义(P<0.01),治疗24、36个
月与治疗前比较虽有升高但差异无统计学意义 (P>0.05);CD4+T淋巴细胞计数治疗24个月与治疗前比较明显升高,差异有高度统计学意义(P<0.01),治疗12、36个月与治疗前比较虽有升高但差异无统计学意义(P>0.05)。见表3。
表2 ⅡB期患者症状体征积分、卡洛夫斯基积分、CD4+T淋巴细胞计数的变化情况(±s)

表2 ⅡB期患者症状体征积分、卡洛夫斯基积分、CD4+T淋巴细胞计数的变化情况(±s)
注:与治疗前比较,*P<0.05,**P<0.01
时间 例数 症状体征积分(分)治疗前 治疗后卡洛夫斯基积分(分)治疗前 治疗后CD4+T淋巴细胞(个/μL)治疗前 治疗后12个月24个月36个月234 112 35 6.92±2.38 7.03±3.21 5.99±2.55 3.74±1.25**2.83±0.91**3.33±1.09 92.03±6.16 91.44±6.21 91.86±5.50 95.68±5.41**95.93±5.06**95.31±5.85**283.10±47.05 281.76±41.24 285.86±38.44 324.12±132.38*358.84±149.58*383.21±170.05*
表3 Ⅲ期患者症状体征积分、卡洛夫斯基积分、CD4+T淋巴细胞计数的变化情况(±s)
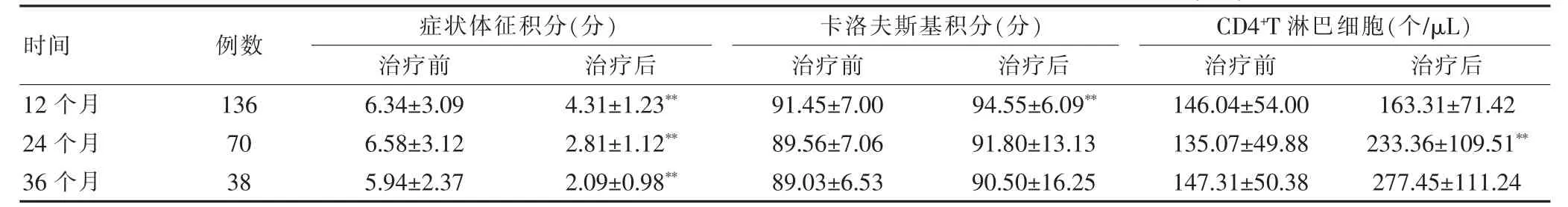
表3 Ⅲ期患者症状体征积分、卡洛夫斯基积分、CD4+T淋巴细胞计数的变化情况(±s)
注:与治疗前比较,**P<0.01
时间 例数 症状体征积分(分)治疗前 治疗后卡洛夫斯基积分(分)治疗前 治疗后CD4+T淋巴细胞(个/μL)治疗前 治疗后12个月24个月36个月136 70 38 6.34±3.09 6.58±3.12 5.94±2.37 4.31±1.23**2.81±1.12**2.09±0.98**91.45±7.00 89.56±7.06 89.03±6.53 94.55±6.09**91.80±13.13 90.50±16.25 146.04±54.00 135.07±49.88 147.31±50.38 163.31±71.42 233.36±109.51**277.45±111.24
3 讨论
现代医学将HIV感染及AIDS的临床表现分为HIV原发感染期(ⅠA、ⅠB期)、HIV感染中期(ⅡA、ⅡB期)、HIV感染晚期(Ⅲ期,AIDS期)。HIV感染ⅠA、ⅠB期持续时间较短仅为6~12个月,ⅡA、ⅡB期时间最长,平均6~7.5年,HIV感染晚期(Ⅲ期,AIDS期)平均2~3年[9]。ⅠA、ⅠB期因持续时间较短,治疗的重点主要在ⅡA、ⅡB期和Ⅲ期。目前,HAART是治疗AIDS的主流疗法,其有效降低了AIDS的发病率和病死率[10-12],但是,长期抗病毒治疗的同时患者容易出现肝功能异常、恶心、头痛、疲乏等不良反应[13-15]。如何充分发挥中医的优势,减少患者的临床症状、体征,改善患者生活质量,使其长期带毒生存,对AIDS的临床治疗具有十分重要的意义,也是今后中医药治疗AIDS着重研究的方向[16-18]。
扶正抗毒丸由黄芪、人参、黄精、白术、灵芝等组成,具有益气养阴、滋肾健脾、清热解毒的功效,主要用于AIDS无症状期感染者,辨证属气阴两虚、脾肾不足、邪毒内蕴,症见消瘦(体重减轻)、咳嗽、乏力、气短、自汗、盗汗、纳呆、恶心、脱发、疼痛者。本研究发现:①服用扶正抗毒丸治疗12、24、36个月时,ⅡA、ⅡB、Ⅲ期患者症状体征总积分呈逐渐降低的趋势,除ⅡB期治疗36个月与治疗前比较无明显降低 (P>0.05),其余各组均显著下降(P<0.01);三个不同分期患者卡洛夫斯基积分均呈逐渐升高的趋势,除ⅡA期治疗36个月、Ⅲ期治疗24、36个月与治疗前比较无明显升高 (P>0.05),其余各组均显著升高 (P<0.01),说明扶正抗毒丸对三个不同分期的AIDS患者均具有减轻临床症状体征、提高生存质量的作用。②ⅡA期患者服用扶正抗毒丸治疗12、24个月个后CD4+T淋巴细胞计数仍然表现为显著下降 (P<0.01),治疗36个月时,CD4+T淋巴细胞计数接近治疗前,而ⅡB期患者(治疗12、24、36个月)和Ⅲ期患者(治疗24个月时)CD4+T淋巴细胞计数较治疗前显著增加(P<0.05或P<0.01),个别时点(Ⅲ期患者治疗12、24个月时)与治疗前比较表现为无显著性差异(P>0.05),可能与病例少检验效能低有关,这与既往研究[19-20]结果相符。扶正抗毒丸在病情相对稳定的ⅡB、Ⅲ期具有增加患者CD4+T淋巴细胞计数的作用,而在病情进展较快的ⅡA期其增加CD4+T淋巴细胞计数的作用则需要在长时间服用(36个月)后才能显现。
综上所述,扶正抗毒丸治疗对减少ⅡA、ⅡB、Ⅲ期AIDS患者临床症状体征、提高生存质量都具有确切作用,能够提高ⅡB、Ⅲ期患者的CD4+T淋巴细胞计数,但对ⅡA期患者CD4+T淋巴细胞计数的增加作用可能在较长时间使用后才能显现。
[1]彭勃,王丹妮.无症状HIV感染期是中医药治疗艾滋病的黄金切入点[J].中国临床康复,2006,10(19):166-167.
[2]刘颖,王健.中医药治疗艾滋病切入点及疗效评价策略探讨[J].中华中医药杂志,2010,25(8):1159-1161.
[3]郭会军,王丹妮,刘学伟,等.中医药治疗艾滋病应重视对无症状HIV感染期的早期干预[J].上海中医药杂志,2006,40(7):17-18.
[4]李勇,王阶,林洪生,等.中医“治未病”思想在艾滋病早期免疫重建中的作用[J].辽宁中医杂志,2010,37(11):2117-2119.
[5]Zhang TL,Jia MH,Luo HB,et al.Study on a HIV/AIDS model with application to Yunnan province,China[J]. Applied Mathematical Modelling,2011,35(9):4379-4392.
[6]Xiao Y,Kristensen S,Sun J,et al.Expansion of HIV/AIDS in China:Lessons from Yunnan Province[J].Soc Sci Med,2007,64(3):665-675.[7]国家技术监督局.GB/T 16751.2-1997中医临床诊疗术语(证候部分)[S].北京:中国标准出版社,1997:1-6.
[8]郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002:361-392.
[9]卫生部传染病标准专业委员会.WS293-2008,艾滋病和艾滋病病毒感染诊断标准[S].北京:中国标准出版社,2008:6-9.
[10]中华医学会感染病学分会艾滋病学组.艾滋病诊疗指南第三版(2015版)[J].中华临床感染病杂志,2015,8(5):385-400.
[11]King JT,Justice AC,Roberts MS,et al.Long-term HIV/ AIDS survival estimation in the highly active antiretroviral therapy era[J].Med Decis Making,2003,23(1):9-20.
[12]Montaner JS,Lima VD,Harrigan PR,et al.Expansion of HAART coverage is associated with sustained decreases in HIV/AIDS morbidity,mortality and HIV transmission:the“HIV Treatment as Prevention”experience in a Canadian setting[J].PLoS One,2014,9(2):e87872.
[13]孙铭泽,王建云,陈继军,等.HIV/AIDS抗病毒治疗效果及不良反应评价[J].浙江预防医学,2016,28(2):129-131.
[14]郭红梅,孙纪新,李张,等.278例HIV/AIDS病例免费抗病毒治疗不良反应[J].江苏预防医学,2015,26(2):58-60.
[15]韩丹,潘建玲,储文功,等.上海市872例抗病毒药物治疗艾滋病患者的不良反应分析[J].中国医院药学杂志,2015,35(22):2038-2041.
[16]李亮平,徐立然,扶伟,等.中医药综合干预对艾滋病病毒感染者/艾滋病患者免疫功能和机会性感染的长期影响[J].中医学报,2016,31(212):1-3.
[17]蒋莲秀,赵海潞,吴丹.艾滋病中医整体观[J].辽宁中医药大学学报,2014,16(1):149-152.
[18]陈秀娟,袁继云.中医治疗艾滋病研究进展[J].实用中医药志,2013,29(1):67-68.
[19]叶润华,段松,项丽芬,等.云南省德宏州无抗病毒治疗史的HIV感染者CD4+T淋巴细胞计数自然变化及其影响因素[J].中华流行病学杂志,2011,32(9):882-887.
[20]华近,林海江,朱萍,等.浙江省台州市未接受抗病毒治疗HIV感染者CD4+T淋巴细胞计数自然变化研究[J].中华疾病控制杂志,2012,16(12):1015-1018.
Efficacy analysis of Fuzheng Kangdu Pills for different stages of patients with HIV/AIDS
LI Qin WANG LiLU Zhongyun
Yunnan Academy of Chinese Medicine,Yunnan Province,Kunming 650223,China
Objective To evaluate the clinical efficacy of Fuzheng Kangdu Pills for different stages of patients with human immunodeficiency virus(HIV)/acquired immune deficiency syndrome(AIDS).Methods A retrospective analysis was conducted for patients receiving pure traditional Chinese medicine treatment of Fuzheng Kangdu Pills for 12,24,36 months at each therapeutic site of traditional Chinese medicine AIDS prevention pilot project of Yunnan Province from June 2005 to October 2014.The total scores of symptoms and signs,Karnovsky scores and CD4+T lymphocyte count changes before and after medication were recorded.Results Total scores of symptoms and signs∶compared with before treatment,the total scores of symptoms and signs of Ⅱ A and Ⅲ patients after treatment for 12,24,36 months were significantly decreased (P<0.01);compared with before treatment,the total scores of symptoms and signs of Ⅱ B patients after treatment for 12,24 months were significantly decreased(P<0.01).Karnovsky scores∶compared with before treatment,the Karnovsky scores of Ⅱ A patients after treatment for 12,24 months were significantly increased(P<0.01);compared with before treatment,the Karnovsky scores of Ⅱ B patients after treatment for 12,24,36 months were significantly increased (P<0.01);compared with before treatment,the Karnovsky scores of Ⅲ patients after treatment for 12 months were significantly increased (P<0.01).CD4+T lymphocyte counts∶compared with before treatment,the CD4+T lymphocyte counts of Ⅱ A patients after treatment for 12,24 months were significantly decreased (P<0.01);compared with before treatment,the CD4+T lymphocyte counts of Ⅱ B patients after treatment for 12,24,36 months were significantly increased(P<0.05);compared with before treatment,the CD4+T lymphocyte counts of Ⅲ patients after treatment for 24 months were significantly increased (P<0.01).Conclusion Fuzheng Kangdu Pills have a certain role in reducing the clinical signs and symptoms and improving the quality of life of AIDS patients at the stages of Ⅱ A,Ⅱ B and Ⅲ,which can improve the CD4+T lymphocyte counts of Ⅱ B and Ⅲ patients to some extent,but the increasing roles of CD4+T lymphocyte count in HIV-infected Ⅱ A patients may be appeard after a long time (36 months) of use.
Fuzheng Kangdu Pills;Different stages;Human immunodeficiency virus;Acquired immune deficiency syndrome;Efficacy
R512.91
A
1673-7210(2016)06(a)-0074-04
2016-02-21本文编辑:张瑜杰)
国家自然科学基金地区科学基金资助项目(81360583)。
李钦(1981.9-),女,硕士,主要从事中医药防治艾滋病临床研究工作。

