糖尿病大鼠的SOD活性与抗氧化剂治疗对机体抗氧化状态的影响
周玉, 王伶俐, 黄杨, 曹明香, 杨昌明
(荆门市第一人民医院麻醉科,湖北 荆门 448200)
糖尿病大鼠的SOD活性与抗氧化剂治疗对机体抗氧化状态的影响
周玉, 王伶俐, 黄杨, 曹明香, 杨昌明*
(荆门市第一人民医院麻醉科,湖北 荆门448200)
目的探究糖尿病大鼠主要脏器SOD活性及蛋白表达水平的变化,并观察抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)短期治疗(4周)后对机体抗氧化状态的影响。方法STZ诱导的糖尿病大鼠(D组,n=8)每天给予NAC1.5g/kg灌胃治疗(D+N组,n=8),正常对照组(C组,n=8)同时给予同体积生理盐水。4周后,获取心、肺、肝、肾组织,试剂盒检测血浆总SOD、总抗氧化物浓度、脂质过氧化特异性标志物15-F2t-isoprostane及各组织总超氧化物歧化酶(superoxidedismutase,SOD)活性,Westernblotting分析SOD亚型Cu/Zn-SOD及Mn-SOD蛋白表达水平。结果与C组相比,D组大鼠血浆15-F2t-isoprostane与总抗氧化物浓度及心肌组织中总SOD活性显著升高,而血浆、肺、肝、肾组织总SOD活性显著降低;心、肺组织中Cu/Zn-SOD蛋白表达水平明显升高,而肝、肾组织中明显降低;肺、肾组织中Mn-SOD蛋白表达水平明显降低,而肝组织明显升高,但心肌组织变化不明显。NAC干预能不同程度逆转上述改变,但进一步降低肾组织Mn-SOD表达。结论糖尿病大鼠各组织中总SOD活性、Cu/Zn-SOD及Mn-SOD蛋白表达水平具有组织差异性,抗氧化剂NAC能不同程度恢复糖尿病大鼠各组织抗氧化水平,从而起到阻止或延缓糖尿病相关的靶器官功能损害的作用。
糖尿病;N-乙酰半胱氨酸;超氧化物歧化酶;大鼠
机体通过精密的信号转导调控,如线粒体能形成一种高氧化环境[1],以满足某种生理需要。糖尿病患者慢性高血糖状态,进行性破坏了这种复杂的调控模式,从而使局部的氧化应激水平激化并进一步扩大,同时可直接对抗氧化防御系统造成损伤,最终引起多种代谢紊乱和靶器官损害(targetorgandamage,TOD)[2]。超氧化物歧化酶(superoxidedismutase,SOD)是机体抗氧化防御系统的重要组成部分,按其亚细胞区域分布的不同,分为胞质Cu/Zn-SOD、线粒体Mn-SOD和胞外SOD三种亚型[3]。细胞内氧化应激的程度密切影响着SOD的表达水平,这种动态改变参与了糖尿病及其相关并发症的进展过程[4, 5]。这提示应用抗氧化剂抑制机体氧化应激水平或许能改变糖尿病及其并发症的转归。然而,临床实验表明应用抗氧化剂如维生素C与维生素E并未有满意的效果[6]。因此,进一步探究亚细胞区域抗氧化防御系统的改变,是深刻认识糖尿病相关的TOD病理生理机制的重要课题,对于优化糖尿病及其并发症防治策略具有指导性意义。本研究旨在观察链脲佐霉素(streptozotozin,STZ)诱导的SD大鼠1型糖尿病模型中主要脏器,包括心脏、肺、肝、肾组织,观察总SOD活性及Cu/Zn-SOD和Mn-SOD蛋白表达的变化,同时探究抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)早期干预的影响。
1 材料与方法
1.1材料
1.1.1分组与模型
8周龄清洁级雄性SD大鼠,由武汉大学动物实验服务中心提供【SCXK(鄂)2014-0004】,共24只, 体重220~250g。所有动物实验符合武汉大学实验动物实验管理条例。实验前适应性喂养7d,整个实验中自由饮食,有创操作前给予戊巴比妥钠(50mg/kg,湖北鸿运隆生物科技有限公司)麻醉。通过计算机产生随机数列后,将大鼠随机分为三组(每组8只):正常组(C)、糖尿病组(D)和糖尿病+NAC治疗组(D+N)。所有大鼠禁食一夜后,采用单次性尾静脉注射STZ(65mg/kg)法诱导1型糖尿病模型。3d后血糖值稳定在高于16.8mmol/L水平表示建模成功。建模1周后,D+N组每天灌胃给予NAC1.5g/kg。建模及干预时,给予C组和D组同体积生理盐水。血糖仪监测血糖每周1次,称重法饮食量每天记录1次。
1.1.2主要试剂与仪器
N-乙酰半胱氨酸与链脲佐菌素(STZ)(美国Sigma公司);15-F2t-isoprostane、总抗氧化物浓度及超氧化物歧化酶活性检测试剂盒(美国Cayman公司);内参GAPDH(1∶2000)、二抗(1∶10 000)(美国CellSignaling公司);一抗Cu/Zn-SOD、一抗Mn-SOD(1∶1000)(美国Millipore公司)。
1.2标本获取与检测
第4周未,抗凝后腹腔大剂量注射戊巴比妥钠处死大鼠,注射器心内取血,获取用心脏、肺、肝、肾组织,并立即置入液氮中。所有样本-80°C妥善贮存。按试剂盒标准操作检测血清15-F2t-isoprostane、SOD与总抗氧化物浓度,及各组织总SOD活性。提取各组织总蛋白,BCA法测量蛋白浓度。50μg上样,Westernblotting分析各组织Cu/Zn-SOD与Mn-SOD蛋白表达情况,按奥德赛(Odyssey)红外扫描仪操作人员手册扫描条带(美国LI-CORBiosciences公司),分析并导出蛋白条带灰度值。
1.3数据处理及统计分析
2 结果
2.1各组大鼠一般情况
本次研究中STZ诱导的大鼠糖尿病模型表现出了典型的1型糖尿病特征,包括高血糖、多饮、多食、多尿以及体重下降(P<0.05)。NAC干预后,糖尿病大鼠仅食物摄取量及饮水量显著性降低,但仍明显高于正常大鼠。见表1。
2.2血浆15-F2t-isoprostane、总抗氧化物浓度及SOD活性
如表2所示,与C组比较,D组大鼠血浆F-2t-isoprostane与总抗氧化物浓度显著增加,而SOD活性显著降低,经NAC治疗4周后,血浆F-2t-isoprostane与总抗氧化物浓度明显降低,但对血浆SOD活性无显著影响。
2.3各组织中总SOD活性水平
C组大鼠的肝、肾组织中总SOD活性几乎是心、肺组织中的3倍。与C组相比,D组大鼠肺、肝、肾组织中总SOD活性明显降低(P<0.05),但心肌组织中明显升高(P<0.05)。与D组相比,D+N组大鼠肺与肝组织中总SOD活性恢复(P<0.05),而在肾与心肌组织中虽然分别有所升高和降低,但变化并不明显。见表3。

表1 各组大鼠大体情况
注:*与C组比较P<0.05,#与D组比较P<0.05。
Note.* P<0.05comparedwiththecontrolgroup,#P<0.05comparedwiththediabeticgroup

表2 血浆15-F2t-isoprostane、总抗氧化物浓度及SOD活性
注:*与C组比较P<0.05#与D组比较P<0.05。
Note.*P<0.05,comparedwiththecontrolgroup,#P<0.05,comparedwiththediabeticgroup.
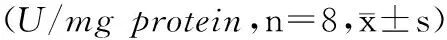
表3 各组大鼠各组织总SOD活性
注:*与C组比较P<0.05#与D组比较P<0.05。
Note.*P<0.05,comparedwiththecontrolgroup,#P<0.05,comparedwiththediabeticgroup.
2.4各组织中Cu/Zn-SOD蛋白表达水平
如图1所示,与C组比较,D组大鼠心脏、肺组织中Cu/Zn-SOD蛋白表达水平显著升高;而肝、肾组织中显著降低。经NAC治疗4周后,D+N组大鼠肝、肾组织中Cu/Zn-SOD蛋白表达量显著增加(P<0.05),心肌组织中显著减少(P<0.05),而肺组织中减少的程度不明显。
2.5各组织中Mn-SOD蛋白表达水平
如图2所示,各组大鼠心肌组织Mn-SOD蛋白表达水平改变不明显。与C组比较,D组大鼠肺、肾组织中Mn-SOD蛋白表达水平明显降低(P<0.05),而肝组织中明显升高(P<0.05)。与D组比较,D+N组大鼠肺组织Mn-SOD蛋白表达水平显著升高(P<0.05),而肝组织中降低不明显,但肾组织中显著降低(P<0.05)。
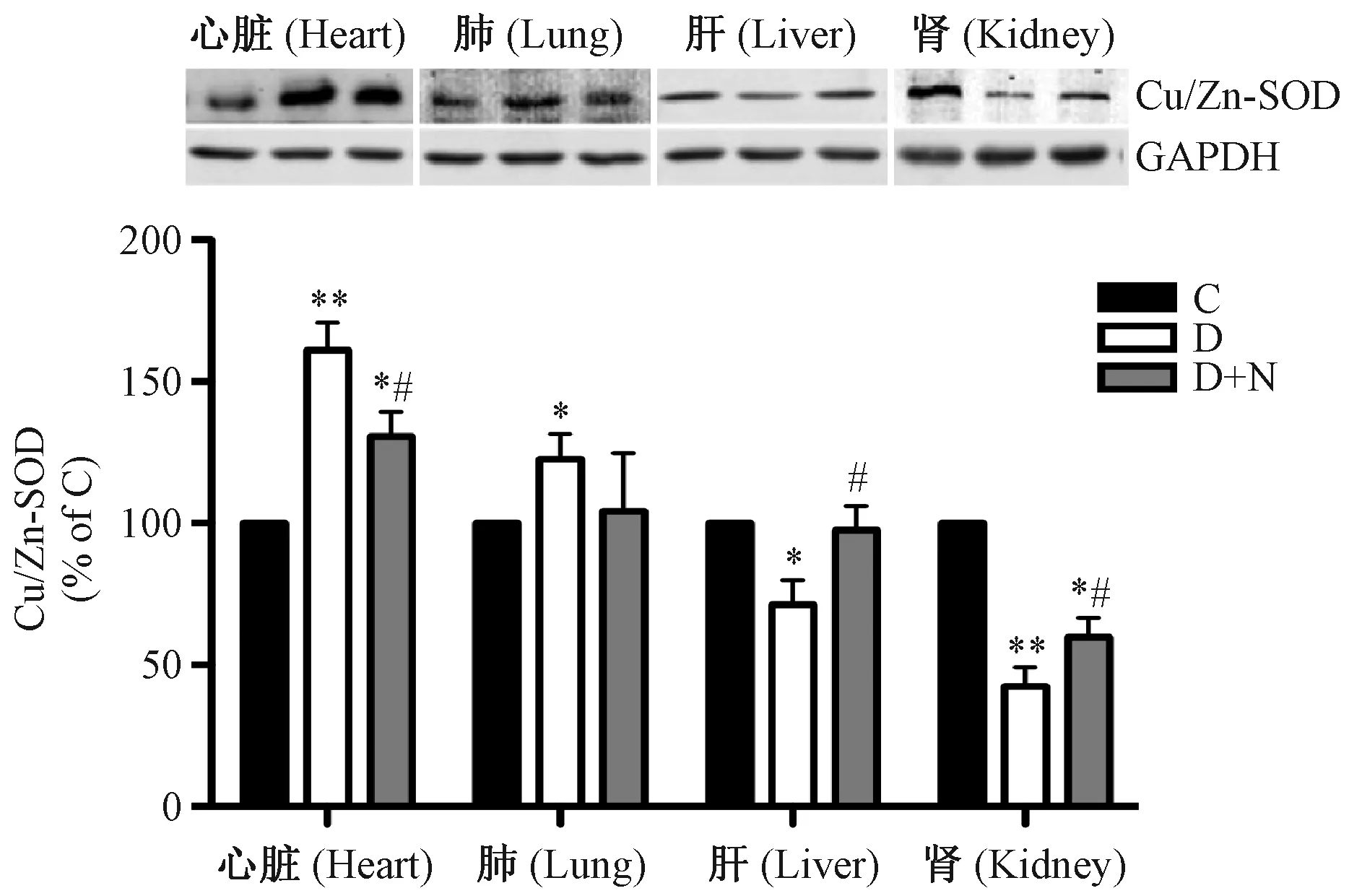
注:*与C组比较P<0.05,**与C组比较P<0.01,#与D 组比较P<0.05。图1 各组大鼠各组织中Cu/Zn-SOD蛋白表达水平的影响Note: * P<0.05 compared with group C, ** P<0.05 compared with group C, # P<0.05 compared with group D.Fig.1 The expression levels of Cu/Zn-SOD protein in various organ tissues of the rats
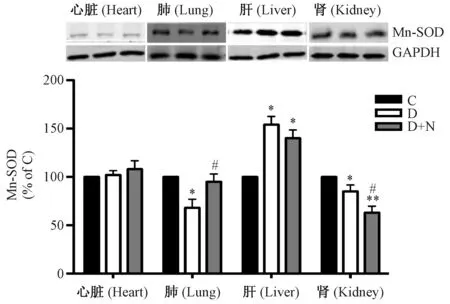
注:*与 C 组比较P<0.05,**与C组比较P<0.01,#与D 组比较P<0.05。图2 各组大鼠各组织中Mn-SOD蛋白表达水平的影响Note. * P<0.05, compared with the control group, ** P<0.01, compared with the control group, # P<0.05, compared with the diabetic group.Fig.2 The expression levels of Mn-SOD protein in various organ tissues of the rats
3 讨论
据国际糖尿病联合会预测,到2035年,全球糖尿病患者将接近6亿。而2014年这一数字已达3.87亿,其中约有5百万人死于糖尿病及其相关并发症。然而,临床上糖尿病相关并发症主要包括糖尿病心脏病和糖尿病肾病[7],而糖尿病相关的肝、肺病变则相对少见。这说明,虽然持续的高糖刺激对机体施加的不良影响是一致的,但不同组织的反应却不一样。糖尿病状态下的这种组织特异性反应,取决于组织自身的抗氧化能力及其对氧化应激的敏感性[8]。我们发现,正常组大鼠肝、肾组织总SOD活性几乎是心脏、肺组织的3倍,而糖尿病状态下肝、肾、肺组织总SOD活性均显著降低,但心肌组织总SOD活性明显升高。这说明糖尿病大鼠肾、肝、肺组织抗氧化能力下降,而心肌组织似乎具有更强的抗氧化损伤代偿能力。这同时也提示,虽然心肌组织具有更强的代偿功能,但其与肾脏组织一样,对氧化应激损伤更为敏感。而肺组织虽然生理状态下总SOD活性相对较低,但其对氧化应激损伤的耐受性更强。这可能是因为肺组织作为呼吸器官,长期处于氧暴露状态,从而产生了一定的适应性[9]。另外,在糖尿病早期使用抗氧化剂NAC治疗,能有效恢复肺与肝组织总SOD活性,而对心脏、肾组织中总SOD无明显影响。可见,NAC的作用也表现出了组织特异性,这与临床应用NAC的研究结果相一致[10,11]。
线粒体活性氧自由基的产生与糖尿病相关并发症的发生发展密切相关[10]。随着糖尿病病情进展,线粒体局部氧化应激不断激化,从而波及到其他亚细胞区域。已有充分的证据显示,持续性高糖刺激引起的ROS蓄积,可直接造成抗氧化防御系统功能受损,这是糖尿病相关并发症发生发展的关键因素[11]。本研究结果显示,在糖尿病状态下,过氧化损伤特异性指标15-F2t-isoprostane显著增加,血浆SOD活性降低,而总抗氧化物浓度显著增加。这提示机体总抗氧化物浓度代偿性增加并不能减少组织氧化损伤。进一步研究发现,心脏、肺组织中Cu/Zn-SOD蛋白表达水平显著升高,而肝肾组织中显著降低;Mn-SOD蛋白表达水平在心肌组织中无明显变化,在肺、肾组织中显著降低,而在肝组织中显著升高。这说明,不同亚细胞区域的抗氧化能力以及对氧化应激的敏感性也存在差异。因此,笼统的抗氧化治疗的效果可能并不确切,糖尿病患者需要更精准的靶向抗氧化治疗。目前,线粒体靶向抗氧化药物已经被设计,并在动物实验中取得了良好效果[12]。
与许多研究[13]一致,我们的实验结果也表明NAC能有效改善糖尿病大鼠症状,但似乎没有降糖作用。这提示,整个实验过程中NAC治疗组大鼠高血糖刺激的不良影响持续存在,NAC可能并不能减少ROS的来源,而是通过其他途径来发挥保护作用。在本实验中,NAC能不同程度恢复糖尿病状态下各组织胞质和线粒体SOD蛋白表达变化,从而恢复组织总SOD活性。但其进一步下调了肾组织Mn-SOD的表达。临床研究也表明,中等剂量的NAC治疗30d后,糖尿病肾病患者氧化应激状态和蛋白尿症状末出现明显改善[14]。
综上所述,生理状态下SD大鼠心脏、肺组织总SOD活性较肝、肾组织弱。在糖尿病状态下,心脏、肾组织对氧化应激更敏感性,而肺组织耐受性更强。在糖尿病早期阶段,使用抗氧化剂NAC进行干预,能不同程度地限制Cu/Zn-SOD与Mn-SOD蛋白表达水平变化,从而恢复各组织总SOD活性,然而NAC进一步下调了糖尿病大鼠肾组织Mn-SOD表达。因此,进一步研究NAC影响不同组织中亚细胞区域抗氧化能力的具体机制,是深入认识糖尿病相关的靶器官损害的新途径。
[1]CumminsTD,HigdonAN,KramerPA,etal.Utilizationoffluorescentprobesforthequantificationandidentificationofsubcellularproteomesandbiologicalprocessesregulatedbylipidperoxidationproducts[J].FreeRadicBiolMed, 2013. 59: 56-68.
[2]ThandavarayanRA,GiridharanVV,SariFR,etal.Depletionof14-3-3proteinexacerbatescardiacoxidativestress,inflammationandremodelingprocessviamodulationofMAPK/NF-kappaBsignalingpathwaysafterstreptozotocin-induceddiabetesmellitus[J].CellPhysiolBiochem, 2011. 28(5): 911-922.
[3]ZelkoIN,MarianiTJ,FolzRJ.Superoxidedismutasemultigenefamily:AcomparisonoftheCu/Zn-SOD(SOD1),Mn-SOD(SOD2),andEC-SOD(SOD3)genestructures,evolution,andexpression[J].FreeRadicalBiolMed, 2002, 33(3): 337-349.
[4]KimJW,ChaeJY,NamSM,etal.Treadmillexercisepreventsdiabetes-inducedincreasesinlipidperoxidationanddecreasesinCu/Zn-superoxidedismutaselevelsinthehippocampusofZuckerdiabeticfattyrats[J].JVetSci, 2015. 16(1):11-16.
[5]KresyunNV,GodlevskiiLS.Superoxidedismutaseandcatalaseactivitiesintheretinaduringexperimentaldiabetesandelectricstimulationofthepaleocerebellarcortex[J].BullEepBiolMed, 2014. 158(2): 206-208.
[6]HasnainBI,MooradianAD.Recenttrialsofantioxidanttherapy:whatshouldwebetellingourpatients? [J].CleveClinJMed, 2014. 71: 327-334.
[7]CorriereM,RooparinesinghN,KalyaniRR,etal.Epidemiologyofdiabetesanddiabetescomplicationsintheelderly:anemergingpublichealthburden[J].CurrDiabRep, 2013. 13(6): 805-813.
[8]FabbriniE,SerafiniM,BaricIC,etal.Diabetes.Effectofplasmauricacidonantioxidantcapacity,oxidativestress,andinsulinsensitivityinobesesubjects[J].Diabetes, 2014. 63(3): 976-981.
[9]AgarwalAR,YinF,CadenasE.Metabolicshiftinlungalveolarcellmitochondriafollowingacroleinexposure[J].AmJPhysiolLungCellMolPhysiol, 2013. 305(10):L764-773.
[10]YesilbursaD,SerdarA,SenturkT,etal.EffectofN-acetylcysteineonoxidativestressandventricularfunctioninpatientswithmyocardialinfarction[J].HeartVessels, 2006. 21(1): 33-37.
[11]SaklayenMG,YapJ,VallyathanV.Effectofmonth-longtreatmentwithoralN-acetylcysteineontheoxidativestressandproteinuriainpatientswithdiabeticnephropathy:apilotstudy[J].JInvestigMed, 2010. 58(1): 28-31.
[12]TowlerDA.MitochondrialROSdeficiencyanddiabeticcomplications:AMP[K]-lifyingtheadaptationtohyperglycemia[J].JClinInvest,2013. 123(11): 4573-4576.
[13]GokturkH,UlusuNN,GokM,etal.Long-termtreatmentwithabeta-blockertimololattenuatesrenal-damageindiabeticratsviaenhancingkidneyantioxidant-defensesystem[J].MolCellBiochem, 2014. 395(1-2): 177-186.
[14]HuangW,CashN,WenL,etal.Effectsofthemitochondria-targetedantioxidantmitoquinoneinmurineacutepancreatitis[J].MediatorsInflam, 2015. 2015: 901780.
[15]XuJ,LeiS,LiuY,et.al.AntioxidantN-acetylcysteineattenuatesthereductionofBrg1proteinexpressioninthemyocardiumoftype1diabeticrats[J].JDiabetesRes, 2013. 2013: 1-8.
Effect of anti-oxidant treatment on the expression andactivityofSODindiabeticrats
ZHOUYu,WANGLing-li,HUANGYang,CAOMing-xiang,YANGChang-ming*
(DepartmentofAnesthesiology,theFirstPeople’sHospitalofJingmen,Hubei448200,China)
ObjectiveTostudythechangesoftotalSODactivityandexpressioninmajororgansandobservetheeffectsofantioxidantN-acetylcysteine(NAC)onantioxidantstatusindiabeticrats.MethodsNormalrats(groupC, n =8)orstreptozotocin(STZ)-induceddiabeticrats(groupD, n =8)weretreatedwithNAC1.5g/kg/d(GroupD+N, n =8)orequalvolumeofnormalsalineoncedailybygastricgavagefor4weeks.Bloodsampleswerecollectedandthe15-F2t-isoprostane,totalantioxidantconcentrationandSODactivitywereassayed.Theheart,lung,liverandkidneytissueswerecollectedforassayofthetotalSODactivityusingakitandtheproteinexpressionofSODisoforms,includingCu/Zn-SODandMn-SOD,wasdeterminedbywesternblot.ResultsThelevelsof15-F2t-isoprostaneandtotalantioxidantconcentrationinplasma,totalSODactivityintheheart,proteinexpressionofCu/Zn-SODintheheartandlung,andMn-SODexpressionintheliverweresignificantlyincreased(P diabetesmellitus;N-acetylcysteine;Superoxidedismutase,SOD;Rats YANGChang-ming.E-mail:pyb1980@mail.scuec.edu.cn 湖北省自然科学基金项目(编号:2014CFC1028);荆门市科技计划重点项目。 周玉(1976- ),女,硕士研究生,研究方向:麻醉药理。 杨昌明(1972-),男,主任医师,研究方向:麻醉药理。Email:hbjmyangcm@126.com 研究报告 Q95-33 A 1005-4847(2016)04-0422-05 10.3969/j.issn.1005-4847.2016.04.016 2015-12-08

