基因敲入小鼠甲亢性低钾型周期性麻痹模型的评价
智红叶,徐宏燕,陈瑛瑛,陈亚宁,周丽君,战大伟,颜克松,姚合斌,*
(1.安徽医科大学海军临床学院,北京 100048;2.中国人民解放军海军总医院 内分泌科,北京100048;3. 中国人民解放军海军总医院海战伤基础研究中心,北京 100048;4.中国人民解放军总医院第一附属医院实验动物科,北京 100048)
基因敲入小鼠甲亢性低钾型周期性麻痹模型的评价
智红叶1,徐宏燕1,陈瑛瑛2,陈亚宁2,周丽君3,战大伟4,颜克松4,姚合斌1,2*
(1.安徽医科大学海军临床学院,北京100048;2.中国人民解放军海军总医院内分泌科,北京100048;3. 中国人民解放军海军总医院海战伤基础研究中心,北京100048;4.中国人民解放军总医院第一附属医院实验动物科,北京100048)
目的用基因敲入CaV1.1-R528H小鼠建立甲亢性低钾型周期性麻痹模型并对其进行评价。 方法 8周龄基因敲入CaV1.1-R528H雄性小鼠及8周龄野生型C57BL/6J雄性小鼠各36只,采用三因素两水平2×2×2析因设计方法按体重随机原则(三因素分别为突变、甲状腺素及胰岛素因素,两水平为有或无)分为8组。其中有甲状腺素处理组的小鼠制备高甲状腺素毒症,按350μg/kg体重连续腹腔注射左旋甲状腺素钠12d,末次给药后有胰岛素处理组按0.8U/kg体重给予腹腔注射短效胰岛素,分别检测并记录各组小鼠注射前(0min)及注射后(30、60min)的血钾。 结果(1)制备高甲状腺素毒症的小鼠出现烦躁不安、易激怒及毛色枯燥现象,相比对照组,饮食及饮水量明显增多,而体重增加缓慢。甲状腺功能检测显示T3、T4明显高于相应对照组,TSH明显低于相应对照组,且差异均有显著性(P<0.05)。(2)单独给予甲状腺素或胰岛素处理,突变组与野生组血钾同时间点比较并没有统计学差异,而在高甲状腺素毒症下给予胰岛素处理后,突变组与野生组同时间点(30、60min)比较突变组血钾显著低于野生组(P<0.05)。(3)主效应及交互作用:单独突变因素或甲状腺素因素对血钾并没有作用,仅有胰岛素对降低血钾有作用(P<0.05);甲状腺素因素和突变因素之间以及胰岛素因素和突变因素之间均有交互作用(P<0.05);甲状腺素因素和胰岛素因素之间没有交互作用。 结论 (1)高甲状腺素毒症制备成功。(2)利用基因敲入CaV1.1-R528H小鼠成功的建立了甲亢性低钾型周期性麻痹模型。
甲亢性低钾型周期性麻痹;基因敲入;CaV1.1-R528H小鼠;高甲状腺素毒症;胰岛素
甲亢性低钾型周期性麻痹(thyrotoxichypokalemicperiodicparalysis,简称THPP)是一种在遗传缺陷基础上,由于甲状腺素毒症及其他诱因激发的与细胞内外钾离子跨膜转移异常相关的疾病,主要表现为甲状腺毒症、低钾血症及发作性肌无力[1]。该病发病年龄多在20~40岁,多见于男性,是我国低钾型周期性麻痹的主要类型。发病前通常伴有明显的诱因,如高碳水化合物的饮食、大量葡萄糖的输入等,这些诱因均可导致体内胰岛素水平的增多,诱发该病的发作。目前该病的发病机制仍不是十分清楚,有研究显示THPP存在相关离子通道的突变,如编码钾通道辅助亚单位、编码钠通道α亚单位以及内向整流钾通道的突变,但除个别报道外,数量极少,阳性率不足1%[2-5],但也说明THPP是有离子通道病的特点。因此,已发现的低钾型周期性麻痹相关突变可以作为甲亢性低钾型周期性麻痹发病机制研究的借鉴与补充,利用课题组前期构建的钙离子通道缺陷型基因敲入CaV1.1-R528H小鼠模型[6]进一步建立甲亢性低钾型周期性麻痹模型。目前认为甲亢性低钾型周期性麻痹的发病因素包括本身存在相关离子通道突变、高甲状腺素毒症、导致体内胰岛素增多的诱因以及雄性激素,因此本实验应用已构建的钙通道缺陷型基因敲入CaV1.1-R528H雄性小鼠,通过给予外源性左旋甲状腺素钠处理来制备小鼠高甲状腺素毒症,并在高甲状腺素毒症基础上给予注射外源性胰岛素,模拟人类甲亢性低钾型周期性麻痹发病时的特点,建立甲亢性低钾型周期性麻痹动物模型。
1 材料与方法
1.1主要仪器及试剂
1.1.1仪器
日本京都干式电解质分析仪(型号:SE-1520),购自日本京都有限公司,采用日本原装配套试剂干片及参比液,每次实验前使用磁卡对其进行校对;PCR仪(型号:德国AG22331Hamburg);DNA测序仪(型号:美国ABI公司Prism377);贝克曼DXC800全自动生化分析仪,美国贝克曼库尔特公司;西门子CentaurCP全自动化学发光分析仪,德国西门子公司;电子天平(型号:YP/0001),购自上海越平科学仪器有限公司;胰岛素一次性使用无菌注射器,美国BD公司;一次性注射器(1、5、20mL),购自深圳市保安医疗用品有限公司。
1.1.2试剂
左旋甲状腺素钠,阿拉丁(货号:T113354);T3、T4及TSH测定试剂盒,西门子医学诊断产品有限公司;短效胰岛素(10mL: 400U),购自江苏万邦生化医药股份有限公司;Tap酶、dNTP,购自大连宝生物工程有限公司;DNAladdermarker,购自深圳晶美生物技术有限公司;PCR引物,上海英俊生物技术有限公司和上海生物工程有限公司合成;0.9%生理盐水,购自天津天安药业股份有限公司。
1.2实验动物及实验环境
8周龄SPF级野生型C57BL/6J雄性小鼠36只,体重为21~23g,购自北京斯贝福实验动物科技有限公司【SCXK(京)2011-0004】;8周龄SPF级基因敲入CaV1.1-R528H雄性小鼠36只,体重为21~23g,由本课题组在中国人民解放军总医院第一附属医院(304医院)动物实验室传代所得,原代小鼠由本课题组和上海南方模式生物研究中心共同研制【SCXK( 沪)2009-0023】。所有小鼠均饲养于中国人民解放军总医院第一附属医院(304医院)屏障环境动物房【SYXK(军)2012-2014】,实验室温度控制在20~26℃,湿度40%~70%,每周换两次垫料,添加食物和水。所有小鼠按实验动物使用的3R原则给予人道的关怀,购买的野生型C57BL/6J小鼠在适应性饲养一周后开始正式实验。
1.3基因敲入CaV1.1-R528H小鼠的鉴定及其生化指标检测
实验所使用的基因敲入CaV1.1-R528H小鼠为传代小鼠,在传代中突变基因是否会发生丢失,对其进行了鉴定。基因敲入CaV1.1-R528H小鼠是以野生型C57BL/6J小鼠为背景构建的,因此选取野生型C57BL/6J小鼠作为参考对照小鼠,该小鼠与突变小鼠生化指标是否存在差异,对二者的生化指标进行检测并比较。
1.3.1基因敲入CaV1.1-R528H小鼠的鉴定
实验前随机抽取8只基因敲入CaV1.1-R528H小鼠,提取鼠尾基因组DNA进行PCR鉴定,并在8只小鼠基因组DNA的PCR产物中随机选取5只进行DNA测序。
1.3.2基因敲入CaV1.1-R528H小鼠与野生型C57BL/6J小鼠生化指标比较
实验前取8周龄基因敲入CaV1.1-R528H小鼠雌雄各8只以及8周龄野生型C57BL/6J小鼠雌雄各8只,所有小鼠于当日20:00开始禁食、禁水,次日早晨8:00摘取眼球取血于EP管中送检,检测指标包括葡萄糖(GLU)、丙氨酸氨基转氨酶(ALT)、天门冬氨酸氨基转氨酶(AST)、肌酸激酶 (CK)、血肌酐(Cr)、电解质(Na+、K+、Cl-) 8项指标。
1.4实验设计及实验方法
1.4.1实验设计
实验采用三因素两水平2×2×2析因设计方法,三因素分别为突变、甲状腺素及胰岛素因素,两个水平为有或无。
1.4.2动物分组
取8周龄基因敲入CaV1.1-R528H雄性小鼠及8周龄野生型C57BL/6J雄性小鼠各36只,采用三因素两水平2×2×2析因设计方法按体重随机原则分为野生+盐水组、突变+盐水组、野生+盐水+胰岛素组、突变+盐水+胰岛素组、野生+甲状腺素+盐水组、突变+甲状腺素+盐水组、野生+甲状腺素+胰岛素组及突变+甲状腺素+胰岛素组8组,其中有甲状腺素处理组每组8只,其他组每组10只。
1.4.3高甲状腺素毒症制备及给药方法
有甲状腺素处理组的小鼠每日腹腔注射左旋甲状腺素钠(按350μg/kg),左旋甲状腺素钠用生理盐水配制成浓度为35μg/mL的溶液,按0.1mL/10g体重的量腹腔注射,连续注射12d[7]。同时其余组小鼠给予0.9%生理盐水作为对照,按0.1mL/10g体重的量腹腔注射。实验期间观察小鼠外观行为,测量并记录小鼠体重。最后一次给药后有胰岛素处理组的小鼠给予腹腔注射短效胰岛素(0.8U/kg),胰岛素用0.9%生理盐水稀释配置成0.1U/mL,按0.1mL/10g体重的量腹腔注射,同时其余组以注射相同体积的0.9%生理盐水作为对照。
1.4.4血钾及甲状腺功能测定
小鼠断尾取血,采取让血液自由滴入的方式,取血约25μL即可,避免用手挤压鼠尾,防止红细胞破裂影响血钾,取血后立即用干式电解质分析仪进行血钾测定,分别在胰岛素或生理盐水注射前(0min)及注射后(30、60min)测定并记录血钾。测完血钾后,野生+盐水组、突变+盐水组、野生+甲状腺素+盐水组及突变+甲状腺素+盐水组小鼠于当日20:00开始禁食不禁水12h后,次日早晨摘取眼球取血于EP管并送检实验室,检测血清T3、T4及TSH。
1.5统计学处理
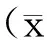
2 结果
2.1基因敲入CaV1.1-R528H小鼠鉴定结果及其生化指标检测结果
2.1.1基因敲入CaV1.1-R528H小鼠鉴定结果
PCR结果显示8只小鼠的基因组DNA扩增片段长度为870bp,为纯合子基因敲入CaV1.1-R528H小鼠,而对照的野生型小鼠DNA扩增片段长度为748bp。DNA测序结果证实5只小鼠为携带CaV1.1基因G→A突变的小鼠,并与野生型小鼠进行对比。
2.1.2基因敲入CaV1.1-R528H小鼠与野生型C57BL/6J小鼠生化指标比较结果
基因敲入CaV1.1-R528H小鼠与野生型C57BL/6J小鼠同性别之间比较,结果差异无显著性(P>0.05);基因敲入CaV1.1-R528H小鼠雌、雄之间比较及野生型C57BL/6J小鼠雌、雄之间比较,结果差异均无显著性(P>0.05)(表1)。
2.2高甲状腺素毒症鉴定结果
实验过程中观察到注射甲状腺素组在注射左旋甲状腺素钠一周后,出现烦躁不安、易激怒及毛色枯燥现象。相比对照组,饮食及饮水量明显增多,而体重增加缓慢。对照组小鼠精神状况、活动情况及毛色光泽均未见明显异常。甲状腺功能T3、T4及TSH检测结果显示,基因敲入CaV1.1-R528H小鼠与野生型C57BL/6J小鼠之间差异无显著性,而注射甲状腺素组小鼠T3、T4均明显高于相应对照组,TSH明显低于相应对照组,且差异有显著性(P<0.05)(表2)。
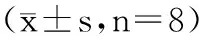
表1 生化指标比较
注:与野生型同性别组比*P>0.05; 与同型雌性组比△P>0.05。
Note.*P>0.05,comparedwiththesamegenderofwildtypegroup;△P>0.05,comparedwiththefemalemiceofthesametypegroup.

表2 T3、T4及TSH指标比较
注:与突变对照组比*P<0.05; 与野生对照组比△P<0.05。
Note:*P<0.05comparedwiththemutantcontrolgroup;△P<0.05comparedwiththewildcontrolgroup.
2.3突变、甲状腺素及胰岛素因素对血钾的作用
2.3.1血钾的变化(表3)
(1)胰岛素对血钾的影响
胰岛素处理后,与基线值(0min)相比,野生+盐水+胰岛素组、突变+盐水+胰岛素组、野生+甲状腺素+胰岛素组、突变+甲状腺素+胰岛素组在处理后30min或60min血钾均有下降趋势,除野生+甲状腺素+胰岛素组外其他处理组均有统计学差异(P<0.05)。盐水处理后,野生小鼠血钾水平有下降趋势,但野生+盐水组与突变+盐水组之间同时间点相比并无统计学差异;突变+甲状腺素+盐水组也观察到血钾下降趋势;其他盐水处理组血钾均无明显变化。
(2)突变对血钾的影响
给予盐水处理后,突变+盐水组与野生+盐水组两组之间血钾同时间点比较并没有统计学上差异;给予胰岛素处理后,即突变+盐水+胰岛素组与野生+盐水+胰岛素组两组之间血钾同时间点比较也并没有统计学上差异;给予甲状腺素处理制备成高甲状腺素毒症后,即突变+甲状腺素+盐水组与野生+甲状腺素+盐水组两组之间血钾同时间点比较也并没有统计学上差异;但在高甲状腺素毒症下给予胰岛素处理后,即高甲状腺素与高胰岛素联合作用下,突变+甲状腺素+胰岛素组与野生+甲状腺素+胰岛素组相比突变组血钾在30min或60min时显著低于野生组,差异有显著性(P<0.05)。
2.3.2主效应及交互作用
析因设计重复测量方差分析结果显示,单独突变因素或甲状腺素因素对血钾并没有作用,仅有胰岛素对降低血钾有影响,且差异有显著性(P<0.05);甲状腺素和突变因素之间以及胰岛素和突变因素之间均有交互作用,差异有显著性(P<0.05),比较边际均值提示有协同作用;甲状腺素和胰岛素之间无交互作用。

表3 不同处理组小鼠血钾变化情况
注:与基线值(0min)比*P< 0.05; 与野生相同处理组比△P<0.05。
Note.*P<0.05,comparedwiththebaselinevalue;△P<0.05,comparedwiththesametreatmentgroupofwildtypemice.
3 讨论
甲亢性低钾型周期性麻痹是我国低钾型周期性麻痹的主要发病类型,但目前我国对于THPP研究甚少,鉴于人体试验伦理原则的限制,建立甲亢性低钾型周期性麻痹动物模型用来研究THPP致病过程及发病机制显得尤为重要,因此利用前期课题组构建的基因敲入CaV1.1-R528H小鼠进一步建立了甲亢性低钾型周期性麻痹动物模型。
实验中使用的基因敲入CaV1.1-R528H小鼠为传代小鼠,传代小鼠是否还携带突变基因,对其进行了鉴定,结果证实该突变基因在传代中不会发生丢失,能够稳定的遗传到子代小鼠中。实验前对基因敲入CaV1.1-R528H小鼠与野生型C57BL/6J小鼠的生化指标进行了比较,结果显示它们之间生化指标并无差异,可以用C57BL/6J小鼠作为本实验的参考对照。本实验需要多次取血,每次取血后需小鼠存活且状态良好,而眼球和心脏取血容易使小鼠致死,因此只能通过鼠尾取血,而鼠尾取血量少,用传统湿化学法测定其电解质不易实现。选取干化学法测定电解质,需血量少(约25μL),可以满足该实验需求。实验前课题组设计了相关实验,对干化学法可以替代湿化学法测定小鼠血电解质进行了验证[10]。
甲亢性低钾型周期性麻痹的发病特点是在本身遗传缺陷基础上由于高甲状腺素毒症和其他诱因如胰岛素增多的联合作用下,导致了疾病的发作。目前发现THPP存在钾离子通道相关的突变,虽然还并未发现钙离子通道存在突变,但该病确实有离子通道疾病的特点,因此利用前期课题组构建的基因敲入CaV1.1-R528H小鼠,模拟人类甲亢性周期性麻痹发病特点,建立甲亢性低钾型周期性麻痹动物模型。首先,通过连续给予小鼠注射外源性左旋甲状腺素钠模拟人类高甲状腺素毒症,小鼠在注射左旋甲状腺素钠一周后,出现烦躁不安、易激怒及毛色枯燥现象,以及相比对照组体重增加缓慢,饮食及饮水量明显增多。T3、T4及TSH检测结果显示,注射甲状腺素组小鼠T3、T4均明显高于相应对照组,TSH明显低于相应对照组,成功的制备了小鼠高甲状腺素毒症。然后,在小鼠高甲状腺素毒症下给予胰岛素处理,以生理盐水作为对照,给予盐水处理后,突变组和野生组小鼠之间血钾同时间点比较并没有统计学上差异,给予单独胰岛素或高甲状腺素毒症处理后,两组小鼠之间血钾同时间点比较也并没有统计学差异,但在小鼠高甲状腺素毒症下,再联合给予胰岛素处理时,两组血钾在同时间点(30、60min)相比突变组显著低于野生组,说明小鼠突变因素在高甲状腺素毒症和高胰岛素血症联合作用下对血钾有影响。且突变组小鼠血钾相比基线值(0min)在30min或60min均明显下降,60min时下降更明显,下降幅度约为20%。人类正常平均血钾为4.2mmol/L,当血钾低于3.5mmol/L时,即血钾下降幅度约为17%时为低钾血症,与人类参考指标相比小鼠血钾下降的幅度达到了低钾血症[11]。实验结果也显示突变和甲状腺素因素之间以及突变和胰岛素因素之间具有交互作用,即它们相互联合在一起时对血钾有影响,但突变因素或甲状腺素因素单独对血钾并没有作用,与人类甲亢性低钾型周期性麻痹的发病特点相符,说明运用基因敲入CaV1.1-R528H小鼠成功的建立了甲亢性低钾型周期性麻痹模型。
综上所述,本研究首次运用基因敲入CaV1.1-R528H小鼠成功的建立了甲亢性低钾型周期性麻痹的动物模型,且首次在整体动物水平下诱发小鼠出现血钾水平降低。以往对低钾型周期性麻痹小鼠模型的研究中,多数是建立在细胞或组织水平,并且是在外源低钾环境中观察模型小鼠肌肉电生理特征变化,并没有诱导出现自发性血钾水平降低。但在本次实验研究中,野生型小鼠和高甲状腺素毒症突变小鼠在注射生理盐水时,也有血钾的下降,考虑可能与小鼠断尾取血时应激产生的高肾上腺素有关,有待以后进一步给予麻醉处理后再进行实验。并且由于疾病特点以及实验小鼠数量有限,我们仅观察到小鼠低钾血症的表现,并未观察到甲亢性低钾型周期性麻痹其他典型表现,如四肢瘫痪,有待以后进一步实验观察。
[1]VijayakumarA,AshwathG,ThimmappaD.Thyrotoxicperiodicparalysis:clinicalchallenges[J].JThyroidRes, 2014, 2014: 649502.
[2]DiasDaSilvaMR,CeruttiJM,ArnaldiLA,etal.AmutationintheKCNE3potassiumchannelgeneisassociatedwithsusceptibilitytothyrotoxichypokalemicperiodicparalysis[J].JClinEndocrinolMetab, 2002, 87(11): 4881-4884.
[3]SilvaMR,ChiamoleraMI,KasamtsuTS,etal.Thyrotoxichypokalemicperiodicparalysis,anendocrineemergency:clinicalandgeneticfeaturesin25patients[J].ArqBrasEndocrinolMetabol, 2004, 48(1): 196-215.
[4]WangXY,RenBW,YongZH,etal.MutationanalysisofCACNA1SandSCN4Ainpatientswithhypokalemicperiodicparalysis[J].MolMedRep, 2015, 12(4): 6267-6274.
[5]RyanDP,daSilvaMR,SoongTW,etal.MutationsinpotassiumchannelKir2.6causesusceptibilitytothyrotoxichypokalemicperiodicparalysis[J].Cell, 2010, 140(1): 88-98.
[6]雍曾花,徐宏燕,姚合斌,等.低钾型周期性麻痹相关的Cchl1a3基因R528H敲入小鼠模型的构建 [J]. 中国比较医学杂志, 2014, 24(7): 7-13.
[7]李欣, 陈长勋, 郭娟. 知母总皂苷对甲亢模型小鼠影响的实验研究 [J]. 中华中医药学刊, 2012, 30(7): 1581-1583.
[8]柳伟伟, 贺佳陈, 舜杰. 析因设计重复测量资料的统计分析及SAS程序实例 [J]. 中国卫生统计, 2007, 24(2): 146-148.
[9]李新,范颖.析因设计重复测量资料的统计分析及SPSS实现 [J]. 数理医药学杂志. 2013, 26(4): 400-402.
[10]徐宏燕, 智红叶, 陈瑛瑛, 等. 干化学法测定小鼠尾血电解质的可行性研究 [J]. 中国畜牧兽医, 2015, 42(6): 1485-1489.
[11]GuytonAC,HallJE.TextbookofMedicalPhysiology[M].Beijing:PekingUniversityMedicalPress, 2007: 294.
Evaluation of the CaV1.1-R528H gene knock-in mouse model ofthyrotoxichypokalemicperiodicparalysis
ZHIHong-ye1,XUHong-yan1,CHENYing-ying2,CHENYa-ning2,ZHOULi-jun3,ZHANDa-wei4,YANKe-song4,YAOHe-bin1,2*
(1.NavalClinicalCollegeofAnhuiMedicalUniversity,Beijing100048,China; 2.DepartmentofEndocrinology,NavyGeneralHospitalofChinesePeople′sLiberationArmy,Beijing100048; 3.CenterofNavalBattleWoundBasicMedicalSciences,NavyGeneralHospitalofChinesePeople’sLiberationArmy,Beijing100048;4.DepartmentofLaboratoryAnimals, 304HospitalofChinesePeople’sLiberationArmy,Beijing100048)
ObjectiveToestablishandevaluatetheCaV1.1-R528Hgeneknock-inmousemodelofthyrotoxichypokalemicperiodicparalysis.MethodsThirty-six8-week-oldmaleCaV1.1-R528Hgeneknock-inmiceandthirty-six8-week-oldwild-typemaleC57BL/6Jmicewereusedinthisstudy.Usingthree-factortwo-level2 × 2 × 2factorialdesign(thethreefactorsincludingmutation,thyroxineandinsulin,andtwolevelswerewithorwithout),themiceweredividedinto8groups.Thethyroxinegroupswereintraperitoneallyinjectedwithlevothyroxineinadoseof350μg/kgonceperdayfor12consecutivedaystoproducethyrotoxicosis.Theinsulingroupswereintraperitoneallyinjectedwithshort-actinginsulininadoseof0.8U/kgafterthelastadministrationoflevothyroxine,andthepotassiumlevelsofdifferentgroupsweremeasuredandrecordedbefore(0min)andafterinsulininjection(30min, 60min).Results(1)Comparedwiththecontrolgroup,thefollowingphenomenaincludingirritability,dullcoat,increaseddietandwaterintake,andslowbodyweightgain,wereobservedinthethyrotoxicmice.ThyroidfunctiontestsshowedthatthelevelsofT3andT4inthethyrotoxicmiceweresignificantlyhigherthanthoseinthecorrespondingcontrolmice(P<0.05),andtheTSHlevelwassignificantlylowerthanthatofthecorrespondingcontrolmice(P<0.05 ). (2)Afteradministrationofinsulinorthyroxinealone,thepotassiumlevelsinthemutantandwild-typemicewerenotsignificantlydifferent.However,aftercombinedadministrationofthyroxineandinsulin,thepotassiumlevelsinthemutantgroupweresignificantlylowerthanthoseinthewild-typemiceat30minand60min( P<0.05forboth). (3)Themaineffectsandinteractions:Mutationfactororthyroxinefactoralonedidnotinfluenceonthepotassiumlevel,onlyinsulinshowedhypokalemiceffect(P<0.05).Therewereinteractionsbetweenthyroxineandmutation,andbetweeninsulinandmutation(P<0.05),butnointeractionbetweenthyroxineandinsulin.Conclusions(1)Athyrotoxicosisstateinmiceissuccessfullydevelopedinthisstudy. (2)AnCaV1.1-R528Hgeneknock-inmousemodelofthyrotoxichypokalemicperiodicparalysisissuccessfullyestablished.
Thyrotoxichypokalemicperiodicparalysis;Geneknock-in;CaV1.1-R528Hmice;Thyrotoxicosis;Insulin
YAOHe-bin,Email:yhb196321@163.com
国家自然科学基金资助项目(编号:30671006;81170800);北京市自然科学基金(编号:7154240)。
智红叶(1983-),女,硕士生,内分泌与代谢病专业。E-mail:hongye111124@126.com
姚合斌(1963-),男,博士,硕士生导师,主任医师,研究方向:内分泌与代谢病。E-mail:yhb196321@163.com
研究报告
Q95-33
A
1005-4847(2016)04-0369-06
10.3969/j.issn.1005-4847.2016.04.007
2016-04-15

