超声弹性成像技术联合BI-RADS分级对乳腺微小病灶的诊断价值
周艳英 李丽 杜峰
超声弹性成像技术联合BI-RADS分级对乳腺微小病灶的诊断价值
周艳英 李丽 杜峰
目的 探讨超声弹性成像(UE)技术联合乳腺超声影像报告与数据系统(BI-RADS)分级对乳腺微小病灶的临床诊断价值。 方法 收集2014年1月至2015年3月期间因外科触及乳腺肿块拟行手术切除术的女性患者68例,共132个乳腺微小病灶的BI-RADS分级资料以及UE资料进行回顾性分析,并与病理结果作对比研究。结果 良性乳腺微小病灶BI-RADS分级值、超声弹性评分值以及应变率比值均明显低于恶性乳腺微小病灶(P<0.05);BI-RADS分级+UE联合诊断恶性乳腺微小病灶的敏感度为96.30%、特异度为96.15%、准确度为96.21%,均分别高于单独BI-RADS分级或单独UE(P<0.05)。结论 UE联合BI-RA DS分级对乳腺微小病灶的良恶性质鉴别具有较高的临床应用价值。
超声 弹性成像 BI-RADS分级 乳腺 微小
乳腺癌是在女性群体中最常见的恶性肿瘤之一,其恶性程度极高,病死率居于首位,严重威胁着全球女性的生命健康[1]。对乳腺癌的防治关键在于早发现、早治疗。目前临床上对最长直径≤1cm的微小乳腺癌的早期定性诊断仍较困难。本文旨在探讨UE联合乳腺超声影像报告与数据系统(BI-RADS)分级对乳腺微小病灶进行鉴别诊断的临床价值。
1 临床资料
1.1 一般资料 收集2014年1月至2015年3月期间,因外科触及乳腺肿块拟行手术切除术的女性患者68例(132个乳腺微小病灶);年龄23~67岁,平均年龄(48.34±11.67)岁。病灶最长径线为0.3~1.0 cm,平均最长径线为(0.62±0.23)cm。所有观察对象于术前1周内均曾接受常规二维超声检查以及UE检查,所有乳腺微小病灶均于手术切除术后行病理确诊。
1.2 仪器与方法 (1)超声诊断仪:采用Siemens公司生产的S2000 型号超声诊断仪,采用超声线阵探头,探头频率5.5~18MHz,超声诊断仪配有UE系统。(2)超声检查方法:患者取仰卧位,并脱去衣饰使乳房及腋窝暴露。超声检查时应以乳头作为扫查中心,向乳腺边缘呈辐射状连续反复扫查。发现乳腺病灶时,观察并记录其所在位置、最大超声图像切面时的大小、形态特征、边界是否清楚、内部结构特点以及回声分布情况、是否存在钙化、钙化大小和分布情况、后方有无声衰减、内部以及周边血供情况等超声影像学改变,并对乳腺病灶进行BI-RADS分级值评价。启动UE系统,医师对超声探头进行适当加压及松压,并以实时双幅模式同时显示乳腺组织的超声灰阶图像以及超声弹性图像,获得理想满意的超声弹性图像后,测量病灶的应变率及其周边且深度一致的正常乳腺组织的应变率,并计算病灶的应变率比值(应变率比值=乳腺病灶周边且深度一致的正常乳腺组织的应变率除以乳腺病灶的应变率[2])以及超声弹性评分值。
1.3 BI-RADS分级标准[3]0级:只有临床症状,但是资料不全,超声检查乳腺内未见异常病灶,需作其它辅助检查。Ⅰ级:超声检查乳腺内未见异常病灶。Ⅱ级:超声检查乳腺内可见异常病灶,超声影像学改变符合良性病灶。Ⅲ级:超声检查乳腺内可见异常病灶,超声影像学改变主要考虑良性病灶,恶性的可能性<2%,需要短期随访。Ⅳ级:超声检查乳腺内可见异常病灶,超声影像学改变为可疑恶性病灶,恶性的可能性范围为3%~94%,需要穿刺活组织病理检查。Ⅴ级:超声检查乳腺内可见异常病灶,超声影像学改变主要考虑恶性病灶,恶性的可能性≥95%,需要穿刺活组织病理检查。 Ⅵ级:超声检查乳腺内可见异常病灶,超声影像学改变为恶性病灶,并获得病理检查证实。BI-RADS分级值≤Ⅲ级为良性;>Ⅲ级为恶性。
1.4 UE评分标准[4]1分:乳腺病灶整体以及周边组织均出现显著形变,病灶整体以及周边组织均表现为绿色。2分:乳腺病灶大部分出现形变,病灶表现为蓝绿相间,但主要表现为绿色。3分:乳腺病灶周缘部分出现形变,而中心部分未出现形变,病灶中心表现为蓝色,周缘表现为绿色。4分:乳腺病灶整体未出现形变,病灶整体表现为蓝色。5分:乳腺病灶以及周边组织均未出现形变,病灶整体以及周边组织均表现为蓝色。UE评分值1~3 分为良性;4~5 分为恶性。应变率比值≤3.08为良性;>3.08为恶性[5]。以病理结果为金标准。
1.5 统计学方法 采用SPSS17.0 统计软件。计量资料以(±s)表示,采用t检验。计数资料以%表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 病理诊断结果 良性乳腺微小病灶78个,其中纤维腺瘤31个、导管内乳头状瘤23个、乳腺囊肿6个、乳腺炎性病灶5个、纤维脂肪瘤13个。恶性乳腺微小病灶54个,其中:原位癌5个、黏液癌11个,髓样癌8个、浸润型导管癌16个、导管内乳头状癌14个。
2.2 BI-RADS分级及UE诊断乳腺微小病灶 BIRADS分级对132个乳腺微小病灶的诊断结果:良性乳腺微小病灶73个、恶性乳腺微小病灶59个。良性乳腺微小病灶BI-RADS分级值明显低于恶性乳腺微小病灶,差异有统计学意义(P<0.05)。UE对132个乳腺微小病灶的诊断结果:良性乳腺微小病灶74个、恶性乳腺微小病灶58个。良性乳腺微小病灶超声弹性评分值以及应变率比值均明显低于恶性乳腺微小病灶,差异有统计学意义(P<0.05)。
2.3 BI-RADS分级、UE以及两者联合对恶性乳腺微小病灶的诊断价值 见表1。
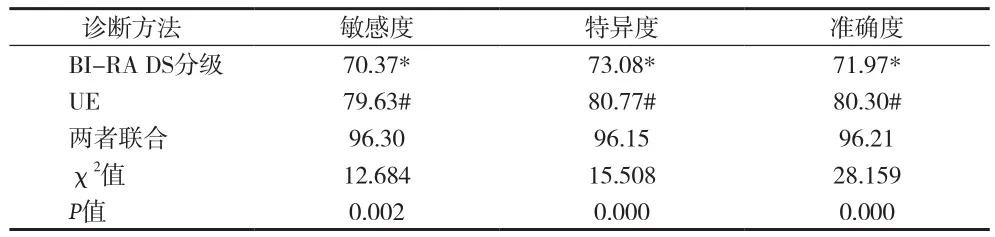
表1 BI-RADS分级、UE单独或联合诊断的价值(%)
3 讨论
超声有着简便、经济、无创等优点而被广泛应用于乳腺疾病筛查中。但常规二维超声诊断的主观性较强,常导致超声诊断描述结果笼统不规范,降低了其对临床的实际指导价值。BI-RADS分级诊断以其简单明了的分级,规范了超声检查对乳腺疾病的诊断描述及报告,提高超声对乳腺肿瘤良恶性质的鉴别诊断能力,充分发挥超声对临床的指导价值。本资料结果显示,良性乳腺微小病灶的BI-RADS分级值明显低于恶性乳腺微小病灶(P<0.05),说明BI-RADS分级诊断可运用于乳腺微小病灶的良恶性质判定中。而BI-RADS分级诊断恶性乳腺微小病灶的敏感度为70.37%、特异度为73.08%以及准确度为71.97%,提示BI-RADS分级对乳腺微小病灶的良恶性质判定具有明确的临床应用价值。
BI-RADS分级是建立在二维超声基础之上的,当存在乳腺病灶体积过于微小,病灶内癌组织仅局限于病灶内的极小范围,癌组织对周围组织侵犯不明显,病灶内血流信号不明显等因素时,均可导致恶性乳腺微小病灶的二维超声影像特征不明显,易漏诊或误诊。UE诊断原理是不同的组织结构具有不同的组织弹性系数,乳腺病灶的恶性程度随着病灶硬度的增加而上升[6]。UE分析病灶硬度,获得病灶的应变率,以不同的色彩直观反映不同的组织弹性硬度。本资料中,良性乳腺微小病灶的超声弹性评分值以及应变率比值均明显低于恶性乳腺微小病灶(P<0.05),说明恶性乳腺微小病灶的硬度大于良性乳腺微小病灶,UE能根据乳腺微小病灶的硬度情况对病灶的良恶性质作出准确的判定。而本资料中运用UE技术诊断恶性乳腺微小病灶的敏感度为79.63%、特异度为80.77%以及准确度为80.30%,且均分别高于BI-RADS分级的敏感度、特异度以及准确度,说明UE对乳腺微小病灶的良恶性质判定具有较高的临床应用价值,UE对乳腺微小病灶良恶性质的判定能力优于BI-RADS分级。但UE对部分的乳腺微小病灶同样会误诊漏诊,原因可能与部分良性乳腺病灶病程较长,其内部出现钙化或机化使病灶的硬度增加;部分恶性乳腺病灶边界不清楚使病灶质地较硬区难以明确;部分恶性乳腺病灶内部癌细胞所占比例明显高于纤维间质成分致使病灶硬度下降;部分恶性乳腺病灶发生囊性变致使病灶硬度下降等诸多因素有关[7]。本资料中,BI-RADS分级+UE两者联合诊断恶性乳腺微小病灶的敏感度、特异度以及准确度均明显高于单独BI-RADS分级或单独UE(P<0.05),说明应用超声对乳腺微小病灶进行检查时,将两者联合应用,彼此互补,充分发挥各自的优势,为临床提供更全面客观的参考依据。
1 Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burder of cancer in 2008:globocan 2008.Int J Cancer,2010,127:2893~2917.
2 赵子卓,欧冰,罗葆明,等.超声弹性成像对乳腺小实性病灶的鉴别诊断价值.中华超声影像学杂志,2010,19(9):787~789.
3 姚晓松,张颖,陈菲,等.BI-RADS分级诊断标准在乳腺疾病超声诊断中的应用,中国临床研究,2012,25(3):283~284.
4 罗葆明.乳腺超声弹性成像检查压力与压放频率对诊断结果影响.中国医学影像技术,2011,12(8):156~158.
5 智慧,肖晓云,杨海云,等.弹性应变率比值在乳腺实性肿物良恶性鉴别诊断中的价值初探.中华超声影像学杂志,2009,18(7):589~591.
6 罗健文,白净.超声弹性成像的原理及理论分析.国外医学生物医学工程分册,2003,26(3):97~102.
7 罗葆明.乳腺超声弹性成像检查的影响因素及解决策略.中国医学科学院学报,2010,12(1):226~228.
310007 杭州市西湖区北山街道社区卫生服务中心(周艳英)
310022 浙江省肿瘤医院(李丽 杜峰)

