喉癌干细胞的新型培养纯化方法及临床应用前景
段广亮 王凯峰 戴辉萍 唐婷婷 丁飞
喉癌干细胞的新型培养纯化方法及临床应用前景
段广亮 王凯峰 戴辉萍 唐婷婷 丁飞
目的 通过含生长因子的无血清培养基(SFM)培养Hep-2喉癌细胞,分离并扩增肿瘤干细胞,为进一步制备放疗增敏剂做基础研究。方法 含生长因子的无血清培养基(SFM)培养Hep-2喉癌细胞,流式细胞仪检测细胞中侧群细胞的比例。当侧群细胞比例达25%时,收集全部细胞球,FACS筛选出CD133+、CD44+细胞作为喉癌干细胞。结果 成功培养出侧群细胞,流式细胞仪检测其比例达26.2%,FACS筛选出CD133+CD44+细胞的比例均>91%。结论 成功培养出高浓度喉癌干细胞。
无血清培养基 重组表皮生长因子 成纤维生长因子 侧群细胞
肿瘤干细胞是肿瘤中少数具有自我更新、无限增殖及多向分化潜能的细胞,且固有放射抵抗能力,而其它肿瘤细胞群并不增殖或数次增殖后自然凋亡。因此一般认为肿瘤干细胞是肿瘤发生发展和放射抵抗的根源[1~4]。近年成功分离鉴定近10种肿瘤干细胞,鉴别肿瘤干细胞目前常用的方法是对富集肿瘤细胞表面特殊抗原的识别,头颈部鳞状细胞癌表面标志物的研究较少,较为认可的“标志”细胞是流式细胞仪检测的侧群细胞(肿瘤干细胞样细胞)和CDl33+、CD44+肿瘤细胞[5],但分选效果不佳,作者自2010年6月至2012年3月结合自身试验条件及喉癌干细胞的特点通过长期实验摸索分两步培养纯化喉癌干细胞,成功的经流式细胞仪分选出具有较高浓度CDl33+、CD44+喉癌干细胞。报道如下。
1 材料与方法
1.1 材料 Anti-CD44-FITC(美国eBioscience公司);Anti-CD133-PE(美国eBioscience公司);Hocest33342(碧云天公司);碘化丙啶(PI)(美国 Sigma公司);维拉帕米(Verapamil)(美国 Sigma公司);DMEM/ F12(美国Gibco公司);重组表皮生长因子(EGF)(美国PeproTech公司);成纤维生长因子(bFGF)(美国PeproTech公司)
1.2 实验方法 (1)细胞的冻存和复苏:①冻存:消化细胞,将细胞悬液收集到离心管中保存。1000r/min离心10min,弃上清液。沉淀加含10%DMSO的培养液,计数板计数,调整至5×106/ml左右。将悬浮液分到冻存管中,1ml/管。将冻存管拧紧封严,如用安瓿瓶火焰封口时,封口须严密,否则复苏时较易爆裂。管瓶下部贴上标签,注明细胞的种类及冻存日期。根据冷冻要求按顺序降温:室温时→4℃(20min)→冰箱冷冻室(30min)→低温冰箱(-30℃ 1h)→液氮。②复苏:准备37℃的温浴锅,从液氮中取出冻存管、迅速置于37℃温水中并不断搅动,使冻存管中的冻存物在1min之内融化。打开冻存管,将细胞悬液吸到离心管中。1000rpm离心10min,弃去上清液。沉淀加10ml培养液,吹打均匀,再离心10min,弃上清液。加适当培养基后将细胞转移至培养瓶中,37℃培养,第2天观察生长情况。(2)喉癌干细胞球培养和诱导分化试验:采用常用的干细胞微球体分离培养法:①先将Hep-2喉癌细胞接种于含血清培养基中培养传代。待细胞生长至80%瓶底面积时,用PBS液清洗,质量浓度为2.5g/L胰蛋白酶消化,吸管反复吹打制成单细胞悬液。②离心除去终止消化时残留的含血清培养基后重悬于无血清培养基中,无血清培养基为在DMEM/ F12培养基中添加重组表皮生长因子(20μg/L)和重组成纤维生长因子(10μg/L),L-谷氨酰胺(2mmol/L),胰岛素(4U/L),青霉素G(1×105U/L),链霉素(100mg/ L)。③台盼蓝染色、计数重悬成103/ml单细胞悬液,接种于培养瓶,在37℃,体积分数为5%的CO2饱和湿度培养箱中培养,培养瓶直立、每日摇数次以利细胞悬浮生长,观察微球形成,在每个培养瓶中加入2 ml/2d新鲜无血清培养基,传代1次/6d。④待喉癌细胞增殖形成细胞球4d后,Accutase消化、吹打成单细胞,洗涤后在SFM中传代培养,以扩增和富集喉癌干细胞,按1:4的比例传代。(3)侧群细胞的检测:①选择对数生长期生长的细胞,细胞计数,调整细胞悬液的密度至1×109/L。②准备2个干燥无菌的流式上样管(5 ml,材料为聚丙烯),分别在2管中加入上述细胞悬液各1ml,然后再加入Hoechst33342溶液,使终末浓度达到5 mg/L,在对照管中加入维拉帕米溶液,使终末浓度达到浓度50 mg/L。③给予反复吹打数次,均匀后置于37℃恒温水浴箱中120 min,期间缓和摇动上样管1次/15min使细胞充分染色。④待染色结束后在4℃ 1000 r/min离心机离心10min,弃上清液,加入4℃磷酸盐缓冲液吹洗1次,再4℃ 1000 r/min离心10min,弃上清液,重悬于体积分数为2%胎牛血清的磷酸盐缓冲液中。⑤放在4℃环境中准备上机检测。(4)喉癌干细胞的筛选及体外生长HE染色观察:①当侧群细胞比例达25%时,收集全部生长细胞球,制成单细胞PBS悬液100μl,计数细胞密度为1×107/ml。②用台盼蓝染色计活细胞数,要求活细胞数90%~95%。③加入Anti-CD44-FITC和Anti-CD133-PE各5μl,4℃避光孵育30min。④离心去上清液,PBS洗涤≥3次,1500r/min,离心3min,200目细胞网筛过滤。⑤加300μl PBS(pH=7.4),上机检测。⑥分选之后调整细胞浓度达到1×106/ml,接种到含盖玻片的培养瓶中培养,细胞长成单层后,取出盖玻片,PBS洗涤,用95%的酒精固定15min,再洗涤,浸入苏木精染液中染色10min,洗涤;浸入淡氨水中之前用稀盐酸酒精溶液分色,使细胞核蓝化5min洗涤;伊红染液染色10min,洗涤;无水酒精脱水,过二甲苯3次,封片,光镜下观察。
2 结果
2.1 成功诱导和富集喉癌干细胞 (1)以含血清培养基培养Hep-2喉鳞癌细胞系细胞:接种后8h所有细胞均贴壁,3~4d后细胞即长满瓶底,培养的喉癌细胞有明显的肿瘤细胞特征:上皮样形态,多边形,似铺路石样排列,折光性好,不形成悬浮细胞球(如图1)。(2)接种细胞于无血清培养基中:Hep-2喉鳞癌细胞株细胞接种于SFM中,培养瓶直立,每日摇数次,开始大部分细胞贴壁,在第3~7天,部分细胞开始悬浮,小球状增生形成,部分细胞崩解死亡,不能在SMF培养基中存活生长。第9天时,小球状细胞团部分凋亡,但仍能见小部分细胞扩增继续形成细胞球,摇晃培养瓶可见较少的细胞球沉于培养瓶底部。球内细胞折光性较好,生长紧密,不能准确辨别细胞间的分界限。新形成的肿瘤干细胞球外形不规则,常以“发芽”的生长方式连接在球体上。传代时通过Accutase消化、吹打成单细胞悬液,后第l~2天单个细胞间相互聚集连接成“树枝状”悬浮于SFM中,第3~4天形成不规则细胞球,第5~6天逐渐形成规则球形。随着传代次数的增加,球体趋于圆形(如图2)。

图1 含血清培养基培养的喉癌细胞
图2 SFM培养喉癌细胞形成的细胞球(原放大倍数×200)
2.2 侧群细胞的分选 侧群细胞能排出荧光染料Hoechst33342而呈弱染色状态,位于流式图的左下角荧光弱染区域。对照组中加维拉帕米,抑制细胞转运蛋白的功能,改变侧群细胞外排荧光染料的特性,使侧群细胞的比例减少到(0.0±0.0)%,经多次扩增和富集后成功使侧群细胞达到26.2%(如图3)。用离心管收集分选的SP细胞和NSP细胞备用。

图3 Hoechst33342组(左)和Hoechst33342+维拉帕米组(右)染色结果
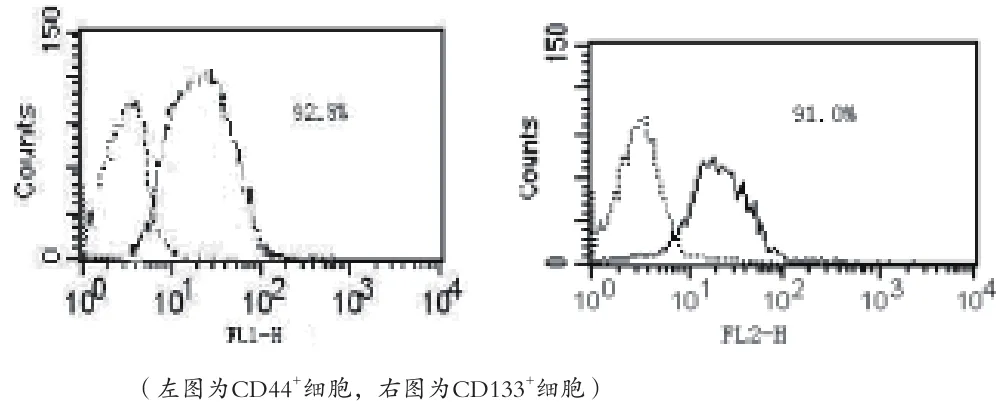
图4 流式细胞仪筛选实体瘤来源的CD44+、CDl33+喉癌干细胞结果

图5 喉癌干细胞HE染色结果
2.3 喉癌干细胞的筛选 采用无血清培养基培养细胞微球体,富集喉癌干细胞。流式细胞仪分别筛选出CD44+、CDl33+喉癌干细胞。分选前喉癌细胞CD44+、CDl33+的表达率均<3%,分选后均>91%,分选后喉癌细胞HE染色可见细胞分布均匀,体积较大,呈梭形,细胞核与细胞质的比例接近于1,核大浓染,核仁大而突出,有病理性核分裂相,符合恶性肿瘤干细胞病理特点(图4、5)。
3 讨论
目前肿瘤干细胞的分选可通过功能学分选(肿瘤干细胞高表达耐药蛋白而将核染料Hoechst 33342排除出细胞外。流式图中显示这类细胞称为侧群细胞)或免疫学分选(流式或免疫磁珠法分选出肿瘤干细胞表面标志阳性的细胞)[6]。但上述两种方法最大的问题是肿瘤干细胞存在于肿瘤组织中数量稀少,若纯化足量的细胞以满足研究所需,工作量极大。作者通过长期实验摸索发现,在无血清培养基中添加bFGF、EGF、L-谷氨酰胺,胰岛素作为血清替代物既保留了细胞赖以生存的必需营养物质又去除了血清中的促分化剂,通过富集培养成功使侧群细胞>25%。喉癌鳞状细胞中,CD44和CD133的阳性比例均<3%,作者成功地通过流式细胞仪分选出具有CD44+、CDl33+喉癌干细胞的比例均>91%。
流式细胞仪分选法,也称为荧光活化细胞分选法,是利用待分选细胞结合荧光素标记抗体能力的差异或者利用外排荧光染料性质的差异来分离肿瘤干细胞,是目前应用最为广泛的分离技术,已应用于人白血病、乳腺癌及神经胶质瘤干细胞的分离。磁性激活细胞分选法基于细胞表面抗原与连结有磁珠的特异性单抗相结合,在外加磁场中,通过抗体与磁珠相连的细胞被吸附而留滞在磁场中,无该类表面抗原的细胞不能与连接有磁珠的特异性抗体结合,不能被磁珠捕获,因而无磁性,这些细胞不能在磁场中留下,细胞进而得到分离,目前胶质瘤干细胞的分离常采用此法。还有一种肿瘤干细胞分选法是侧群细胞分选法,有关研究表明体外培养的侧群细胞具有神经干细胞特性,且与非侧群细胞不同,侧群可以在裸鼠中高效表达移植瘤。由于肿瘤干细胞包膜高度表达ATP结合盒(ATP-binding cassette,ABC)膜转运蛋白(包括P-糖蛋白P-gp、乳腺癌耐药蛋白、ABCG1、ABCG2等)对进入细胞内的化疗药物和染料有外排泵作用。因此可以利用侧群细胞不被Hoechst33342染色的特性,即利用干细胞通过分子标记来分离纯化肿瘤干细胞,这一方法有利于分离纯化未知表面标志物的肿瘤干细胞。研究证明大多数肿瘤细胞系中存在侧群细胞[5],并在C6神经胶质瘤、MCF-7乳腺癌、B104成神经细胞瘤细胞系中成功分离出侧群细胞亚群,且证实了C6中仅占细胞总数0.4%的侧群细胞具有多向分化和少量成瘤的特性,提示侧群细胞是适用于肿瘤干细胞分离的一种方法。目前尚无最优化的肿瘤干细胞分选方案,流式细胞仪分选与纯化具有高敏感和高特异性,由于流式细胞分选法是在分选血细胞的过程中建立的,许多肿瘤细胞可能难以承受高压小直径的液流,进而影响分选细胞的活性,磁性激活细胞分选法对细胞损伤小,不会影响细胞的活性与功能,微型磁珠可被生物降解等优点,但与流式细胞分选法相比分选纯度较低。侧群细胞分离的最优化条件是用355nm左右的紫外光激发,需要特殊的氩气激发光源,其功率较高,需要水冷却系统及相应的滤片,这些设备价格昂贵,限制了侧群细胞分选法的普遍推广。
我国喉癌的发病率呈逐年上升趋势,成为危害严重的常见恶性肿瘤之一。放疗是喉癌的临床最重要的治疗手段之一,但是肿瘤细胞固有的和放疗诱导的放疗抵抗严重影响了疗效,希望在分选出喉癌干细胞的基础上进一步研究开发出放疗增敏剂,解决喉癌放疗抵抗,根治肿瘤。
1 Ghotra VP, Puigvert JC, Danen EH. The cancer stem cell microenvironment and anti-cancer therapy. Int J Radiat Biol,2009,85(11): 955~962.
2 Blazek ER,Foutch JL,Maki G.Daoy medulloblastoma cells that express CDl33 are radioresistant relative to CDl33-cells,and the CD133+sector is enlarged by bypoxia.Int J Radiat. Oncol. Biol. Phys,2007,67(1):l~5.
3 Hambardzumyan D,Squatrito M,Holland EC.Radiation resistance and stem-like cells in brain tumors.Cancer Cell,2006,10(6):454~456.
4 Kang MK,Har BI,Ko MH,et al.Potential identity of multi-potential cancer stem-1ike subpopulation after radiation of cultured brain glioma. BMC Nearosci,2008,9(2):15.
5 孙志刚,黄盛东,张宝仁.肿瘤干细胞研究现状.第二军医大学学报,2008,29(4):443~449.
6 Mueller DW,Bosserhoff AK.Role of miRNAs in the progression of malignant melanoma. Br J Cancer,2009,101(4):551~556.
Objective To explore a new culturing method for Hep-2 Laryngeal Cancer Cell by menas of the SFM of containing growth factor separate and to amplify cancer stem cell. Methods Culturing Hep-2 Laryngeal Cancer Cell by menas of the SFM of containing growth factor,FACS was used to detect the ratio of side population. When the ratio of side population expressed reached 25%,the whole cell balls were collected. FACS was used to screen out CD133+CD44+cells, which were laryngeal cancer stem cell. Results The side population were successful cultured and reached the ratio of 26.2% by detection of FACS;Overtop 91% of CD133+CD44+cells were screened out by FACS. Conclusion High ration of laryngeal cancer stem cell can be successfully cultured.
SFM EGF bFGF Side population
310015 杭州师范大学附属医院

