植物乳杆菌对猕猴桃酒降酸效果的研究
李 静,樊明涛,孙慧烨
(西北农林科技大学 食品科学与工程学院,陕西杨凌 712100)
植物乳杆菌对猕猴桃酒降酸效果的研究
李静,樊明涛,孙慧烨
(西北农林科技大学 食品科学与工程学院,陕西杨凌 712100)
本研究旨在通过植物乳杆菌和酒类酒球菌引发猕猴桃酒的苹果酸-乳酸发酵,筛选出猕猴桃果酒的后发酵的适宜菌株。实验选用植物乳杆菌CS-1、XJA-2、XJ-14、XJ-25、520、542、544以及酒类酒球菌31MBR八株菌对自酿猕猴桃酒进行降酸。通过单因素实验以及中心实验设计(CCD)筛选最佳的猕猴桃酒后发酵菌株并优化其降酸条件。结果表明植物乳杆菌520在酒中生长快速,降酸效果最佳。所得最佳条件为:接种量6.7%,pH3.5,温度21.6 ℃。在该条件下验证得到苹果酸的降酸率为63.89%,因此可以有效降低猕猴桃果酒酸度,故植物乳杆菌520可作为新一代猕猴桃酒降酸的潜在菌株。
猕猴桃酒,植物乳杆菌,降酸
猕猴桃又称“奇异果”,富含VC,被誉为“水果之王”,且含有丰富的可溶性膳食纤维,具有较强的抗氧化性能[1]。猕猴桃酒是其深加工产业的重要产品之一[2]。它的酿制过程同其他果酒酿造过程基本相同[3],营养价值较高。但目前猕猴桃果酒市场占有率较低,究其原因主要是猕猴桃酒酸度过高,口感尖酸、锐利,不能满足消费者感官的需求,因而猕猴桃酒的降酸问题成为限制猕猴桃果酒产业发展的技术难题[4]。
果酒经过后发酵可使其口感更加圆润、细腻,提高果酒的品质[5]。利用后发酵过程,接入可引发苹果酸乳酸发酵的适宜菌株,有效降低猕猴桃酒的酸度[6-7]。葡萄酒中进行苹果酸乳酸发酵的商业化菌株主要是酒类酒球菌[8],然而酒类酒球菌生长缓慢,作用效果迟缓,不利于工业化生产。已有研究证实,植物乳杆菌可在严苛的酿酒环境中生存,通过苹果酸乳酸发酵降低果酒酸度,故可以作为MLF发酵的潜在菌株[9-11]。
本实验选取四株分离自果酒的菌株:植物乳杆菌CS-1、XJA-2、XJ-14、XJ-25和三株分离自泡菜中的植物乳杆菌520、542、544,接入猕猴桃鲜酒,引发MLF发酵,测定发酵后的苹果酸含量,旨在筛选出适宜菌株并得到最优的发酵条件,为猕猴桃酒的生产奠定基础。
1 材料和方法
1.1材料与仪器
植物乳杆菌CS-1、XJ-14、XJ-25、XJA-2(从葡萄酒中分离)西北农林科技大学葡萄酒学院提供。-80 ℃保存的植物乳杆菌活化至第二代后,以2%接种量接种至MRS培养基中,37 ℃温度下培养至对数末期(12~16 h)备用;植物乳杆菌520,542,544(从泡菜中分离)本实验室分离、鉴定并保存;酒类酒球菌31MBR为实验室保存菌株。
MRS培养基:葡萄糖20 g/L,酵母浸粉4 g/L,蛋白胨10 g/L,牛肉膏5 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·4H2O 0.05 g/L,乙酸钠5 g/L,磷酸氢二钾2 g/L,柠檬酸铵2 g/L,吐温80 mL/L,用1 mol/L NaOH调pH至6.2~6.4,121 ℃灭菌20 min。
ATB培养基:蛋白胨10 g/L,酵母浸粉5 g/L,MgSO4·7H2O 0.2 g/L,葡萄糖10 g/L,MnSO4·4H2O 0.05 g/L,盐酸半胱氨酸0.5 g/L,实验室自制番茄汁250 mL/L,pH调至4.8,121 ℃灭菌20 min。
猕猴桃鲜酒:实验室自酿[12](秦美猕猴桃,购自陕西省咸阳市杨凌区夏家村猕猴桃园)
苹果酸标样:购自阿拉丁试剂公司;酵母(excellence SP):购自yakult公司;果胶酶(Mcerozyme R-10):购自Lamothe abiet公司;亚硫酸:购自西陇化工股份有限公司。
DH-420A电热恒温培养箱北京科伟永兴仪器有限公司;HC-3018R高速冷冻离心机安徽中科中佳科学仪器有限公司;HS-840μ型水平层流单人净化工作台苏州净化设备有限公司;水浴锅北京科伟永兴仪器有限公司;pH计上海雷磁仪器厂;UV-1700紫外可见分光光度仪SHIMADZU公司;LC-10AVPPLUS高效液相色谱仪日本岛津公司;TRACE ISQ气相色谱/质谱联用仪美国Thermo Fisher公司。
1.2猕猴桃酒的酿造

成熟度适宜的猕猴桃果实打浆后经果胶酶处理24 h后,接入酿酒酵母进行酒精发酵,酒精发酵完成后进行倒罐,直至果酒澄清且瓶底无沉淀物。接入实验菌株引发果酒的苹果酸-乳酸发酵,至果酒中苹果酸含量恒定后倒罐,至澄清即得到猕猴桃果酒的成品。
1.3实验方法
1.3.1猕猴桃果酒理化指标的测定pH的测定:用pHS-3C雷磁pH计进行测定;总酸(以酒石酸计)测定:酸碱滴定法(GB/T 15038-1994);可溶性固形物(TSS)测定:用手持折光仪测定;总还原力:参照Oyalzu(1986)方法进行测定[13];总酚含量测定:福林-酚(Folin-Ciocaheus)法;酒精度测定:酒精计测定。
1.3.2单因素实验菌株筛选实验选用7株植物乳杆菌和酒类酒球菌 31MBR在室温条件下,以猕猴桃鲜酒体积为基准接入6%(v/v)的菌株(108cfu/mL)[14],定期取样HPLC法测定苹果酸含量至苹果酸含量恒定。计算各菌株对猕猴桃酒的苹果酸降酸率。
各实验因素对降酸效果的影响以猕猴桃酒中苹果酸含量为响应指标,经预实验确定环境温度、接种量和初始pH对响应值影响显著。在其他因素水平不变的条件下,单因素实验分别测定温度为14、18、22、26、30 ℃,接种量为2、4、6、8、10(v/v),初始pH为3、3.2、3.4、3.6、4.0时的降酸率。
1.3.3中心实验设计(CCD,Central Composite Design)以猕猴桃酒中苹果酸含量的降酸率作为响应值,选取单因素实验得到的最优点为中心水平,进行中心实验设计[15]。
1.3.4HPLC法测定苹果酸含量色谱柱:Kromasil 100-5C18(250 mm×4.6 mm);柱温:40 ℃;检测波长:210 nm,二极管阵列检测器;流动相:质量分数为0.01的磷酸氢二钾溶液(去离子水配制),用磷酸调节pH至2.9,流速:0.6 mL/min。
1.3.5苹果酸降酸率的计算降酸率(%)=(1-C/C0)×100
C-植物乳杆菌降酸处理后,猕猴桃酒残余苹果酸含量(以苹果酸计),mg/L;C0-空白组,即未经后发酵的猕猴桃酒中苹果酸含量,mg/L。
1.6.5数据处理运用Design export 7.0软件对实验得到的结果进行多元二次模型方程的建立以及方差分析,并利用响应面方法得到各个因素的最优水平。二次旋转中心实验的因素水平(如表1)。

表1 二次旋转中心实验因素水平
2 结果分析
2.1猕猴桃酒的理化指标
猕猴桃汁经酒精发酵得到鲜酒,鲜酒(1 ℃)经倒罐并澄清至瓶底无沉淀物,即为实验组猕猴桃酒。猕猴桃酒在陈酿的过程中,还原力较为稳定,但多酚等具有抗氧化能力的物质被氧化,或者分解为不具有抗氧化能力或者该能力较弱的单酚,故测得总酚含量(没食子酸当量)变小。
2.2单因素实验结果
2.2.1猕猴桃鲜酒中不同植物乳杆菌降酸效果计算得到实验菌株的苹果酸降酸率(如图1)。结果表明实验菌株都具有一定的降酸能力,而植物乳杆菌520能力较强,可将猕猴桃鲜酒中53.22%的苹果酸降解,比酒类酒球菌31MBR的降酸率高出3.28%。而降酸最弱的菌株为植物如柑橘CS-1,降酸率仅达到36.16%。实验得出酒类酒球菌31MBR的苹果酸降酸率为49.94%,低于相关研究中的处理结果,原因是猕猴桃鲜酒的酸度较高,初始pH仅为3.19,在该过酸条件下,酒类酒球菌不能十分高效的引发苹果酸乳酸发酵。植物乳杆菌520在猕猴桃酒中降酸效率较高,能较显著改善猕猴桃果酒的口感和品质。

表2 猕猴桃酒的基础理化指标

图1 不同植物乳杆菌在猕猴桃鲜酒中的苹果酸降酸率Fig.1 The deacidification of different Lactobacillus plantarum in kiwifruit wine
2.2.2各因素对降酸效果的影响环境温度、初始pH和植物乳杆菌接种量三个因素对于MLF发酵的作用较为显著(如图2所示)。由图2a所示,随着植物乳杆菌接种量的增大,苹果酸降酸率呈现出先增大后减小的趋势,苹果酸降酸率在植物乳杆菌的接种量为6%时达到最大。接种量为6%~8%时,苹果酸降酸率基本保持不变,接种量继续增大则苹果酸降酸率有轻微下降趋势。可能是由于经酒精发酵,猕猴桃果酒中残留的营养素含量有限,接种量过大在MLF前期可有效促进菌株量迅速增大,但到了发酵后期果酒不能供给单位体积生物量足够的营养物质[15],导致菌株大量死亡,发酵周期缩短反而不利于菌株的增殖。图2b显示环境温度升高至22 ℃时,苹果酸降酸率达最大,随着温度继续升高苹果酸降酸率呈下降趋势。植物乳杆菌对温度具有较明显的敏感性。如图2c所示,菌株在pH 3.0、3.2、3.4、3.6、3.8时均能够生长,但随着初始pH的增大苹果酸降酸率呈现出先增大后减少的趋势,且初始pH为3.4时降酸率达最大。

图2 MLF的初始条件对于苹果酸降酸率的影响Fig.2 The influence of different initial factors to the rate of deacification for malic acid of kiwifruit wine
2.2二次旋转中心组合实验
依据单因素实验结果,设计中心组合旋转实验,选定环境温度、pH和菌株接种量的中心值为22 ℃、3.4和6%进行实验,以苹果酸降酸率作为响应值,得到植物乳杆菌降酸效果最优时的因素水平。实验设计编码以及实验结果如表3所示。

表3 二次旋转中心组合实验结果
对二次旋转中心实验结果进行方差分析和显著性检验,其结果如表5和表6所示。从回归模型的方差分析可以看出,回归方程的失拟项不显著(p>0.05),可推断出选用的二次方程模型是适合的。回归方程的显著性检验得到该模型具有显著性(p<0.01),可说明该模型的预测值与真实值较为吻合,故该模型成立。

表5 回归模型的方差分析
响应面分析所得的因子变化与实验结果之间的相互作用真实可靠。经回归拟合之后,实验因子对于响应值的对应关系可用二次回归方程表示。
Y=58.28+2.14A+3.36B+0.62C+4.99AB-5.41AC-0.82BC-5.28A2-6.24B2-3.83C2
在α=0.05的显著水平下,剔除不显著项之后,二次回归方程可简化为
Y=58.28+2.14A+3.36B+4.99AB-5.41041AC-5.28A2-6.24B2-3.83C2
简化所得二次回归模型是显著的,回归方程与实测值拟合较好。进一步对回归方程进行偏相关t检验,得到各项均在α=0.05的显著水平上显著(p<0.05),故剔除不显著因素后实验所选取因素(初始pH和接种量)对实验结果均影响显著。
构建苹果酸降酸率与环境温度、初始pH和接种量的三维空间响应面图,各因素之间的交互作用如图3~图5所示。
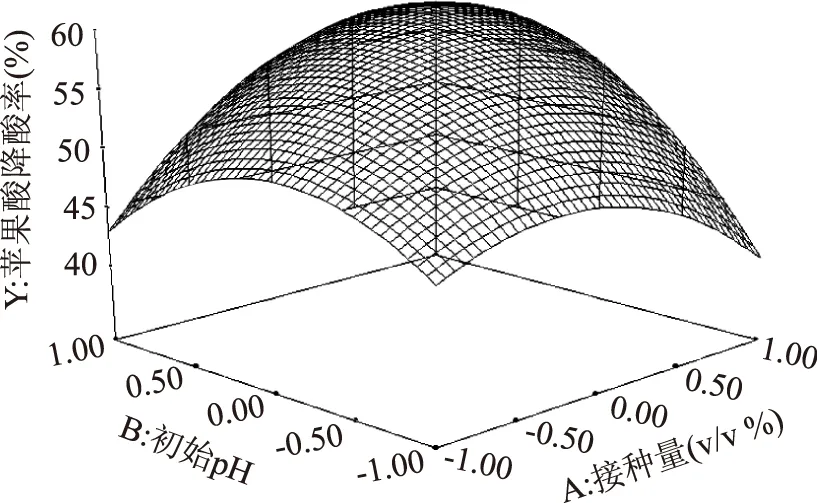
图3 接种量和初始pH对苹果酸降酸率的响应面图Fig.3 Response surface of inoculum size and initial pH on the deacification rate of malic acid
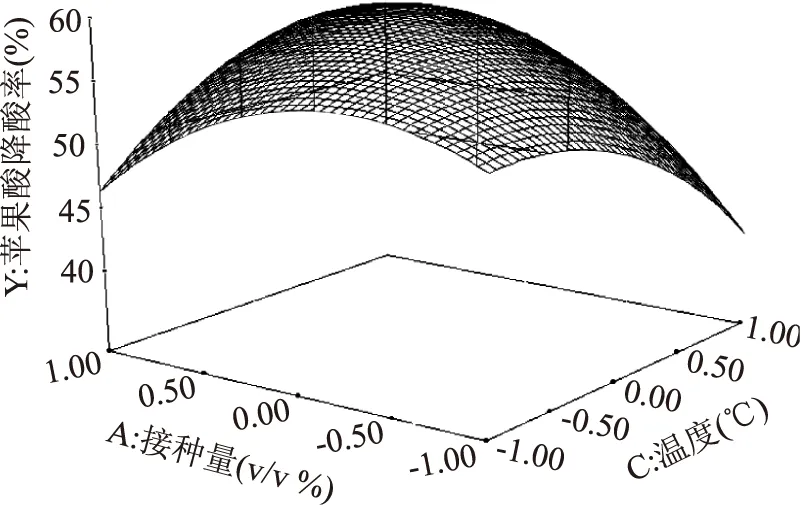
图4 接种量和温度对苹果酸降酸率的响应面图Fig.4 Response surface of inoculum size and temperature on the deacification rate of malic acid

图5 初始pH和温度对苹果酸降酸率的响应面图Fig.5 Response surface of initial pH and temperature on the deacification rate of malic acid
回归方程所作的响应面立体分析图3~图5,分别反映了接种量、起始pH、温度这3个因素的两两交互作用对响应值的影响。因拟合所得方程的二次项系数均为负值,故其所表征的抛物面开口向下,具有极大值点。利用Design Expert 7.0软件,计算分析得到,植物乳杆菌接种量为6.7%,pH3.5,温度为21.6 ℃时苹果酸降酸率最大,且软件预测中心点对应响应值为64.57%。
2.3主因子效应分析
由方差分析以及优化得到的回归方程可知接种量(A)、pH(B)会对响应值苹果酸降酸率有显著影响(p<0.05),而温度(C)对苹果酸降酸率影响不显著(p>0.05),且归方程的一次系数B>A,即三因素对于响应值的影响:pH>接种量>温度,结果与对猕猴桃酒总体品质研究[2]的结果一致。
2.4验证实验
利用Design Export 7.0 优化得到的最适条件进行验证实验(6个平行组),HPLC法测定猕猴桃酒经过植物乳杆菌520进行MLF发酵猕猴桃酒的苹果酸减少量,经计算得苹果酸降酸率的平均值为63.89%,与模型的预测值64.57%较为接近。
2.5讨论
猕猴桃果酒的微生物降酸主要通过苹果酸-乳酸发酵实现,苹果酸乳酸酶是乳酸菌进行苹果酸乳酸发酵的关键酶。实验菌株接入猕猴桃鲜酒,菌株对环境的适应能力不同,导致其生长状况存在差异,同时苹果酸乳酸酶(MLE)的分泌量和活力也不同[16]。菌株达到稳定期后,因适应能力的差异导致菌株稳定期长短和分泌苹果酸乳酸酶量和活力具有明显差异,故导致不同实验菌株对猕猴桃酒的降酸效果不同,需筛选出适宜猕猴桃酒苹果酸-乳酸发酵的菌株。
环境温度和初始pH对植物乳杆菌的作用包括菌株的生长状况和菌株的产酶特性两个方面,因而控制该因素变化可得到降酸效果最优的条件。理论上讲,初始pH越高,则苹果酸乳酸酶的活力则越强,但是化学方法调节pH会破坏酒体的微生物稳定性,故实验结果中实验菌株的的降酸能力并未随pH的增大而一直增大。环境温度较低时,菌株生长受到抑制,因而产酶量和酶活力都较低,导致降酸效果不理想。随着温度升高,酶活力升高,但是果酒环境中实验菌株的生长可能会受到抑制。经实验降酸效果最优时的环境温度和初始pH分别为21.6 ℃,pH3.5。
综上,植物乳杆菌的产酶活性和产酶量会受到环境影响,且菌株的生长状况及酒体的微生物稳定性都可能在一定程度影响微生物降酸的效果和风味[17]。但考虑到苹果酸乳酸酶是诱导酶[18],通过改良环境因素可能使菌株产酶量和产酶活性可得到一定的增加。关于增加果酒中菌株的产酶量和产酶活性的途径,有待进一步研究。
3 结论
经实验七株不同来源的植物乳杆菌进行猕猴桃酒的降酸效果不同,筛选出植物乳杆菌520在猕猴桃酒中降酸效果最优。单因素实验和中心旋转组合实验得到在植物乳杆菌接种量为6.7%,pH3.5,温度为21.6 ℃该条件下,苹果酸消耗率的平均值为63.89%,降酸效果得到有效提高。
故分离自泡菜的植物乳杆菌520接入猕猴桃酒,引发苹果酸乳酸发酵可以有效降低猕猴桃酒的苹果酸含量、改善其口感,是一株具有商业化潜力的猕猴桃果酒生物降酸菌株。
[1]黄诚,周长春,李伟. 猕猴桃的营养保健功能与开发利用研究[J]. 食品科技,2007(4):51-55.
[2]彭帮柱,岳田利,袁亚宏,等. 猕猴桃酒酿造工艺参数优化及其香气成分分析[J]. 农业工程学报,2007(2):229-232.
[3]汤高奇,陈月英,岳田利,等. 响应曲面法优化猕猴桃酒酵
母培养条件[J]. 食品工业科技,2010(4):183-186.
[4]诸葛庆,帅桂兰,赵光鳌,等. 猕猴桃酒两种不同降酸方法的研究[J]. 酿酒科技,2005(3):61-64.
[5]王家梅,张军翔. 葡萄酒香气来源和形成研究进展[J]. 中国酿造,2014(5):5-9.
[6]赵燕,任美燕,李帅. 猕猴桃果酒降酸研究[J]. 粮食科技与经济,2012(1):55-57.
[7]诸葛庆,帅桂兰,赵光鳌,等. 猕猴桃酒两种不同降酸方法的研究[J]. 酿酒科技,2005(3):61-64.
[8]Sulette M,Andreas G J T,Hélène H,et al.Comparative metabolic profiling to investigate the contribution of O. oeni MLF starter[9]Krista M S,Paul R G,Vladimir J. Implications of new research and technologies for malolactic fermentation in wine[J]. Applied Microbiology and Biotechnology,2014,98(19):8111-8132.
[10]Bravo-Ferrada BM,Hollmann A,Delfederico L,et al.Patagonian red wines:selection of Lactobacillus plantarum isolates as potential starter cultures for malolactic fermentation[J].World J Microbiol Biotechnol,2013(9):1537-1549
[11]Maretdu T L,Engelbrech E,Sibylle K W.Lactobacillus:the Next Generation of Malolactic Fermentation Starter Cultures-an Overview[J]. Food and Bioprocess Technology,2011,4(6):876-906.
[12]王胜利,李国薇,樊明涛. 猕猴桃酒酿造过程中多酚及抗氧化性的研究[J]. 酿酒科技,2012(10):55-58.
[13]Oyalzu,M.Studies on product of browning reaction prepared from glucose amine[J].Japanese Journal of Nutrition,1986(44):307-315.
[14]何志刚,梁璋成,任香芸,等. 植物乳杆菌R23在枇杷酒中生长及苹果酸乳酸发酵特性研究[J]. 中国食品学报,2011(4):36-41.
[15]叶萌祺,岳田利,袁亚宏. 添加营养素提高苹果酒总酯含量优化实验[J]. 农业机械学报,2014(2):228-232.
[16]李维新,何志刚,郑宝东,等. 植物乳杆菌R23产苹果酸乳酸酶特性研究[J]. 中国食品学报,2012(5):35-40.
[17]Rosa L,Isabel L A,Ana R,et al. Malolactic fermentation of Tempranillo wine:contribution of the lactic acid bacteria inoculation to sensory quality and chemical composition[J]. International Journal of Food Science & Technology,2011,46(11):2373-2381
[18]张哲,樊明涛,董梅,等.植物乳杆菌β-D-葡萄糖苷酶的定位及活性研究[J]. 食品科学,2014(15):161-165.
Effect ofLactobacillusPlantarumon the Deacification of Kiwifruit Wine
LI Jing,FAN Ming-tao,SUN Hui-Ye
(College of Food Science and Engineering,Northwest A&F University,Yangling,Shaanxi 712100,China)
The aim of this study was to investigate the secondary fermentation of kiwifruit wine inducted byLactobacillusplantarumandOenococcusoeniso as to screen the starter cultures for malolactic fermentation(MLF)by comparing the deacidification. 7 different isolates ofLactobacillusplantarum(CS-1,XJA-2,XJ-14,XJ-25,520,542,and 544)andO.oeni31MBR associated with the MLF were used in the study. By conducting single factors and central composite design(CCD),the suitable levels were screened out for MLF. According to rate of deacidification for malic acid,L.plantarum520 was a considerable strain for kiwifruit wine,and the centre point were 6.7 percent for inoculum size and pH3.5 at 21.6 ℃. Under this optimized condition,the rate of deacidification for malic acid achieved 63.89 percent. All these characteristics,together with their ability to conduct MLF,makingL.plantarum520 suitable for a new generation of MLF starter cultures to reduce the acidity and improve the flavor of kiwifruit wine.
kiwifruit wine;Lactobacillusplantarum;deacidification
2015-05-15
李静(1989-),女,硕士研究生,研究方向:微生物发酵研究,E-mail:
公益性行业(农业)科研专项-园艺作物产品加工副产物综合利用(201503142);西安市科技计划项目-冷冻浓缩技术生产优质葡萄酒和低醇猕猴桃酒的试验研究(NC1318)。
TS261.1
B
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000

