牛血清白蛋白/黄酮醇纳米核壳颗粒的制备及抗氧化活性研究
杨 陈,许舒雯,陈龙胜,刘 慧,王 凯
(1.上海师范大学环境与生命科学学院,上海 200235;2.安徽省科学技术研究院,安徽合肥 230000;3.安徽省应用技术研究院,安徽合肥 230088)
牛血清白蛋白/黄酮醇纳米核壳颗粒的制备及抗氧化活性研究
杨陈1,许舒雯2,陈龙胜2,刘慧3,王凯3
(1.上海师范大学环境与生命科学学院,上海 200235;2.安徽省科学技术研究院,安徽合肥 230000;3.安徽省应用技术研究院,安徽合肥 230088)
利用牛血清白蛋白和疏水性黄酮醇合成牛血清白蛋白/黄酮醇纳米核壳颗粒,采用TEM确定纳米核壳的粒径,HPLC分析明确包覆率,2种抗氧化方法(DPPH自由基,ABTS自由基)对包覆前后的黄酮醇类化合物抗氧化活性进行评价。结果表明:牛血清白蛋白/黄酮醇纳米核壳粒径约为20 nm;牛血清白蛋白与黄酮醇化合物的结合关系影响它的包覆率;由于具有抗氧化活性的基团与BSA形成氢键,使得被包覆的黄酮醇抗氧化活性降低。合成牛血清白蛋白黄酮纳米核壳颗粒可以作为提高黄酮稳定性保护黄酮抗氧化活性实现黄酮较高生物利用度的一种新途径。
牛血清白蛋白,疏水性黄酮醇化合物,纳米核壳颗粒,抗氧化活性
天然黄酮类化合物(Flavonoids)大量存在于各种药用植物和食用植物中,如蜂产品、大豆产品、水果、茶叶、咖啡和蔬菜等[1-2]。黄酮类化合物最显著的性质之一是具有强的抗氧化作用,常用来治疗和预防感染、炎症、烧伤和辐射引起的伤害[3]。而黄酮类化合物因其在水溶液中的低溶解度和低稳定性限制了它们作为药物被广泛使用[4-5]。血清白蛋白因在血液中具有高度的生物相容性和稳定性等特点,在药物研究中一直被用作运输抗癌药物等的可降解性载体[6-7]。分子特性-结合力关系研究显示黄酮小分子物理化学特性与蛋白质结合力的关系密切,黄酮小分子与血清白蛋白/血红蛋白间的结合力随疏水常数增加而增强,随氢键供体/受体数目增加而降低,这表明疏水作用力在黄酮小分子与蛋白质的相互作用中起关键作用[8-9]。基于蛋白质-小分子非共价弱相互作用的药物纳米输送体系通过蛋白质单元自组装形成,该体系由于其独特的生物相容性和生物可降解性,加上低毒而成为理想的药物输送载体[10]。
因此本实验选择有较强抗氧化活性的7种天然黄酮醇类化合物:山奈酚(KA)、芦丁(RU)、异李素(ISM)、槲皮素(Q)、槲皮苷(Q3)、杨梅素(MY)及杨梅苷(MN)和典型的蛋白质载体牛血清白蛋白,通过二甲基亚砜(DMSO)设计合成牛血清白蛋白质包覆黄酮醇纳米核壳颗粒结构(粒径小于50 nm),采用TEM手段表征纳米核壳结构,HPLC明确纳米核壳黄酮包覆率,研究纳米核壳黄酮醇输送体系对黄酮醇抗氧化活性的影响。
1 材料和方法
1.1材料与仪器
7种黄酮醇标准品(纯度均大于98%)购于阿拉丁公司;牛血清白蛋白(BSA)购于上海源聚生物科技有限公司;二甲基亚砜(DMSO)国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)购于东京化成工业株式会社;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),购于合肥博美科技有限公司;所有药品均为分析纯。
79HW-1磁力搅拌器江苏金坛市金城国胜实验仪器厂;722G可见分光光度器上海仪电分析仪器有限公司;TGL-16C台式离心机上海安亭科学仪器厂;冷冻干燥机FD-1A-50北京博医康实验仪器有限公司;Thermo Scientific ultimate3000(配有可变波长紫外检测器和Chromeleon 7.1 英文版色谱工作站)赛默飞公司。
1.2实验方法
1.2.1纳米核壳的制备参照文献[10]1×10-3mol/L黄酮醇类化合物(DMSO配成的溶液)与1×10-4mol/L BSA以1∶9的比例混合,计时搅拌5 min,混合溶液浓度为黄酮醇/BSA纳米颗粒1×10-4mol/L。冷冻干燥去除DMSO[11]。
1.2.2纳米核壳表征将干燥成粉末的纳米颗粒加蒸馏水水溶解。取铜网,加20 μL样品于铜网上,自然干燥10 min后,加20 μL磷钨酸溶液(0.2 mol/L pH7.04),低温烘15 min后在透射电镜(TEM)下观察[12]。
1.2.3纳米核壳包覆率的测定黄酮醇/BSA纳米溶液中加入0.7 g(NH4)2SO4混合仪上混合10 min 静置20 min 取上清液,离心15 min,12000 r/min,再取上清液备用,每组三个平行,同时用相应的1×10-4mol/L黄酮醇类化合物作为对照[12]。色谱柱:AcclaimTM120 C18柱(4.6 mm×250 mm,5 μm),柱温25 ℃,波长为280 nm,流动相为乙腈:磷酸水体系,进样量20 μL在HPLC检测黄酮醇类化合物的峰面积。按(1)式计算包覆率。
核壳纳米颗粒包覆率(%)=[(A0-A1)/A0×100]
式(1)
式中:A0是1.0-4mol/L黄酮醇类化合物的出峰面积;A1是上清液的出峰面积。
1.2.4抗氧化活性的测定
1.2.4.1DPPH自由基清除能力测定将1×10-4mol/L黄酮/BSA纳米溶液稀释成不同梯度后各取200 μL,分别加 800 μL DPPH,以甲醇溶剂做为空白对照,每组三个平行,摇床震荡30 min后,可见分光光度计517 nm处测吸光度值[13]。按(2)式计算自由基清除率。
DPPH自由基清除活性(%)=[(A0-A1-A2)/A0×100]
式(2)
式中:A0是甲醇的吸光度;A1是加样品的吸光度;A2是加甲醇和样品的吸光度。
另将相应的1×10-4mol/L黄酮稀释成不同梯度测其对DPPH自由基的清除能力,做为对照组。
1.2.4.2ABTS自由基清除能力测定将等量的7 mmol/L ABTS加2.45 mmol/L过硫酸钾混合反应后,黑暗处放置12~16 h以制备ABTS自由基。用50%甲醇将ABTS自由基稀释成在波长为734 nm处吸光度值到0.700±0.020.将1×10-4mol/L黄酮/BSA纳米溶液稀释成不同梯度后各取100 μL分别加900 μL ABTS自由基溶液,以蒸馏水做空白对照,每组三个平行,放置10 min后,可见分光光度计734 nm处测吸光度值[14]。按(3)式计算自由基清除率。
ABTS自由基清除率(%)=[(A0-A1-A2)/A0×100]
式(3)
式中:A0是蒸馏水的吸光度;A1是加样品的吸光度;A2是加甲醇和样品的吸光度。
另将相应的1×10-4mol/L黄酮稀释成不同梯度测其对ABTS自由基的清除能力,做为对照组。
2 结果与分析
2.1纳米粒径的测定
以牛血清白蛋白为模板,采用DMSO溶剂部分变性蛋白质,降低α-螺旋结构,选择常见天然黄酮类化合物通过非共价弱相互作用(疏水作用)结合到疏水腔内的未折叠多肽链上,通过冷冻干燥去除溶剂,促使蛋白质形成包覆黄酮的核壳结构纳米粒[15],通过图画模拟纳米核壳颗粒形成示意图(如图1所示)。

图1 蛋白质/黄酮纳米颗粒形成示意图[15]Fig.1 The sketch diagram of the formation of the flavonols/BSA nanoparticles[15]
图2中通过透射电镜(TEM)在放大倍数70.0 KZoom-1HC-80.0 K下观察3种黄酮醇与牛血清白蛋白形成的纳米颗粒:槲皮素/牛血清白蛋白纳米颗粒(Q/BSA),杨梅素/牛血清白蛋白纳米颗粒(MY/BSA),山奈酚/牛血清白蛋白纳米颗粒(KA/BSA),可以看出合成的3种纳米颗粒的粒径都大约为20 nm,小于50 nm,且每种纳米颗粒的粒径都比较均一。图3D是同样放大倍数下牛血清白蛋白(BSA)的结构,相较于图3A、图3B、图3C中包覆了黄酮醇的BSA,从外观上来看并未发生明显变化,据报道DMSO加入到蛋白质中后,DMSO的S=O基团会和蛋白质的C=O基团争夺蛋白质肽键中的氢原子,使得蛋白质的α-螺旋结构被打开,部分肽链结构得以展开,蛋白质内部的疏水基团被暴露在外,从而使得蛋白质通过疏水作用和氢键作用聚合形成纳米颗粒[15-17]。表明这种包覆作用仅仅是通过DMSO改变了BSA的部分三级结构。

图2 Q/BSA、MY/BSA、KA/BSA纳米核壳颗粒及牛血清白蛋白TEM图Fig.2 TEM Figures of Q/BSA nanoparticles,MY/BSA nanoparticles,Ka/BSA nanoparticles and BSA注:A:Q/BSA,B:MY/BSA,C:Ka/BSA,D:BSA,浓度均为1×10-4 mol/L。
2.2包覆率的测定
已制备好的黄酮纳米核壳溶液中,存在着游离的牛血清白蛋白,游离黄酮以及被包覆的黄酮牛血清白蛋白颗粒,通过盐沉析的方法使得游离的蛋白质和蛋白质纳米颗粒全部沉淀下来,取上清的游离黄酮,通过HPLC进样检测,7种黄酮醇类化合物的检测主要是通过调节流动相的比例,每种黄酮醇都是通过先进一针浓度为1.0×10-3mol/L的标品确定其的出峰时间。如图3所示,谱图KA即表示浓度为1.0×10-3mol/L的山奈酚,为确定其出峰时间;谱图KA/10表示浓度为1.0×10-4mol/L的山奈酚,即山奈酚被包覆时的浓度;谱图KA/BSA表示包覆后游离的山奈酚(上清液),通过包覆率计算公式即求出山奈酚KA的被包覆率为89.77%。图4~图9分别是芦丁,杨梅素,杨梅苷,槲皮素,槲皮苷和异鼠李素的三种色谱图,通过包覆率计算公式求出的包覆率如表1所示。由表1可看出,杨梅素,山奈酚,槲皮素,异鼠李素的被包覆率都在75%以上,其中杨梅素最高为95.43%。黄酮类化合物的基本结构如图10A所示,是由两个芳香环(A 与B)通过C6-C3-C6 三碳链相互连接而成的一系列化合物,主要是指以2-苯基色原酮为母核的衍生物,根据C环取代基、3号碳原子氢化程度、苯基取代位置的不同以及C环的开环等异构变化分成不同类型,其中黄酮醇(如图10B所示)就是一种重要的类型。从文中7中黄酮醇化合物的结构上来分析,A环上都具有7-OH。而由分子结构-结合力关系研究表明黄酮的结构差异明显影响其与蛋白质的结合能力,7-羟基黄酮与BSA和HSA的结合常数比黄酮与BSA和HSA的结合常数分别大800和40倍,而黄酮/黄烷酮上的羟基糖苷化会后降低与BSA和HSA的结合力约1-3个数量级[18-19]。槲皮素,芦丁和杨梅苷的C环上的3羟基都存在被糖苷化的现象,被包覆的效果相对而言较差。槲皮苷的被包覆率仅为41.73%,芦丁和杨梅苷的被包覆率也只有60%多。说明牛血清白蛋白与黄酮的结合力关系影响着包覆率。

图3 KA,KA/10,KA/BSA的色谱图Fig.3 Chromatogram diagram of KA,KA/10,KA/BSA

图4 RU,RU/10,RU/BSA色谱图Fig.4 Chromatogram diagram of RU,RU/10,RU/BSA

图5 MY,MY/10,MY/BSA的色谱图Fig.5 Chromatogram diagram of MY,MY/10,MY/BSA
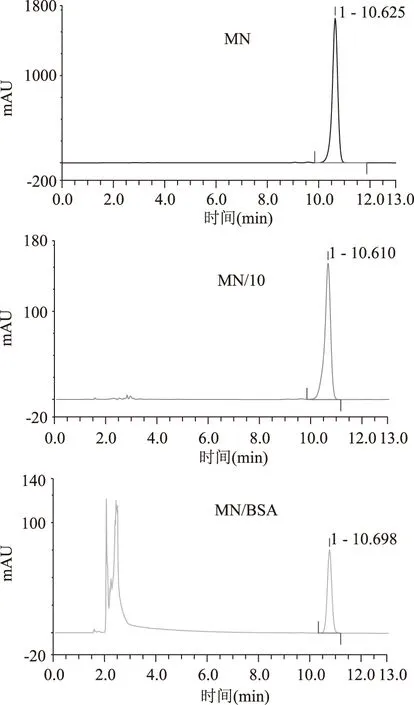
图6 MN,MN/10,MN/BSA的色谱图Fig.6 Chromatogram diagram of MN,MN/10,MN/BSA

图7 Q,Q/10,Q/BSA的色谱图Fig.7 Chromatogram diagram of Q,Q/10,Q/BSA
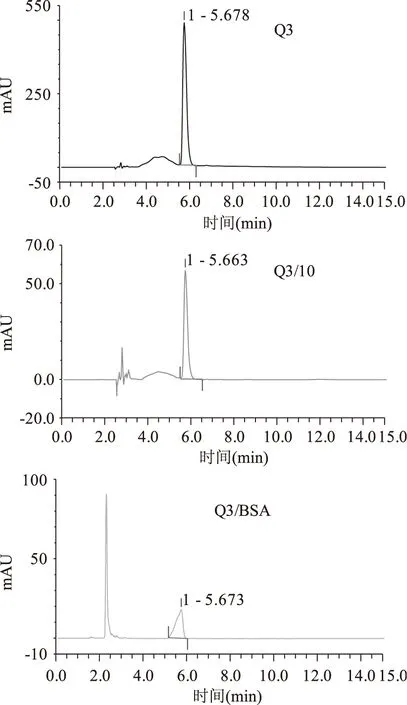
图8 Q3,Q3/10,Q3/BSA的色谱图Fig.8 Chromatogram diagram of Q3,Q3/10,Q3/BSA

图9 ISM,ISM/10,ISM/BSA的色谱图Fig.9 Chromatogram diagram of ISM,ISM/10,ISM/BSA
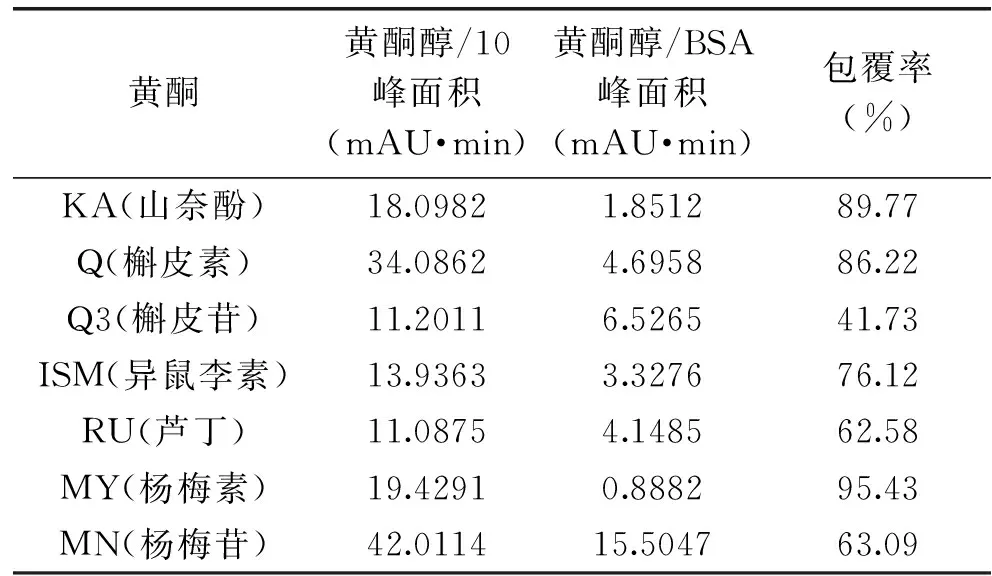
黄酮黄酮醇/10峰面积(mAU·min)黄酮醇/BSA峰面积(mAU·min)包覆率(%)KA(山奈酚)18.09821.851289.77Q(槲皮素)34.08624.695886.22Q3(槲皮苷)11.20116.526541.73ISM(异鼠李素)13.93633.327676.12RU(芦丁)11.08754.148562.58MY(杨梅素)19.42910.888295.43MN(杨梅苷)42.011415.504763.09

图10 黄酮类化合物及黄酮醇的基本结构Fig.10 Molecular structure of the flavonoid backbone and flavonol
2.3抗氧化活性
2.3.1DPPH自由基清除以清除率达到50%的样品浓度IC50值能更直接的评价被包覆前后黄酮醇类化合物对DPPH自由基的清除能力变化。从表2可看出,被包覆后的Q3/BSA,MY/BSA,MN/BSA,ISM/BSA纳米颗粒的IC50值都仅比包覆前的Q3,MY,MN,ISM高了不到10%;被包覆后的Q/BSA的IC50值为0.393×10-4mol/L,比包覆前高了29.5%;被包覆后的RU/BSA的IC50值比包覆前的RU高了47.9%;被包覆后的KA/BSA的IC50值比包覆前的KA高了54.6%。表明被包覆后的7种黄酮醇对DPPH自由基的清除能力都有所下降,其中山奈酚被包覆后的清除能力下降最为明显,芦丁其次,其余5种仅稍有下降。研究表明,槲皮素A环上的5-OH与BSA形成氢键后,使得槲皮素被包覆后的抗氧化能力轻微降低[20]。由此说明黄酮醇化合物具有抗氧化活性的基团参与到这种包覆作用中,从而使得包覆后的活性减弱。芦丁和山奈酚则可能是除A环上的5-OH外,B环上的-OH也参与形成了氢键,从而使得它们被包覆后抗氧化活性降低较大。
2.3.2ABTS自由基清除由表3可看出,被包覆后KA/BSA的IC50值比包覆前的高了38.3%,被包覆后RU/BSA的IC50值也比包覆前的RU高了近34.7%,说明被包覆后两者对ABTS自由基的清除能力下降的比较大。被包覆后的Q/BSA的IC50值比包覆前高了26.7%;被包覆后的Q3/BSA的IC50值比包覆前高了20.3%;被包覆后的MY/BSA的IC50值比包覆前高了46.1%;被包覆后的MN/BSA的IC50值比包覆前高了22.2%;被包覆后的ISM/BSA的IC50值比包覆前高了8.55%。表明被包覆后的7种黄酮醇对ABTS自由基的清除能力都有所下降,其中杨梅素被包覆后的清除能力下降最为明显,山奈酚,芦丁其次,其余4种也有不同程度的下降。由此说明除山奈酚和芦丁外,杨梅素B环上的-OH也可能参与形成了氢键。

表2 被包覆前后的黄酮醇类化合物对DPPH自由基的清除能力
注:表中包覆后样品的清除率已扣除BSA的影响。

表3 被包覆前后的黄酮醇类化合物对ABTS自由基的清除能力
注:表中包覆后样品的清除率已扣除BSA的影响。
3 结论与讨论
本实验中,利用DMSO使得BSA的部分三级结构的改变来运载疏水性的黄酮醇类化合物,通过BSA结构中的色氨酸基团与黄酮醇类化合物形成的非共价键的疏水作用力提供主要的结合力,这种弱相互作用使得BSA包覆黄酮醇分子形成表面亲水内部疏水的双层纳米核壳结构,有利于疏水性的黄酮醇在体内的运输,制得的蛋白质纳米核壳颗粒的粒径均在20 nm左右。据报道,Rahimnejad M et al.通过反溶剂法合成牛血清白蛋白纳米颗粒,采用调节温度、转速、pH等不同变量控制纳米粒径,但形成的纳米粒径均超过100 nm[21]。MaHam et al.提出小于50 nm的纳米载体可在淋巴系统的细胞间和细胞内自由分布,而更大的纳米载体容易被捕获排出体外而失效[18]。本次实验中制得的20 nm的蛋白质黄酮纳米核壳颗粒使得黄酮作为药物在淋巴系统的细胞间和细胞内运输过程更为通畅,且更不容易被捕获排出体外而失效。
通过对包覆率的测定发现,BSA对黄酮醇类化合物的包覆作用跟黄酮醇化合物的结构有很大的关系,其中黄酮醇A环上的7-羟基,有助于BSA对黄酮醇化合物的包覆,使得包覆率提高。但是黄酮的糖苷化则会使的包覆作用减弱,因为糖苷是大基团形成的位阻较大,不利于两者的相互作用。黄酮类化合物作为药物小分子经小肠吸收和代谢后在血液循环中与蛋白质结合,其与蛋白质的结合程度会影响黄酮类化合物及其代谢物的清除率和转运进入细胞和组织的速率[18]。因此研究不同黄酮类化合物与BSA的包覆率关系有助于提高黄酮的利用度。
综合2种抗氧化实验结果来看,黄酮醇被包覆后氧化能力都是下降的。黄酮的抗氧化能力通常要求A环5和7位,C环3位和B环存在羟基。在本实验中,槲皮素,槲皮苷,异鼠李素和杨梅苷包覆后的抗氧化活性都稍有降低,说明它们的A环上的5-OH与BSA参与形成了氢键,影响了包覆后的抗氧化活性。而杨梅素,芦丁和山奈酚则可能是除A环上的5-OH外,B环上的-OH也参与形成了氢键,从而使得它们被包覆后抗氧化活性降低较大。据文献[20]报道在模拟肠道流体(SIF)测定槲皮素包覆前后稳定性实验中,被包覆后Q/BSA纳米核壳颗粒显著提高了Q在SIF中的稳定性;这种包覆作用同时也保护了Q的抗氧化活性。因此合成牛血清白蛋白黄酮纳米核壳颗粒可以作为提高黄酮稳定性保护黄酮抗氧化活性实现黄酮较高生物利用度的一种新途径。
[1]杨冀艳,胡磊,许杨. 荷叶黄酮类化合物的研究进展[J]. 食品科学,2007,28(8):554-558.
[2]张国文,陈秀霞. 牛蒡苷与人血清白蛋白的相互作用[J]. 农产品加工学刊,2009,3:62-64.
[3]Calzada F,Meckes M,Cedillo-Rivera R. Antiamoebic and antigiardial activity of plant flavonoids[J]. Planta Medica.,1999,65(1):78-80.
[4]Friedman M,Ju¨rgens HS. Effect of pH on the stability of plant phenolic compounds[J]. Journal of Agricultural and Food Chemistry,2000,48(6):2101-2110.
[5]Jørgensen LV,Cornett C,Justesen U,et al. Two-electron electrochemical oxidation of quercetin and Kaempferrol changes only the flavonoid C-ring[J]. Free Radical Research,1998,29(4):339-350.
[6]M. J. Hawkins,P. Soon-Shiong and N. Protein nanoparticles as drug carriers in clinical medicine[J]. Advanced Drug Delivery Reviews,2008,60(8):876-885.
[7]F. Kratz,J.Albumin as a drug carrier:design of prodrugs,drug conjugates and nanoparticles[J]. Journal of Controlled Release,2008,132(3):171-183..
[8]Xiao JB,Kai GY,Yang F,et al. Molecular structure-affinity relationship of natural polyphenols for bovineγ-globulin[J]. Molecular nutritionand Food Research,2011,55(S1):S86-S92.
[9]Xiao JB,Mao FF,Yang F,et al. Interaction of dietary polyphenols with bovine milk proteins:Molecular structure-affinity relationship and influencing bioactivity aspects[J]. Molecular nutritionand Food Research,2011,55(11):1637-1645.
[10]Fang R,Hao jing,Zhi Chai et al. Study of the physicochemical properties of the BSA:flavonoid nanoparticle[J].European Food Research and Technology,2011,233(2):275-283.
[11]Pezeshki A,Vergote V,Van Dorpe S,et al.Adsorption of peptides at the sample drying step:influence of solvent evaporation technique,vial material and solution additive[J]. Journal of Pharmaceutical Biomedical Analsis,2009,49(3):607-612.
[12]Fang Ru,Hao Jing,Zhi Chai,et al. Design and characterization of protein-quercetin bioactive nanoparticles[J].Journal of Nanobiotechnology,2011,9(19):1-14.
[13]邓靖,莫正昌,汲广全等.蛇菰提取物体外抗氧化活性研究[J]. 食品科学,2010,31(5):23-25.
[14]R Re,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology Medicine,1999,26(9-10):1231-1237.
[15]Bhattacharjya S,Balaram P.Effects of organic solvents on protein structures:Observation of a structured helical core in hen egg-white lysozyme in aqueous dimethyl sulfoxide[J]. Proteins:Structure,Fuction and Bioinformation,1997,29(4):492-507.
[16]Liang M,Chen V,Chen H,et al. A simple and direct isolation of whey components from raw milk by gel filtration chromatography and structural characterization by Fourier transform Raman spectroscopy[J]. Talanta,2006,69(5):1269-1277.
[17]Liu C,Bo A,Cheng G,et al.Characterization of the structural and functional changes of hemoglobin in dimethyl sulfoxide by spectroscopic techniques[J]. Biochimica et Biophysica Acta,1998,1385(1):53-60.
[18]Xiao JB,Kai GY. A review of dietary polyphenol-plasma protein interactions:Characterization,influence on the bioactivity and structure-affinity relationship[J].Critical reviews in food science and nutrition,2012,52(1):85-101.
[19]Xiao JB,Chen TT,Cao H,et al. Molecular property-affinity relationship of flavanoids and flavonoids for human serum albumininvitro[J]. Molecular nutritionand Food Research,2011,55(2):310-317.
[20]Fang R,Hao jing,Wu X,et al. Bovine serum albumin nanoparticle promotes the stability of quercetin in simulated intestinal fluid[J]. Journal of Agricultural and Food Chemistry,2011,59(11):6292-6298.
[21]Rahimnejad M.,M. Jahanshahi,G. D. Najafpour.Production of biological nanoparticles from bovine serum albumin for drug delivery[J].African Journal of Biotechnology,2006,5(20):1918-1923.
Study on the preparation of BSA-Flavonols Nanoparticles and its antioxidant activity
YANG Chen1,XU Shu-wen2,CHEN Long-sheng2,LIU Hui3,WANG Kai3
(1.College of Environment and Life Science,Shanghai Normal University Shanghai 200235;2.Anhui institute of science and technology Anhui Hefei 230000;3.Anhui institute of application and technology Anhui Hefei 230088)
In this work,bovine serum albumin molecules and hydrophobic flavonols was used to formed bovine serum albumin/flavonols nano core-shell particles,the size of nanoparticle was determined by TEM,the adsorption capacity was analyzed by HPLC and the antioxidant activity of flavonol before and after being embedded was evaluated by DPPH and ABTS radical scavenging assays in the study. The result demonstrated that the size of nanoparticle was 20 nm.The conjugation of bovine serum albumin and flavonols affected the encapsulation of BSA. Moreover,the antioxidant activity group of flavonols formed an intermolecular hydrogen bond with BSA,making the activities of flavonols were hindered by the embedding of bovine serum albumin nanoparticle. The preparation of BSA/flavonoids nano core-shell particles would be a new way to promote the stability of flavonoids,preserve the antioxidant activity and achieve a higher bioavailability of flavonoids.
Bovine serum albumin;hydrophobic flavonols;nano core-shell particle;antioxidant activity
2015-01-28
李陈(1990-),硕士,E-mail:1805519828@163.com
TS
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000

