大孔吸附树脂纯化制备京尼平苷酸的研究
商 锋,尹 胜,2,肖 潇,王成涛,2,*,文雁君
(1.北京工商大学 北京市食品添加剂工程技术研究中心,北京 100048;2.食品质量与安全北京实验室,北京 100048;3.河南中大生物工程有限公司,河南郑州 451162)
大孔吸附树脂纯化制备京尼平苷酸的研究
商锋1,尹胜1,2,肖潇1,王成涛1,2,*,文雁君3
(1.北京工商大学 北京市食品添加剂工程技术研究中心,北京 100048;2.食品质量与安全北京实验室,北京 100048;3.河南中大生物工程有限公司,河南郑州 451162)
研究了大孔吸附树脂从栀子黄色素生产废液的京尼平苷碱水解液中纯化制备京尼平苷酸(GPA)的影响因素及工艺条件,比较了大孔吸附树脂对GPA的脱色、吸附及解吸附性能,确定了最佳制备工艺。结果表明,弱极性DA201树脂的脱色效果较好,且对GPA的吸附性差;非极性树脂DA201C对GPA的吸附率、解吸率较高,分别达到88.7%、98%。在树脂用量1 g/25 mL 10 mg/mL GPA粗提液稀释液、pH 4.0、25 ℃、120 r/min振荡6 h的条件下,DA201树脂的脱色率为85.9%,GPA保留率为92.3%。DA201C树脂高效吸附GPA的条件为10 mg/mL脱色液、pH3.0、上样速度1 BV/h、上样量7.2 BV。经25%乙醇溶液洗脱、干燥,制备的GPA纯度达到95.1%,回收率为86.2%。上述结果表明,在GPA的分离纯化中,DA201适用于脱色,DA201C适用于吸附和解吸。
京尼平苷,京尼平苷酸,大孔树脂,脱色,纯化
京尼平苷酸(GPA,图1A)属环烯醚萜类化合物,具有抗肿瘤[1]、抗衰化[2]、消炎利胆[3]、降血压[4]等药理作用,日本健康卫生部已将其作为一种保健食品添加剂。GPA经β-葡萄糖苷酶酶解脱糖后形成残基,再与不同的氨基化合物进行显色反应,可生成栀子红色素和栀子紫色素[5-7]两种具有重要开发价值的食用色素。在栀子、车前子、杜仲等植物含有一定量的GPA,可通过溶剂浸提后再用硅胶柱、制备色谱或大孔吸附树脂纯化得到[8-10]。由于上述原料的GPA含量极低,提取工艺相对复杂,难以规模化生产和满足市场需求。利用栀子黄色素生产废液转化是GPA制备的一种有效途径,栀子黄色素生产废液中含有丰富的京尼平苷(GP,图1B),通过碱水解GP、树脂纯化可制备GPA。此法不仅产量高、成本低,而且可以减小栀子黄色素废液的污染、提高资源利用率。
栀子黄废液中残存的栀子黄色素以及碱水解附带产生的杂色素是影响GPA色泽、纯度的主要因素之一。本文通过碱水解栀子黄废液提取物制备GPA粗提液,然后经过大孔吸附树脂,得到GPA纯化产品。本文的目的是探究大孔吸附树脂的脱色、吸附-解吸附等工艺对GPA制备纯度、回收率等方面的影响,旨在为系列栀子色素的研发提供材料。
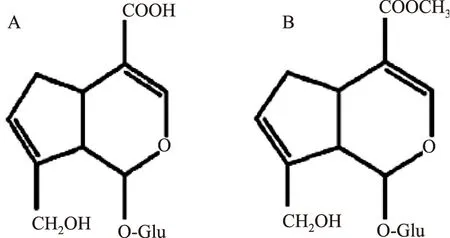
图1 京尼平苷酸和京尼平苷的结构式Fig.1 Structural formula of geniposidic acid and geniposide
1 材料与方法
1.1材料与仪器
GP和GPA(纯度≥98%)四川省维克奇生物科技有限公司;栀子黄生产废液提取物(含GP 90.73%)河南中大生物工程有限公司;GDX201、DA201、A型、H103、D101、S-8、HPD100A、HPD450、AB-8大孔吸附树脂郑州勤实科技有限公司;DA201C、HPD100、HZ816大孔吸附树脂上海一基实业有限公司;甲醇(色谱纯)赛默飞世尔科技(北京)有限公司;其他试剂均为国产分析纯。
20AT型高效液相色谱仪、UV-2450型紫外可见光分光光度计日本岛津公司;IKA RV10旋转蒸发仪德国IKA公司;FD-1B-80型冷冻干燥机南京普森仪器;HQ45型恒温摇床中国科学院武汉科学仪器厂;WE-1水浴恒温振荡器天津市欧诺仪器仪表有限公司;玻璃层析柱(26 mm×40 mm)北京瑞达恒辉科技发展有限公司;FE20型pH计梅特勒-托利多仪器(上海)有限公司;AKTA prime plus内置泵通用电气GE公司。
1.2实验方法
1.2.1树脂的预处理[11]将树脂用无水乙醇浸泡至充分溶胀,去除乙醇后用蒸馏水洗涤至无白色浑浊且无醇味,接着依次用5% NaOH溶液和5% HCl溶液浸泡3 h,最后用蒸馏水洗涤至中性,减压抽滤并在50 ℃下烘干,备用。
1.2.2GPA粗提液的制备准确称取一定质量的栀子黄生产废液提取物,加入两倍质量的蒸馏水,搅拌溶解,调节pH11.0,置于80 ℃的水浴摇床中,100 r/min,水解5 h。每隔20 min用10 mol/L NaOH溶液和10 mol/L的盐酸溶液调节一次pH,控制pH11.0±0.05。碱解结束后,冷却至室温,柠檬酸溶液调节pH3.0,抽滤去除不溶物,获得GPA粗提液,4 ℃保存备用。
1.2.3GPA的HPLC检测色谱柱为Sepax HP-C18柱(250 mm×4.6 mm×5 μm),流动相为甲醇∶水=70∶30,检测波长237 nm,流速0.6 min/mL,柱温30 ℃,进样量5 μL。
1.2.4树脂的筛选分别称取1.00 g预处理好的树脂,置于250 mL的三角瓶,加入50 mL GPA粗提液的稀释液(0.876 mg/mL),pH3.0、25 ℃、120 r/min条件下振荡24 h,测定脱色率、吸附率、吸附量。除去吸附后的残液,得到吸附饱和的树脂,向三角瓶中分别准确加入50 mL 95%的乙醇溶液,25 ℃,120 r/min条件下振荡24 h。计算解吸率。综合比较粗选出摇瓶脱色树脂和吸附-解吸GPA树脂。参考文献[12]方法,脱色率和解色率的计算公式如下:


式中,A前、A后、A解分别表示脱色前、脱色后及解吸液在450nm波长下溶液的吸光度值;V始、V解分别表示初始液和解吸液的体积。
吸附量、吸附率与解吸率计算公式如下:


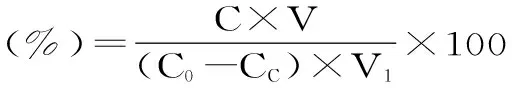
式中,C0-起始质量浓度(mg/mL),CC-平衡质量浓度(mg/mL),V1-吸附液体积(mL),m-树脂质量(g),C-解吸液质量浓度(mg/mL),V-解吸液体积(mL)。
1.2.5不同树脂对GPA粗提液脱色效果称取1.00g预处理好的脱色树脂,置于100mL的三角瓶,加入25mLGPA粗提液稀释液(10mg/mL),调节pH、25 ℃、120r/min条件下振荡一定时间,计算其脱色率、GPA保留率,绘制静态吸附动力学曲线,考察pH对脱色效果的影响。GPA保留率的计算公式如下:

式中,C后、C前分别表示脱色前后溶液中GPA的浓度。
1.2.6GPA的吸附与解吸附
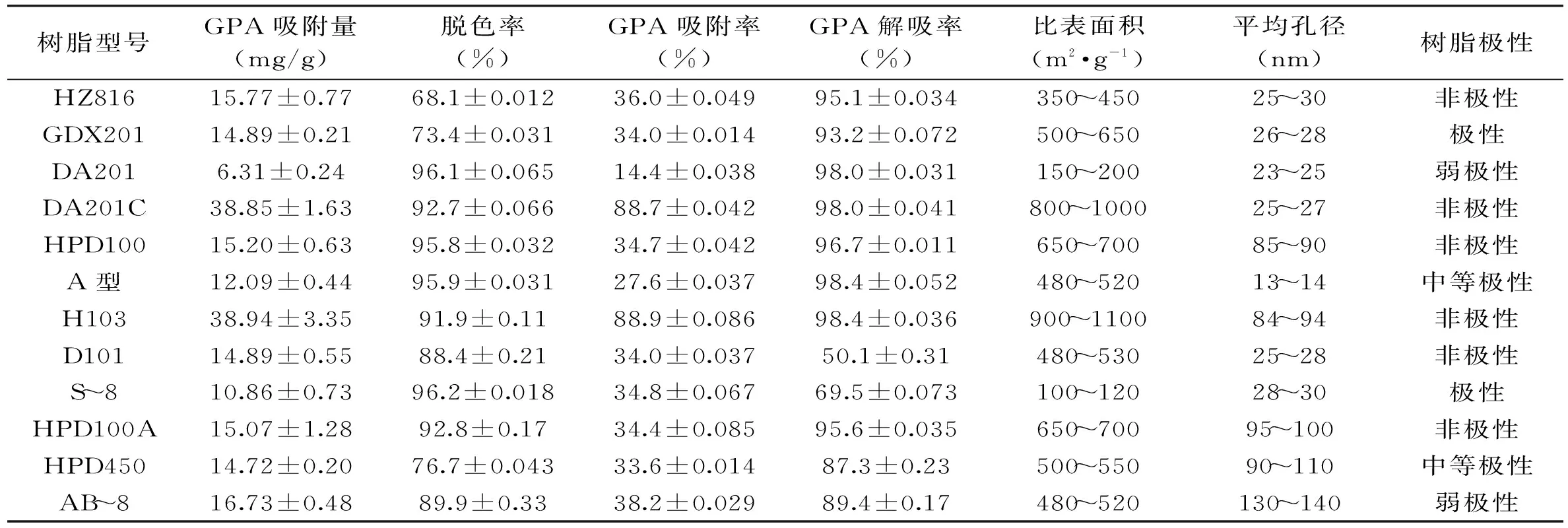
表1 大孔吸附树脂的粗筛对GPA的吸附、解吸附及脱色效果
1.2.6.1GPA的静态吸附与解吸分别称取1.00 g预处理好树脂,置于250 mL三角瓶,加入50 mL脱色后的GPA稀释液(0.876 mg/mL),调一定pH、25 ℃、120 r/min条件下振荡一定时间,计算脱色率、GPA吸附率,确定适宜树脂和pH,考察乙醇浓度对GPA脱附效果的影响。
1.2.6.2GPA的动态吸附与解吸将预处理好的树脂湿法装入玻璃层析柱(装柱量约385 mL),上样脱色后稀释液,上样浓度10 mg/mL、pH 3.0、速度1 BV/h(BV为柱体积),收集器收集流出液(0.1 BV/管),绘制动态吸附曲线,确定适宜上样液用量。上样结束后用1.5 BV的去离子水淋洗除杂,淋洗速度为2.5 BV/h。洗脱液洗脱,洗脱速度为0.5 BV/h,分管收集流出液(0.1 BV/管),绘制动态洗脱曲线,确定洗脱液用量。
1.2.7树脂重复利用次数根据1.2.5、1.2.6确定方法,在相同树脂柱上重复上柱、淋洗、洗脱,收集洗脱液浓缩、冻干,分别测定冻干粉中GPA的纯度、回收率,确定树脂的重复利用次数。
1.2.8统计分析测定结果以平均值±标准差(SD)(n=3)表示,利用SPSS17.0软件对实验数据进行单因素分析,置信度为95%(α=0.05),3次实验重复。
2 结果与讨论
2.1GPA的线性考察
按照1.2.3节方法测定GPA的含量并考察线性关系。结果表明,当GPA的进样浓度X在2.5~15 μg/mL之间时,与峰面积Y呈良好的线性关系,线性方程Y=7857.7X+3064.1(R2=0.9995)。
2.2大孔吸附树脂的粗筛
不同性质化合物因其在大孔吸附树脂上具有不同的吸附、解吸附能力,从而实现其分离纯化。选择不同极性、比表面积、孔径大小等12种大孔树脂,研究考察其对GPA化制备过程中的脱色、吸附、解吸能力。表1可知,12种树脂的脱色、吸附性、解吸性效果存在较大差异,其中DA201、HPD100、A型、S-8等4种树脂脱色率均高于95.0%;DA201树脂的脱色效果较好,且对GPA的吸附率仅为14.4%;非极性树脂DA201C和H103对GPA的吸附率、解吸率分别达到88.7%、98%和88.9%、98.4%,但对色素也有较高吸附性。因此确定采用DA201树脂先进行脱色,再用DA201C或H103树脂吸附、解吸附GPA的制备工艺。
2.3条件优化对GPA粗提液摇瓶脱色效果的影响
2.3.1吸附时间对摇瓶脱色效果的影响GPA粗提液稀释液(10 mg/mL)置于预处理好的DA201树脂中,25 ℃、120 r/min振荡一定时间,其脱色效果见图2。DA201树脂对GPA的吸附在1 h时基本达到饱和,GPA保留率保持在86.4%左右;随时间延长DA201树脂吸附色素不断增加,6 h时达到饱和,脱色率为77.2%。肖丽霞等[13]在研究脱色时间与香菇多糖脱色率的关系时也得到类似的变化趋势,可见吸附时间是影响脱色效果的一个重要因素。选择6 h作为摇瓶脱色时间。
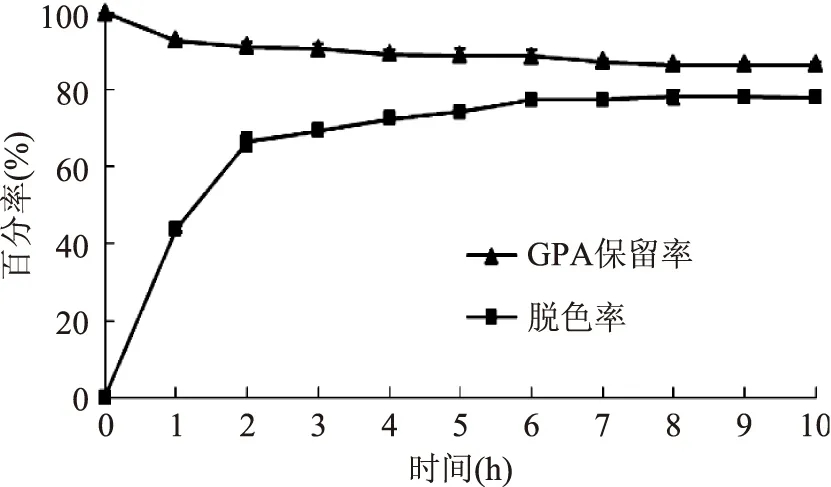
图2 吸附时间对脱色效果的影响Fig.2 Effect of adsorption time on the decolorization efficiency of resin DA201
2.3.2pH对树脂脱色效果的影响图3显示,GPA稀释液pH4.0~10.0条件下GPA保留率变化不大,均高于90.2%;随着其稀释液pH增加,脱色率显著不同(p<0.05),呈先增加后降低的趋势。pH4.0时,脱色效果最好,脱色率达91.7%。
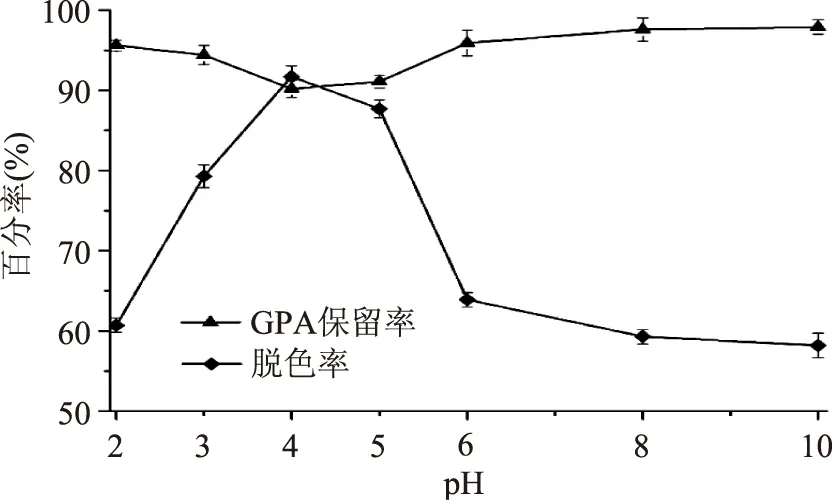
图3 pH对脱色效果的影响Fig.3 Effect of pH on the decolorization efficiency of resin DA201
2.3.3脱色验证实验按上述确定的脱色条件,调pH4.0,25 ℃,120 r/min振荡6 h,3组平行实验,分别计算各组溶液的脱色率及GPA保留率。结果表明,DA201树脂对GPA的保留率为(92.3±0.018)%,脱色率为(85.9±0.013)%,脱色效果较好。李国平等[14]采用FD802树脂对栀子黄废液进行脱色处理,得到栀子黄色素的去除率高于91%,本实验的结果低于这一水平,猜测原因是由于GPA粗提液中除含有大量的栀子黄色素外,还含有少量因高温碱水解附带产生的杂色素,其不易被树脂吸附,从而降低了脱色率。
2.4条件优化对GPA吸附和解吸附性能的影响
2.4.1GPA的静态吸附与解吸附作用
2.4.1.1DA201C和H103树脂对GPA静态吸附作用DA201C和H103树脂的吸附率均随吸附时间的延长而逐渐提高(图4),8 h时吸附作用基本达到饱和,两种树脂对GPA的吸附率均在92%左右。考虑到前8 h,树脂DA201C对GPA的吸附速率和吸附量明显高于H103,因此确定DA201C树脂作为吸附-解吸GPA的树脂。谢键泓等[15]比较不同大孔吸附树脂吸附-解吸GPA的性能,表明树脂H103效果最好,本实验经考察发现树脂DA201C吸附-解吸GPA的效果优于H103。
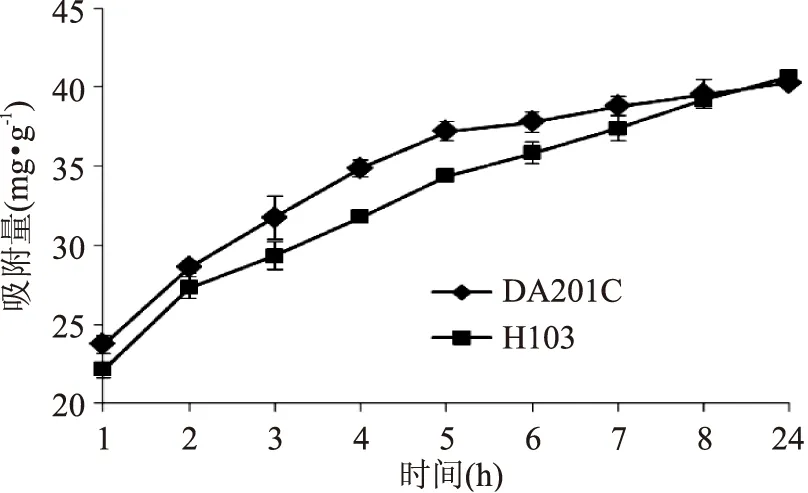
图4 静态吸附GPA动力学曲线Fig.4 The static adsorption dynamic curves of GPA
2.4.1.2pH对DA201C树脂吸附GPA能力的影响图5表明,pH2.0~4.0,DA201C树脂的吸附率无显著性变化(p>0.05),均高于87.1%;pH4.0~8.0范围时,随着pH递增DA201C对GPA的吸附率迅速下降。这可能是因为pH影响了化合物的解离度,GPA含有酸性羧基基团,在酸性条件下DA201C对解离的GPA具有更好交换吸附能力,提高了吸附率。曾超珍等[16]研究考察上样液pH对AB-8树脂吸附橙皮苷的影响时,也得到类似的结论。因此,选择上样液的pH=3.0。

图5 pH对DA201C树脂吸附GPA能力的影响Fig.5 Effect of pH on the adsorption efficiency of GPA by resin DA201C
2.4.1.3乙醇浓度对DA201C树脂解吸附GPA性能的影响随着乙醇浓度增加,GPA和色素均不断解吸(图6)。乙醇浓度>25%时,GPA解吸率增加缓慢,而色素解吸率却增加显著(p<0.05)。色素的解吸附影响GPA的色泽、纯度,综合考虑GPA解吸率、色素解吸率、节约乙醇等指标,选择25%乙醇溶液作为洗脱液。

图6 乙醇浓度对DA201C树脂解吸附GPA性能的影响 Fig.6 Effect of ethanol concentration on the elution efficiency of GPA by resin DA201C
2.4.2GPA的动态吸附与解吸实验
2.4.2.1GPA的动态吸附曲线GPA脱色液经DA201C树脂柱的动态吸附曲线见图7,上样液量<6BV时,洗脱液中未检测到GPA,表明DA201C树脂尚未达到吸附饱和;上样量>6 BV,洗脱液中GPA浓度逐渐增加;当上样液量>7.5 BV时,洗脱液中GPA浓度显著增加(p<0.05)。洗脱液中GPA的浓度为上样液浓度的1/10时达到洗脱点[17],因此确定上样体积为7.2 BV。

图7 GPA的动态吸附曲线Fig.7 The dynamic adsorption kinetics curve of GPA
2.4.2.2GPA的动态洗脱曲线7.2 BV上样体积的GPA脱色液经DA201C树脂柱吸附后进行洗脱(图8),随着洗脱液用量的增加,GPA被不断洗脱,洗脱峰尖锐且对称。当洗脱液用量为1.1 BV时,GPA浓度达到最大值115.36 mg/mL。考虑减少乙醇用量,选择洗脱液用量为2 BV,并收集0.6~2 BV范围内的洗脱液浓缩、冷冻干燥。
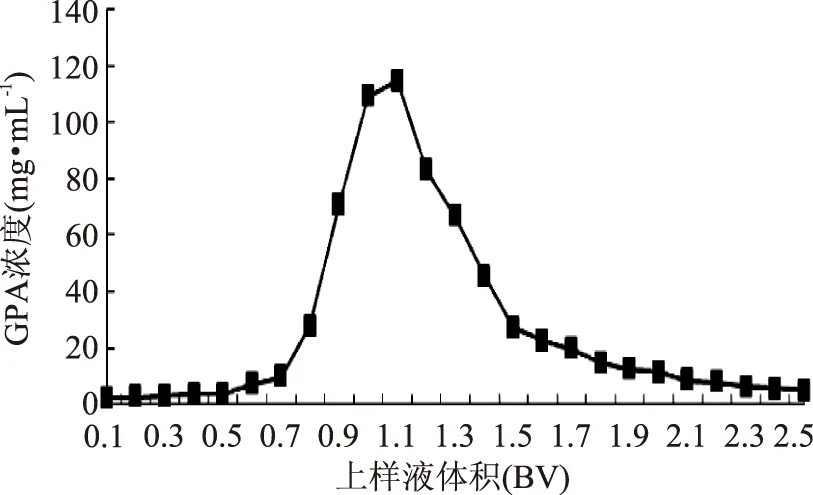
图8 GPA的动态洗脱曲线Fig.8 The dynamic elution kinetics curve of GPA
2.5树脂的利用次数
DA201C树脂经活化再生后可重复使用,但随着分离纯化样品次数的增加,降低树脂分离效果和目标成分回收率。图9中DA201C树脂重复使用4次时,京尼平苷酸纯度>89.9%,回收率>86.2%;第5~6次时,GPA纯度、回收率明显下降(p<0.05),说明DA201C树脂吸附基团及吸附杂质的累积明显影响了树脂吸附性能。本实验得到的GPA纯度、回收率高于曹慧[18]等报道的84.06%、77.18%,但略低于谢键泓等[15]报道的96.1%、95.2%。

图9 树脂使用次数对GPA纯度和回收率的影响Fig.9 Effect of resin repeated uses on the recoveries and purities of GPA
3 结论
研究了大孔吸附树脂纯化制备GPA的影响因素及工艺条件。结果表明,在GPA的分离纯化中,DA201树脂适用于脱色,DA201C树脂适用于吸附和解吸附。DA201树脂的摇瓶脱色条件为树脂用量1 g/25 mL 10 mg/mL GPA粗提液稀释液、pH4.0、25 ℃、120 r/min振荡6 h,该条件的GPA保留率为92.3%,脱色率为85.9%。DA201C树脂吸附-解吸附制备GPA的条件为10 mg/mL脱色液、pH3.0、上样速度1 BV/h、上样量7.2 BV;上样结束后,25%乙醇溶液洗脱,洗脱速度0.5BV/h,洗脱液用量2 BV,收集0.7~2.0 BV范围内的洗脱液浓缩、干燥。按上述工艺树脂重复使用次数为4次,GPA纯度最高达95.1%。
[1]Hsu HY. Comparisons of geniposidic acid and geniposide on antitumor and radioprotection after sublethal irradiation[J]. Cancer Letters,1997,113(1):31-37.
[2]Li Y,Metori K,Koike K,et al. Improvement in the Turnover Rate of the Stratum Corneum in False Aged Model Rats by the Administration of Geniposidic Acid in Eucommia ulmoides Oliver Leaf[J]. Biological & Pharmaceutical Bulletin,1999,22(6):582-585.
[3]金鑫,孙静,谢文莉,等. 京尼平苷酸对佐剂性关节炎大鼠抗炎作用及滑膜细胞凋亡机制研究[J].中国中药杂志,2009,34(23):3082-3086.
[4]Takeshi D,Sansei N,Yoshihisa N. Constituents and Pharmacologieal effects of Eucommia and Siberian glnseng[J]. Acta Pharmacologica Sinica,2001,22(12):1057-1070.
[5]Fang S,Jiang W,Cao J,et al. Conversion Process of High Color Value Gardenia Red Pigment[J]. Lecture Notes in Electrical Engineering,2015.
[6]Moritome N,Kishi Y,Fujii S. Properties of red pigments prepared from geniposidic acid and amino acids[J]. Journal of the Science of Food & Agriculture,1999,79(6):810-814.
[7]陈小梅,黄为民,陈桂芳,等. 栀子紫色素制备及其稳定性研究[J].中国食品添加剂,2014,3:120-124.
[8]Deyama T,Ikawa T,Kitagawa S,et al. The Constituents of Eucommia ulmoides OLIV. IV. Isolation of a New Sesquilignan Glycoside and Iridoids(Organic,Chemical)[J]. Chemical & Pharmaceutical Bulletin,1986,34(12):4933-4938.
[9]邹登峰,何翠微,朱华,等. 制备色谱法制备京尼平甙酸[J]. 化学工程师,2005,120(9):7-8.
[10]李湘洲,胡文彬,张胜,等. 大孔吸附树脂纯化杜仲叶加工剩余物中的京尼平苷酸[J].光谱实验室,2012,29(4):101-109.
[11]陈晓侠,宋渊,张纪柏,等. 吸附树脂对蛹虫草黄酮纯化工艺条件优化[J].食品科学,2015(4):68-73.
[12]罗玺,唐庆九,张劲松,等. 灵芝多糖树脂法脱色工艺优化[J].食品科学,2011,32(16):5-10.
[13]肖丽霞,于洪涛,胡晓松. 香菇多糖的树脂脱色工艺研究[J]. 食品与机械,2011,27(6):241-244.
[14]李国平,陈剑锋,许明塔,等. 高纯度京尼平苷的分离纯化[J]. 现代化工,2007,S2:386-389.
[15]谢键泓,曾彦雯,梁华正,等. 碱水解栀子苷大孔树脂分离纯化京尼平苷酸[J].食品科技,2011,(11):226-229.
[16]曾超珍,刘志祥,韩磊. 大孔树脂法纯化柑橘皮中的橙皮甙及其油脂抗氧化活性研究[J].中国食品学报,2012,12(3):119-124.
[17]刘长江,栾云峰,王菲,等. 大孔吸附树脂分离纯化软枣猕猴桃总黄酮[J].食品科学,2011,32(12):145-148.
[18]曹慧,陈晓青,肖建波,等. A型吸附树脂分离纯化杜仲中京尼平甙酸[J].离子交换与吸附,2005,21(5):415-423.
Purification and preparation of geniposidic acid by macroporous resin
SHANG Feng1,YIN Sheng1,2,XIAO Xiao1,WANG Cheng-tao1,2,*,WEN Yan-jun3
(1.Beijing Engineering and Technology Research Center of Food Additives,Beijing 100048,China;2.Beijing Laboratory of Food Quality and Safety,Beijing Technology and Business University(BTBU),Beijing 100048,China;3.Henan Zhongda Biological Engineering Co.,Ltd.,Zhengzhou 451162,China)
The factors and process conditions on purification and preparation of geniposidic acid from alkaline hydrolyzate of exhausted solution of gardenia yellow by macroporous resin were studied. The optimum technology of the preparation of GPA was found according to the decolorization and adsorption-desorption performance of GPA by different resins. The results showed that DA201 weak polar resins had the best decolorization performance and poor absorption of the GPA;DA201C non-polar resin had higer adsorption rate and desorption rate,reaching 88.7% and 98%,respectively. When the amount of resin was 1 g/25 mL 10 mg/mL of GPA crude liquid,pH 4.0,25 ℃,120 r/min,decoloration time 6 h,the decolorization rate reached 85.9%,GPA retention rate reached 92.3%.The optimum conditions for DA201C resin adsorption of GPA were as follows:destaining solution concentration 10 mg/mL,pH 3.0,adsorption velocity 1 BV/h,sample volume 7.2 BV. After eluting with 25% ethanol and drying the eluent,a purity of GPA of 95.1% and a recovery rate of 86.2% were obtained. It showed that DA201 resin was suitable for decolorization and DA201C resin was suitable for adsorption-desorption of GPA on purification and preparation.
Geniposidic;Geniposidic acid;Macroporous resin;Purification;Decolorization
2015-06-03
商锋(1989-),男,硕士研究生,研究方向:天然食用色素生物制备技术,E-mail:yuexifenghe@126.com。
王成涛(1969-),男,博士,教授,研究方向:食品生物技术,E-mail:wct5566@163.com。
北京市科技计划项目(Z151100001215008);国家高新技术研究发展计划(863计划)项目(2012AA021502);北京市属高等学校食品科学创新团队项目(IDHT20130506)资助。
TS201.1
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000
——以渤海S油田为例

