0 ℃气调包装对鲟鱼籽酱(Husodauricus×Acipenserschrenckii)挥发性成分的影响及分析
周 婷,何 丹,黄 卉,郝淑贤,*,李来好,魏 涯,岑剑伟
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 510300;2.上海海洋大学食品学院,上海 201306)
0 ℃气调包装对鲟鱼籽酱(Husodauricus×Acipenserschrenckii)挥发性成分的影响及分析
周婷1,2,何丹1,2,黄卉1,郝淑贤1,*,李来好1,魏涯1,岑剑伟1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 510300;2.上海海洋大学食品学院,上海 201306)
采用固相微萃取(SPME)结合气相色谱-质谱(GC-MS)联用技术,测定不同气调包装对鲟鱼籽酱0 ℃冷藏过程中挥发性物质的影响。结果表明:醛类是鲟鱼籽酱的主要气味贡献物质,其中己醛是鲟鱼籽酱最重要的风味成分。气调包装可较大程度地增加己醛的相对含量,含量最高可达到13.70%。与对照组相比,气调包装组鲟鱼籽酱具有更浓的脂肪味,青草味和鱼腥味,尤其是在储藏3月时格外明显,此时气味成分最丰富。气调包装具有一定的抑制不饱和脂肪酸的氧化和氨基酸降解的作用,减少了酮类和醇类物质的变化。另外,气调组CO2浓度最低的MAP4组(30% CO2+70% N2)在储藏过程中一些挥发性物质变化如醇类和酯类与其他气调组差异较大,验证了水产品的气调包装CO2浓度不可过低。气调包装对鲟鱼子酱的气味以及对货架期的延长方面具有显著影响。
鲟鱼籽酱,气调包装,固相微萃取,气相色谱-质谱联用,挥发性成分
鲟鱼籽酱是从雌性鲟鱼卵巢中的结缔组织中分离得到的鱼籽,经过筛选,盐渍而制得的产品[1]。鲟鱼籽酱营养价值极高,富含人体必需氨基酸和不饱和脂肪酸、无机盐、多种维生素以及微量元素,口感极佳,与鹅肝、松露并称为“世界三大美食”,价格昂贵,素有“黑色黄金”之称,是国际上经久不衰的名贵高档食品[2]。鲟鱼籽酱受感官质量限制,产品在加工过程中一般不经巴氏杀菌处理,又因富含蛋白质(22%~28%)和脂肪(15%~78%),因此在贮藏过程中,极易受到微生物和生化腐败的影响[2],因而鲟鱼籽酱的保藏方法非常重要。
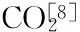
气味是确定水产品品质质量的重要因素,作为鲜鱼特征挥发性成分的醛和酮含量随着腐败过程中酶[12]和微生物[13]的作用而改变。已有多篇报道指出,通过挥发性成分的变化能对水产品的贮藏质量进行一定的评估[14-16]。固相微萃取(SPME)结合气相色谱-质谱(GC-MS)的联用技术近年来被广泛用于研究水产品挥发性有机化合物[17]。为此,本文采用SPME-GC-MS方法,对不同气调包装的鲟鱼籽酱挥发性成分进行了比较分析,鉴定并确定了鲟鱼籽酱冷藏过程中的挥发性成分,以此来体现气调包装对冷藏鲟鱼籽酱气味品质和货架期的影响。
1 材料与方法
1.1材料与仪器
达氏鳇×史氏鲟杂交鱼籽酱(Husodauricus×Acipenserschrenckii)杭州千岛湖鲟龙科技股份有限公司提供。
复合气调保鲜包装机(MAP-D400型)苏州森瑞保鲜设备有限公司;PC-420D手动SPME进样手柄,DVB-PDMS 65 μm萃取头美国Supelco公司;CNW18-400顶空进样瓶上海安普科学仪器有限公司;GCMS-QP2010气质联用仪日本岛津公司。
1.2实验方法
1.2.1样品处理将鱼籽酱随机分为5组,一组为无处理对照组(MAP0),其余4组为不同气调包装组,分别为:MAP1(100% CO2),MAP2(70% CO2+30% N2),MAP3(50% CO2+50% N2),MAP4(30% CO2+70% N2)。每组分为6份,每份5 g,分别装入高阻隔PET/PT包装袋内(12 cm×12 cm),用复合气调保鲜包装机进行气调包装,充气体积与样品重量比约为3∶1,置于0 ℃(±2 ℃)冰箱冷藏。分别在样品处理前(0月)和贮藏1、2、3、4、5个月时每组取一份鲟鱼籽酱进行挥发性成分的测定。
1.2.2固相微萃取取1 g用研钵研磨过的鲟鱼籽酱,倒入15 mL顶空样品瓶中,按料液比1∶3(m/v)比例加3 mL饱和食盐水,置于磁力搅拌台上。将65 μm DVB-PDMS萃取头插入样品瓶顶空部位,在萃取温度60 ℃、磁力搅拌条件下平衡10 min,顶空萃取40 min后取出萃取头,迅速用气质联用仪进行分析鉴定[17]。每次实验重复3次。
1.2.3色谱条件色谱柱:DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm);程序升温:柱初温40 ℃,保持4 min,以6 ℃/min的速度升温到200 ℃保持5 min,再以10 ℃/min上升到250 ℃保持5 min;载气:氦气,流量1.0 mL/min;采用恒线速度,分流比为 1∶20;不分流进样,进样口温度为250 ℃。
1.2.4质谱条件电子轰击离子源;离子源温度230 ℃;电子能量70 eV;溶剂切除时间2 min;传输线温度270 ℃;质量扫描范围50~400 m/z。
1.2.5定性分析化合物经计算机检索,与Wiley Library(32万种化合物,Version 6.0)和NIST Library(10.7万种化合物)相匹配,取匹配度85%以上者;同时,参考相关文献对实验中检测到的物质核对和确认。
1.2.6定量分析按峰面积归一化法计算化合物相对百分含量。
1.2.7数据处理实验采用三个平行样取平均值,最终采用Excel 2007和origin进行数据处理与制图。
2 结果与分析
2.1不同气调包装鲟鱼籽酱0 ℃冷藏期间挥发性物质总量变化

图1 不同气调包装鲟鱼籽酱冷藏期间挥发性物质总量比较Fig.1 Comparison of total volatile compound content in different MAP sturgeon caviar during storage
鲟鱼籽酱是轻盐制品,在储藏过程中发生发酵达到一个风味最佳期,而后开始腐败。由图1可知,气调包装鱼籽酱(MAP1、MAP2、MAP3和MAP4)的挥发性成分总体含量变化一致:先增加到3个月时达到峰值,然后逐渐减小。然而对照组鲟鱼籽酱的挥发性成分总体含量在储藏2个月时出现一个高峰,在储藏5个月时达到最大值,这可能是由于对照组鲟鱼籽酱在储藏5个月时开始腐败,腐败气味变浓造成。由此可初步推断,气调包装在一定程度上可延长鲟鱼籽酱的保藏期。
2.2不同气调包装鲟鱼籽酱0 ℃冷藏期间挥发性组成变化
采用SPME-GC-MS法检测出不同气调包装处理鲟鱼籽酱的挥发性物质,这些物质主要为醛类、酮类、醇类、酸类、酯类和烃类等,含量组成状况见图2。
醛类物质大多由脂肪氧化、烷氧基自由基分解产生[18]。气调包装组MAP2、MAP3和MAP4组在3月份的醛类物质百分含量达到最高,MAP1在储藏4个月时的醛类含量达到最高,而对照组鳟鱼籽酱在贮藏1个月时达到峰值,随后呈现下降趋势,可能是由于醛类在储藏后期进一步氧化为酮类导致醛类物质的减少。对照组的酮类物质一直高于气调包装组,酮类物质是脂肪酸氧化的最终产物[18]且与氨基酸的降解有关[19],由此可知,气调包装对脂肪酸的进一步氧化以及氨基酸的降解具有一定的抑制作用。对于醇类物质,鲟鱼籽酱在储藏期间大致都是增加的趋势(除MAP4外),这可能是由于在脂肪氧合酶的作用下鲟鱼籽酱发生脂肪氧化生成饱和醇导致。其中对照组的变化幅度明显大于气调包装组,这更加验证了气调包装的处理能有效抑制鲟鱼籽酱的脂肪氧化,减少了酮类和醇类物质的变化。酸类物质在对照组储藏到2个月时骤减到几乎消失,而气调组则是在储藏3个月时完全消失,此时烷烃类物质相对增加,可能是由于酸类物质在一定条件下形成烃类物质。酯类物质由脂质代谢生成的羧酸和醇经酯化反应形成,酯类物质呈现先增加后减少的趋势,对照组在储藏2个月时减少,气调组则是在3个月时出现骤减,与酸类物质的变化相一致。对照组的酯类物质在储藏期间含量极少,气调组的酯类含量显著高于对照组(除MAP4外),酯类物质大多赋予食品一种果香或花香味[20],可见气调包装的鲟鱼子酱会有更重的果香和花香的气味。综上所得,MAP4组在储藏中一些挥发性物质变化如醇类和酯类与其他气调组差异较大,说明水产品中气调包装CO2浓度不可过低,验证了水产品在气调包装中倾向于更高浓度的CO2。而MAP1、MAP2、MAP3 组间变化规律组间差异不显著。结果说明气调组中挥发性物质的变化趋势滞后于对照组约一个月左右,这与由图1的变化趋势基本一致。
2.3不同气调包装鲟鱼籽酱在0 ℃冷藏期间主要挥发性物质的分析
气调包装鲟鱼籽酱贮藏过程中共测得挥发性物质40余种,主要有27种(见表1),其中具有风味活性的物质有15种,主要为羰基类和烃类(见表2)。其中具有脂肪味、青草味的己醛和2,4-庚二烯醛的相对含量尤为突出,可分别达到13.70%(3MAP3),12.26%(5MAP3),且气调组中的己醛和2,4-庚二烯醛相对含量显著高于对照组。己醛阈值较低(4.5 μg/kg),是食品气味的主要贡献物质[21]。己醛,3-甲硫基丙醛,辛醛,壬醛,癸醛等低级饱和醛通常被认为是鱼腥味的代表物质[29]。由表1可得,在储藏3个月时对照组中低级饱和醛类总量高于对照组,又由图1可知,在储藏3月时,对照组的挥发性物质总量低于气调组(略高于MAP1),可见气调包装的处理促使鲟鱼籽酱在储藏3月时形成更浓的脂肪味、青草味和鱼腥味。

表2 不同气调包装鲟鱼籽酱0 ℃冷藏过程 特征挥发性物质的阈值和气味描述Table 2 The odor threshold and odor description of volatile compounds in different MAP caviars during 0 ℃ cold storage

表1 不同气调包装鲟鱼籽酱0 ℃冷藏过程中主要挥发性物质及其相对含量(%)Table 1 Changes in volatile compounds and their relative contents in different MAP caviars during 0 ℃ cold storage(%)
注:(1)“-”为未检出;(2)以上数据为三次平行实验的平均值;(3)MAP0、MAP1、MAP2、MAP3、MAP4分别代表:对照组、100% CO2、70% CO2+30% N2、50% CO2+50% N2、30% CO2+70% N2气调处理的鲟鱼籽酱;MAP0、MAP1、MAP2、MAP3、MAP4前面的数字分别代表对应的储藏月数。
实验测得鲟鱼籽酱中的酮类物质主要有1-辛烯-3-酮、3-辛酮、2,5-辛二酮和3,5-辛二烯-2-酮(见表1)。1-辛烯-3-酮具有蘑菇味[25];2,5-辛二酮在新鲜淡水鱼中相对含量较高,与烯醇和烯醛类化合物协同作用构成了淡水鱼特有的土腥味[30];3-辛酮有类似熏衣草的草药气味[26-27];3,5-辛二烯-2-酮等对肉味香精的香气有重要贡献[31]。通常情况下,酮类物质的阈值较高、含量少,一般认为它们对气味特征贡献较小。
烃类物质主要是3,5-辛二烯、乙苯、α-蒎烯、右旋柠檬烯、长叶烯、石竹烯、2,4,10,14-四甲基十五烷(见表1)。其中,长叶烯、石竹烯具有木香、温和的丁香香气[28];2,4,10,14-四甲基十五烷具有青草味,甜味的气味特征[28]。但烃类物质的阈值较大,通常认为对食品的风味贡献不大[32-33]。一些烯烃类物质,如检测出的3,5-辛二烯可能在一定条件下会形成醛类物质[21],由表1可得,对照组在储藏3月时,3,5-辛二烯的相对含量高达22.63%,而此时气调组并未检测到3,5-辛二烯,结合对照组和气调组分析,此时醛类物质的含量差异显著,推测3,5-辛二烯可能由于特定原因转化成了醛类物质。
3 结论
本研究利用顶空固相微萃取法萃取不同气调包装鲟鱼籽酱挥发性物质,经气相色谱-质谱联用技术检测鉴定,共检出40余种挥发性成分,其中醛、烷烃类物质含量较高。尤其是具有脂肪味、青草味的己醛,是形成鲟鱼籽酱的最重要风味物质。气调包装鲟鱼籽酱在储藏3个月时气味成分最丰富,气调包装促使鲟鱼籽酱具有更加浓厚的脂肪味、青草味和鱼腥味。综合不同气调包装鲟鱼籽酱0 ℃冷藏期间挥发性物质总量变化以及挥发性组成变化的分析,气调包装在延长鲟鱼籽酱保藏期方面具有显著效果,尤其是具有抑制脂肪酸氧化的作用,减少了酮类醇类物质的变化。除MAP4组外不同气调包装挥发性成分的数量及总量变化规律差异不显著,建议采用气调包装处理鲟鱼籽酱时保持CO2浓度30%以上。本研究通过不同气调包装鲟鱼籽酱冷藏过程中挥发性成分的变化进行保鲜效果分析,但仅通过挥发性物质的测定无法确定气调的保鲜结论是否合理,需进一步结合其他指标进行全面的分析。
[1] 郝淑贤,何丹,魏涯,等. 鱼卵加工产品类型与鱼籽酱保鲜技术研究进展[J]. 南方水产科学,2014,10(3):104-108.
[2]郝淑贤,李晓燕,李来好,等. 鲟营养组成、高值化加工利用及质量安全研究进展[J]. 南方水产科学,2014,10(6):101-106.
[3]Vazhiyil V. Seafood Processing:Adding Value ThroughQuick Freezing,Retortable Packaging,Cooking-Chilling and Other Methods[M]. Florida CRC Press Traylor and Francis Group,2006:167-196.
[4]Ruiz C,Moral A.Free amino acids in muscle of Norway lobster(Neprops novergicus)in Controlled and modified atmosphere during chilled storage[J].Food Chemistry,2004,86(1):85-91.
[5]Metin S,Erkan N,Baygar T,et al. Modified atmosphere packaging of fish salad[J]. Fisheries Science,2002,68(1):204-209.
[6]Dalgaard P,Gram L,Huss H H. Spoilage and shelf-life of cod fillets packed in vacuum or modified atmospheres[J]. International journal of food microbiology,1993,19(4):283-294.
[7]L. Lauzon Hélène,Margeirsson Björn,Arason Sigurjon,et al. Conservation of fresh golden redfish(Sebastes marinus)fillets:influence of bleeding,modified atmosphere packaging using different gas mixtures and superchilling on quality deterioration[J]. 2012,26(2):185-191.
[8]Randell K,Hattula T,Ahvenainen R. Effect of packaging method on the quality of rainbow trout and Baltic herring fillets[J]. LWT-Food Science and Technology,1997,30(1):56-61.
[9]Garthwaite G. Chilling and freezing of fish[M]. Fish Processing Technology. Springer. 1997:93-118.
[10]Turan H,Kocatepe D. Different MAP conditions to improve the shelf life of sea bass[J]. Food Science and Biotechnology,2013,27(2):195-200.
[11]Bouletis A D,Arvanitoyannis I S,Hadjichristodoulou C,et al. The effect of modified atmosphere packaging on the microbiological,physical,chemical and sensory characteristics of broadtail squid(Illex coindetii)[J]. International Journal of Food Science & Technology,2013,49(2):329-336.
[12]Selli S,Cayhan G G. Analysis of volatile compounds of wild gilthead sea bream(Sparus aurata)by simultaneous distillation-extraction(SDE)and GC-MS[J]. Microchemical Journal,2009,93(2):232-235.
[13]Joffarud J J,Leroi F,Roy C,et al. Characterisation of volatile compounds produced by bacteria isolated from the spoilage flora of cold-smoked salmon[J]. International journal of food microbiology,2001,66(3):175-184.
[14]Edirisinghe R K B,Graffham A J,Taylor S J. Characterisation of the volatiles of yellowfin tuna(Thunnus albacares)during storage by solid phase microextraction and GC-MS and their relationship to fish quality parameters[J]. International Journal of Food Science & Technology,2007,42(10):1139-1147.
[15]Duflos G,CoinvmV M,Cornu M,et al. Determination of volatile compounds to characterize fish spoilage using headspace/mass spectrometry and solid-phase microextraction/gas chromatography/mass spectrometry[J]. Journal of the Science of Food and Agriculture,2006,86(4):600-611.
[16]Soncin S,Chiesa L M,Panseri S,et al. Determination of volatile compounds of precooked prawn(Penaeus vannamei)and cultured gilthead sea bream(Sparus aurata)stored in ice as possible spoilage markers using solid phase microextraction and gas chromatography/mass spectrometry[J]. Journal of the Science of Food and Agriculture,2009,89(3):436-442.
[17]赵景丽. 金华火腿风味形成过程中游离氨基酸参与的美拉德反应研究[D]. 郑州:河南农业大学,2013.
[18]丁丽丽,吴燕燕,李来好,等. 咸带鱼加工过程挥发性风味成分的变化[J]. 食品科学,2012,32(24):208-212.
[19]Alasalvar C,Taylor K D A,Shahidi F. Comparison of volatiles of cultured and wild sea bream(Sparus aurata)during storage in ice by dynamic headspace analysis/gas chromatography-mass spectrometry[J]. Journal of agricultural and food chemistry,2005,53(7):2616-2622.
[20]黄卉,何丹,李来好,等.复合添加剂对鲟鱼籽酱(Husodauricused×sturgerschrenckii)挥发性成分的影响[J]. 食品科学,2015,36(12):97-103.
[21]李来好,丁丽丽,吴燕燕,等. 咸鱼中的挥发性风味成分[J]. 水产学报,2012,36(6):979-988.
[22]孙宝国. 特征香味含硫食品香料化合物[J]. 食品科技,2006,31(7):173-175.
[23]卢春霞,翁丽萍,王宏海,等.3种网箱养殖鱼类的主体风味成分分析[J].食品与工业发酵,2010,36(17):163-169.
[24]张智翠,薛长湖,李兆杰,等. 牡蛎在冻藏过程中气味物质的变化[J]. 食品工业科技,2006,27(10):170-172.
[25]何洁,宋焕禄,陈耿俊,等. 宣威火腿中香味活性化合物的分析[J]. 食品科技,2008,33(10):78-82.
[26]赵建新,顾小红,刘杨岷,等. 传统豆酱挥发性风味化合物的研究[J]. 食品科学,2007,27(12):684-687.
[27]张智翠. 太平洋牡蛎品质的季节性变化及贮藏过程中的生化变化[D]. 青岛:中国海洋大学,2006.
[28]刘奇,郝淑贤,李来好,等. 鲟鱼不同部位挥发性成分分析[J]. 食品科学,2012,33(16):142-145.
[29]李阳,汪超,胡建中,等. 冻藏前后白鲢鱼肉中挥发性成分含量分析[J]. 质谱学报,2014,35(1):59-65.
[30]黄骆镰,黄克,肖如武. 水产品腥昧物质形成机理的研究进展[J]. 广东化工,2009,36(9):146-151.
[31]刘红,杨荣华,戴志远,等. 利用鲢鱼制备肉味香精及其香气成分的分析[J]. 中国食品学报,2010,10(2):149-153.
[32]徐为民,徐幸莲,周光宏,等. 风鹅加工过程中挥发性风味成分的变化[J].中国农业科学,2007,40(10):2309-2315.
[33]Toldrá F. Proteolysis and lipolysis in flavour development of dry-cured meat products[J]. Meat Science,1998,1(49):101-110.
Effect and analysis of MAP on volatile flavor compounds in sturgeon(Husodauricused×sturgerschrenckii)caviar
ZHOU Ting1,2,HE Dan1,2,HUANG Hui1,HAO Shu-xian1,*,LI Lai-hao1,WEI Ya1,CEN Jian-wei1
(1. National R & D Center for Aquatic Product Processing,Key Laboratory of Aquatic Product Processing,Ministry of Agriculture,South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510300,China;2.College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
Volatile compounds in different MAP sturgeon caviars during 0 ℃ cold storage were analyzed by combining solid phase micro-extraction(SPME)with gas chromatography-mass spectrometry(GC-MS). The compounds responsible for the flavor of sturgeon caviars were mostly aldehydes,among which hexanal had the most contribution. Modified atmosphere packaging(MAP)obviously increased the relative contents of hexanal,which reached 13.70% as highest. A stronger fatty,grassy and fishy smell especial in the third month was detected in MAP sturgeon caviars,when they had abundant volatile compounds. MAP could inhibit the oxidation of polyunsaturated fatty acids and the degradation of amino acids,and the change of ketones and alcohols contents were decreased as well. In addition,the MAP4 group treating with lowest concentration of CO2(30% CO2+70% N2)possessed obvious differences,for example,alcohols and esters had different content comparing with other groups,which verified a more concentration of CO2was better in storage. The results showed that MAP could affect odors of sturgeon caviar and extending shelf life.
sturgeon caviar;modified atmosphere packaging(MAP);solid phase micro-extraction(SPME);gas chromatography-mass spectrometry(GC-MS);volatile components
2015-12-16
周婷(1991-),女,硕士研究生,研究方向:水产品加工与质量安全,E-mail:zhouting9210@163.com。
郝淑贤(1972-),女,博士,研究员,研究方向:水产品加工与质量安全,E-mail:susanhao2001@163.com。
公益性行业(农业)科研专项(201003055-06);国家重大科技成果转化项目(ZD-2014-345-3);中央级公益性科研院所基本科研业务费专项(中国水产科学研究院南海水产研究所)(2012YDOl)。
TS206
A
1002-0306(2016)15-0260-05
10.13386/j.issn1002-0306.2016.15.042

