TXNIP过表达对INS-1细胞凋亡通路的影响
吴向征 张倩 梁男男 刘晓波 杨艳宏 焦向英
基础研究
TXNIP过表达对INS-1细胞凋亡通路的影响
吴向征 张倩 梁男男 刘晓波 杨艳宏 焦向英
目的 本研究使用腺病毒转染技术,观察在正常糖脂浓度下培养的INS-1细胞过表达TXNIP是否引起细胞凋亡,并对TXNIP介导细胞凋亡的通路进行初步分析。方法 将处于对数生长期在正常糖脂浓度下培养的INS-1细胞分为3组,即正常培养组、空病毒(Ad-eGFP)组和TXNIP过表达(Ad-TXNIP-eGFP)组,均于转染48 h后收集细胞进行指标测定。结果 转染细胞48 h时病毒转染率达到高峰,并且荧光蛋白表达量基本一致。同Ad-eGFP组相比,Ad-TXNIP-eGFP组TXNIP mRNA(38.68±7.35比0.73±0.39,P<0.01)和蛋白表达量(1.28±0.25比0.62±0.16,P<0.01)均明显增高,说明转染及TXNIP过表达成功。与AdeGFP组相比,Ad-TXNIP-eGFP组Caspase-3相对活性明显增高[(3.823±0.238)nmol·h-1·mg-1比(0.956± 0.107)nmol·h-1·mg-1,P<0.01];反映下游不同通路的Caspase-8[(132.10±27.33)pg/ml比(81.01±15.34)pg/ml,P<0.01]、Caspase-9[(290.76±43.15)pg/ml比(88.94±14.68)pg/ml,P<0.01]和Caspase-12活性[(266.96± 18.50)pg/ml比(52.05±6.13)pg/ml,P<0.01]均明显增高。结论 单纯过表达TXNIP可以引起正常糖脂浓度培养下INS-1细胞凋亡。线粒体凋亡途径、死亡受体活化途径和内质网应激介导途径均参与了TXNIP引起的INS-1细胞凋亡的发生。
硫氧还蛋白相互作用蛋白;INS-1细胞;内质网应激途径;死亡受体途径;线粒体凋亡途径;凋亡
近年来,随着生活工作方式的巨大改变,糖尿病逐渐成为威胁人类健康的重要疾病之一。但是,糖尿病引起B细胞凋亡的机制目前尚不完全明确。近年来,我课题组一直关注一种在细胞内高度表达的蛋白——硫氧还蛋白,并对其进行了大量研究。硫氧还蛋白(thioredoxin,Trx)存在于细胞浆内和线粒体内,除具有重要的抗自由基能力外,还具有抑制凋亡的功能。TXNIP又名硫氧还蛋白相互作用蛋白,是唯一一个内源性Trx结合抑制蛋白质,能通过其第247位点半胱氨酸与Trx的32或35为半胱氨酸结合而抑制Trx活性,进而增加氧化应激损伤,促进凋亡[1]。
我课题组前期已证明过表达TXNIP可以引起心肌细胞凋亡增加,而使用RNA干扰抑制高糖高脂模拟糖尿病刺激引起的TXNIP表达上调,可以显著减轻细胞凋亡的发生。但对TXNIP本身诱导细胞凋亡的下游途径认识尚不清晰。胰岛B细胞是分泌胰岛素的唯一细胞,其死亡和数目减少是糖尿病发生的重要机制。本实验的目的在于观察TXNIP是否也参与糖尿病时胰岛细胞凋亡的发生,并对其可能的下游机制,除经典的线粒体凋亡途径和外源性死亡受体途径,特别对新发现的内质网应激通路进行分析。
1 材料与方法
1.1 主要材料
1.1.1 主要仪器和试剂 Heal Force HF90二氧化碳培养箱,SW-CJ-2FD双人单面垂直超净工作台(苏净集团苏州安泰空气技术有限公司),IX73荧光倒置显微镜(OLYMPUS),MX3005P Real-Time PCR仪(美国STRATAGEN公司),酶标仪(美国Molecular Devices公司),高速离心机(Thermo Fisher),电泳仪(北京市六一仪器厂DYY-6C型),半干转(BIO-RAD公司),JY92-2D超声波细胞粉碎机(宁波新芝科器研究所),Kodak Image Station 400(美国Kodak公司)。
INS-1细胞株购于中国科学院上海细胞库。改良型RPMI1640培养基购于Hyclone公司,胎牛血清、0.25%含EDTA的胰酶和青霉素-链霉素溶液(100×)购于北京全式金生物科技有限公司。两种病毒Ad-CMV-TXNIP(WT)-IRES-eGFP、Ad-CMV-eGFP是与广州赛业生物科技有限公司合作构建获得的,病毒滴度分别为2.21×1011PFu/ml和2.60× 1010PFu/ml。TXNIP引物由Invitrogen公司设计和合成。RNA提取试剂盒购于TIANGEN公司,反转录和RT-PCR试剂盒购于北京全式金生物科技有限公司。凝胶试剂盒购于博士德公司,裂解液购于碧云天生物技术研究所(型号P0013B),CASP12、CASP8、CASP9化学发光免疫分析试剂盒购于Elabscience公司,Caspase-3活性试剂盒购于美国BIOMOL公司,TXNIP一抗抗体购于abcam公司,β-Actin一抗抗体购于CST公司,辣根过氧化物酶标记的羊抗兔IgG购于博士德生物公司。
1.1.2 细胞培养与转染 细胞培养:用含20%胎牛血清、双抗(青霉素-链霉素溶液100 U/ml)的改良型1640培养基于37℃、5%CO2孵箱中培养。对处于对数生长期的细胞长满(80%~90%)时进行传代和转染处理等操作。传代时弃掉原培养基,用PBS冲洗2次,加入700 μl(75 cm×75 cm培养瓶)0.25%含EDTA的胰酶室温下消化1 min,肉眼观察到贴壁的细胞悬浮起来,镜下观察到细胞变圆、不相连,及时加入含20%胎牛的1640终止消化,轻轻吹打数次,传至2瓶,每瓶约12 ml培养基,混匀后置于孵箱培养。
细胞转染:对处于对数生长期的细胞传代时,接种到六孔板上,观察到细胞在六孔板上长满时,细胞数为1×106/孔。吸出培养基,用PBS冲洗2次吸出。按照感染复数MOI(multiplicity of infection)= 100,每孔1 ml病毒稀释液(不含FBS的1640培养基)进行转染,4 h后每孔补液1 ml(含FBS的1640培养基)继续培养,分别于24 h、48 h换液处理,每隔12 h观察一次转染率,于转染效率最高时收集贴壁细胞进行后续试验。
1.2 分组与方法
1.2.1 分组 本实验共分为3组,即正常培养组、空病毒(Ad-eGFP)组和TXNIP过表达(Ad-TXNIP-eGFP)组,使用正常糖脂浓度的1640培养基,均于转染48 h后收集细胞进行指标测定。
1.2.2 方法
1.2.2.1 荧光倒置显微镜观察并计算转染效率 利用荧光倒置显微镜观察并拍摄同一个视野下的转染细胞,计算同一个视野下带绿色荧光蛋白的细胞占整个视野下所有细胞的百分比,计算出转染效率。
1.2.2.2 Real-Time PCR方法测定 INS-1细胞TXNIP mRNA的表达 INS-1细胞mRNA提取用离心柱型总 RNA提取试剂盒,cDNA合成用TransScript First-Strand cDNA Synthesis SuperMix。反转录的条件是42℃孵育30 min,85℃、5 s,4℃保存。Real-Time PCR仪为 Mx3005P Real-Time PCR仪,反应条件是Segment1为94℃、30 s,1个循环;Segment2为94℃、5 s,60℃、30 s,40个循环;Segment3为95℃、1 min,55℃、30 s,95℃、30 s,1个循环。结果用相对定量结果计算(2-△△Ct法)。所使用的基因引物序列为:GAPDH上游引物:5′-ATGGTGAAGGTCGGTGTG-3′,GAPDH下游引物:5′-AACTTGCCGTGGGTAGAG-3′,TXNIP上游引物:5′-AGTGATTGGCAGCAGGTC-3′,TXNIP下游引物:5′-GGTGTCTGGGATGTTTAGG-3′。结果以正常对照组的平均值作为100%,计算其余各组与之相对的比值。
1.2.2.3 Western blot方法测定TXNIP、β-Actin的相对表达量 待转染到48 h时,吸掉培养基,用PBS冲洗2次并吸干,用细胞刮子刮下细胞并收集到离心管中,每管加入100 μl裂解液和 10 μl PMSF,在冰上用超声波打碎,然后4℃裂解3 h左右后,12 000 rpm离心15 min取上清。用BCA法测出三组的蛋白浓度进行定量,按每孔样量为40 μg进行SDS-PAGE电泳分离,80 V电泳30 min至样品到分离线时,将电压转化为120 V电泳60 min左右,电泳完后半干转转膜15 V 15 min,将凝胶上的蛋白转至PVDF膜上。用5%牛血清白蛋白在4℃封闭2 h,洗膜后加入相应的一抗过夜(TXNIP、β-Actin稀释比例为1∶1000)。次日用PBST吸3次,每次5 min后,分别加入对应的辣根过氧化物酶标记的二抗(稀释比例均为1∶5000)4℃下2 h,然后洗膜20 min。加入超敏ECL化学发光即用型底物,用Kodak成像扫描仪扫描拍摄蛋白条带。所有蛋白条带都与内参β-Actin作为对比,实验在相同的条件下至少重复6次。结果以正常对照组的平均值作为100%,计算其余各组与之相对的比值。
1.2.2.4 Caspase-3相对活性测定 Caspase-3代表了细胞凋亡的终末途径,对它的测量可以反映细胞的凋亡程度。蛋白提取方法如上,取一个96孔板,设置标准孔和样品孔。将Caspase-3试剂盒中的标准品按稀释浓度由20.000mm~0.156mm进行倍比稀释。每孔加入10 μl三蒸水、50 μl反应缓冲液、10 μl底物(Ac-DEVD-AFC)工作液和30 μl裂解液,充分混匀;在每个标准孔里依次加入100 μl倍比稀释的AFC标准液。37℃孵育90 min后在508 nm发射光和400 nm激发光检测各孔荧光密度值,用标准品的荧光密度值制作标准曲线。Caspase-3活性根据公式[AFC(1.5 h)-AFC(0 h)]/蛋白浓度/1.5 h(单位:nmol·h-1·mg-1)计算。
1.2.2.5 Caspase-8、Caspase-9和Caspase-12活性测定 Caspase-8是细胞凋亡死亡受体通路中的一个启动子,Caspase-9是线粒体凋亡通路中一个重要分子,而Caspase-12是内质网应激介导INS-1细胞凋亡的一个重要分子,在经典的内源性和外源性细胞凋亡途径中是不被激活的。本试剂盒用双抗体夹心法,用相应的大鼠Caspase抗体包被于酶标板上,样品中含有的Caspase会与包被抗体结合,然后依次加入生物素化的抗大鼠Caspase抗体和辣根过氧化物酶标记的亲和素,最后加入发光底物混合液,发光底物在辣根过氧化物酶的催化下发出荧光,用化学发光免疫分析仪测定各孔在450 nm下的OD值,各孔的OD值即可反映其Caspase浓度,根据标准品OD值制作标准曲线,样品中Caspase活性(单位:pg/ml)可以此进行计算。
1.3 统计学方法 本实验数据用SPSS 13.0进行统计分析。数据均以±s表示,组间比较用单因素方差分析,两两比较用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 转染效率 通过对同一个视野下带绿色荧光蛋白的细胞所占的比例进行计算,分别计算出AdeGFP组INS-1细胞转染24 h、48 h的转染率分别为(14.44±3.09)%、(83.30±7.02)%,Ad-TXNIP-eGFP组细胞转染 24 h、48 h的转染率分别为(12.29±2.83)%、(82.90±5.61)%。由此可以看出,无论Ad-eGFP组或Ad-TXNIP-eGFP组48 h的转染率均高于24 h(P<0.01),所以选用48 h收集细胞进行后续实验。48 h时Ad-eGFP组和Ad-TXNIP-eGFP组的转染率未见统计学差异(P>0.05),说明各组病毒转染量基本一致。见图1。
2.2过表达组TXNIP mRNA的表达量 INS-1细胞转染后过表达组TXNIP mRNA的表达量明显增高。与正常培养组相比,Ad-eGFP组INS-1细胞TXNIP表达量未见统计学差异(0.73±0.39比1.01± 0.06,P>0.05);与Ad-eGFP组相比,Ad-TXNIP-eGFP组TXNIP表达量明显增高(38.68±7.35比0.73±0.39,P<0.01),说明病毒载体构建、细胞转染、目的基因过表达成功。见图2。
2.3 过表达组TXNIP蛋白表达量 INS-1细胞转染后过表达组TXNIP蛋白表达量明显增高。与正常培养组相比,Ad-eGFP组INS-1细胞TXNIP蛋白表达量未见统计学差异(0.62±0.16比 0.70± 0.13,P>0.05);与Ad-eGFP组相比Ad-TXNIP-eGFP组TXNIP蛋白表达量明显增高(1.28±0.25比0.62±0.16,P<0.01),进一步证实了病毒载体构建、细胞转染、目的基因过表达成功。见图3。
2.4 过表达TXNIP组Caspase-3相对活性 过表达TXNIP组Caspase-3相对活性明显增高。与正常培养组相比,Ad-eGFP组INS-1细胞Caspase-3相对活性未见统计学差异[(0.956±0.107)nmol·h-1·mg-1比(0.896±0.120)nmol·h-1·mg-1,P>0.05];与AdeGFP组相比Ad-TXNIP-eGFP组Caspase-3相对活性明显增高[(3.823±0.238)nmol·h-1·mg-1比(0.956±0.107)nmol·h-1·mg-1,P<0.01]。因为Caspase-3代表了细胞凋亡的终末共同途径,Ad-TXNIP-eGFP组 Caspase-3相对活性增高说明TXNIP的过表达上调可导致INS-1细胞凋亡显著增加。见图4。
2.5 过表达TXNIP组Caspase-8活性升高 与正常培养组相比,Ad-eGFP组INS-1细胞Caspase-8活性未见统计学差异[(81.01±15.34)pg/ml比(79.87±12.88)pg/ml,P>0.05];与Ad-eGFP组相比,Ad-TXNIP-eGFP组Caspase-8活性明显增高[(132.10±27.33)pg/ml比(81.01±15.34)pg/ml,P<0.01]。Caspase-8反映了死亡受体通路介导细胞凋亡的情况,TXNIP过表达组Caspase-8活性升高,说明过表达TXNIP可以引起死亡受体通路引起的INS-1细胞凋亡增加。见图5。
2.6 过表达TXNIP组Caspase-9活性 过表达TXNIP组Caspase-9活性升高。与正常组培养相比,Ad-eGFP组INS-1细胞Caspase-9活性未见统计学差异[(88.94±14.68)pg/ml比(81.07±12.58)pg/ml,P>0.05];与Ad-eGFP组相比,Ad-TXNIP-eGFP组Caspase-9活性明显升高[(290.76±43.15)pg/ml比(88.94±14.68)pg/ml,P<0.01]。Caspase-9反映了线粒体凋亡通路介导细胞凋亡的情况,TXNIP过表达组Caspase-9活性明显升高,说明过表达TXNIP可以通过线粒体通路引起的INS-1细胞凋亡。见图6。
2.7 过表达TXNIP组Caspase-12活性 过表达TXNIP组Caspase-12活性增高。与正常培养组相比,Ad-eGFP组INS-1细胞Caspase-12活性未见统计学差异[(52.05±6.13)pg/ml比(50.19±2.37)pg/ml,P>0.05];与Ad-eGFP组相比,Ad-TXNIP-eGFP组 Caspase-12活性明显增高[(266.96± 18.50)pg/ml比(52.05±6.13)pg/ml,P<0.01]。Caspase-12只是在内质网应激通路中被激活,反映了内质网应激介导细胞凋亡的情况,TXNIP过表达组Caspase-12活性增高,说明过表达TXNIP可以使内质网应激介导的INS-1细胞凋亡增加。见图7。
3 讨论
2010年杨文英等[2]对我国20岁以上成年人糖尿病流行病学调查显示,我国糖尿病患者已占到成年人的9.7%,达9240万人,而糖尿病前期占15.5%,达到14 820万,这也意味着未来有更多的人罹患糖尿病。同时,我国糖尿病的治疗现状不容乐观。有调查显示[3],我国糖尿病患者中仅有30.1%的人确诊,25.8%的人接受糖尿病治疗。这些数字提示我们,糖尿病已经成为一个我国未来必须面对的重要社会问题。糖尿病分为胰岛素依赖的1型和进展较慢可长期不依赖胰岛素治疗的2型,但无论哪种类型糖尿病其实都出现B细胞的损伤和凋亡,并最终导致胰岛功能的失代偿,而不得不进入胰岛素依赖期。
前期研究表明,在糖尿病动物心肌等组织中Trx的功能显著下降,可能是细胞凋亡发生的重要原因。进一步分析提示,Trx功能下降涉及Trx硝基化修饰增加、Trx还原酶(TR)活性下降、TXNIP(Trx interacting protein)表达上调三大原因。在糖尿病和高糖引起的Trx系统相关改变中,TXNIP的表达上调非常显著,引起课题组的极大兴趣。
TXNIP在1994年由Chen和Deluca教授[4]首次发现,在使用1,25-(OH)2D3诱导HL-60细胞分化时出现一个46 KD的蛋白大量表达,因此命名为Vitamin-D3 upregulated protein 1(VDUP1),以后使用酵母菌双杂交实验发现可与Trx结合,故也称为thioredoxin binding protein-2(TBP2)。TXNIP是目前发现的唯一一个内源性的Trx结合及抑制蛋白质,能通过和Trx结合而抑制其活性,进而诱导氧化应激,促进凋亡,因在糖尿病和高糖引起的诸蛋白表达变化中TXNIP的上调非常显著,因而引起众多研究者的关注。
本课题组曾经对TXNIP与糖尿病的关系进行了大量研究。先后过表达和RNA干扰两种干预证明TXNIP是介导糖尿病引起心肌细胞凋亡的重要原因。同时研究也提示,TXNIP引起细胞凋亡除存在Trx依赖途径外,也存在不依赖于Trx的其他途径[5]。
鉴于胰岛细胞,特别是B细胞在糖尿病发病机制中的关键作用,本实验使用腺病毒过表达TXNIP,观察TXNIP本身对正常糖脂浓度下培养的胰岛B细胞株INS-1细胞的影响。在各组转染率最高并且荧光蛋白表达量一致时,在mRNA水平和蛋白水平对TXNIP表达量研究显示,TXNIP过表达组比空病毒组明显升高,说明此时腺病毒转染过表达TXNIP成功。在此前提下,对细胞终末凋亡途径的Caspase-3相对活性检测,TXNIP过表达组的Caspase-3相对活性明显升高,细胞凋亡增加。由于本实验用的是正常糖脂浓度的1640培养基,可以排除糖尿病条件下高糖、高脂等其他因素的影响,因此可以确定单纯过表达TXNIP本身可以引起INS-1细胞的凋亡。
目前公认的主要细胞凋亡途径有三种,即经典的线粒体凋亡途径、死亡受体活化途径和内质网应激介导的途径。内质网应激(endoplasmic reticulum stress,ERS)是近几年发现的一种引起细胞凋亡的路径。内质网是蛋白质合成的关键场所,参与蛋白质的折叠、转运和修饰,在糖尿病时由于胰岛素合成的代偿性增加,伴随出现大量积累的未折叠或者错误折叠的蛋白超出了内质网的能力时,诱发的ERS会触发未折叠蛋白反应(unfolded protein response,UPR),一旦UPR不可修复,就会使细胞凋亡[6,7]。UPR由一个内质网分子伴侣GRP78/BIP和3个跨膜信号蛋白组成,分别是PERK[protein kinase RNA(PKR)-like ER kinase]、IRE1α(inositolrequiring protein-1α)和ATF6α(activating transcription factor 6α)[8],这三个跨膜蛋白可作为UPR信号的感受器[9]。Oslowski等[10]证实,内质网应激引起的细胞凋亡中的一个关键分子是TXNIP。这也引起我们的兴趣来研究单纯过表达TXNIP对内质网应激介导的细胞凋亡的影响。
本实验中我们选取Caspase-12来反映内质网应激的程度。Caspase-12是内质网应激介导细胞凋亡的重要分子,在另外两条凋亡途径中不被激活,只反映内质网应激介导细胞凋亡情况[11]。单纯过表达TXNIP时,Caspase-12活性显著,说明TXNIP可以通过内质网应激介导INS-1细胞凋亡。
死亡受体途径是靶细胞表面的死亡受体包括Fas、肿瘤坏死因子受体-1(TNF-R1)等,结合同源配体后启动凋亡程序,激活Caspase-8,以及激活下游的Caspase-3等,从而引起凋亡。本实验中我们选择Caspase-8来反映TXNIP对INS-1细胞死亡受体通路的影响。Caspase-8是死亡受体介导的细胞凋亡中关键的启动子,能够与Fas相关死亡结构域蛋白结合,形成死亡复合物,进而诱导下游Caspase基因表达,促进细胞凋亡[12]。本研究中TXNIP过表达组的Caspase-8活性显著升高,表明死亡受体通路参与了TXNIP引起的细胞凋亡的发生。
线粒体凋亡通路是在20世纪90年代被人们所认知。一些因素如自由基、紫外线、DNA损伤药物等可使线粒体DNA损伤增多[13],引起线粒体外膜通透性增加,存在于线粒体内的细胞色素C释放,释放到细胞质中的细胞色素C与凋亡蛋白酶活化因子1结合形成复合物,促进Caspase-9前体活化,随后激活Caspase-3,导致细胞凋亡[14,15]。线粒体凋亡途径也可以通过死亡配体激活,Caspase-8可以通过凋亡相关蛋白Bid,诱导线粒体外膜通透性改变,引起凋亡相关因子释放,激活Caspase-9,导致细胞凋亡。本实验选择Caspase-9的活性来反映TXNIP对INS-1细胞线粒体凋亡通路的影响。我们可以看出TXNIP过表达组Caspase-9活性显著升高,说明TXNIP可以通过线粒体凋亡途径引起细胞凋亡。
综上所述,本实验表明:①单纯过表达TXNIP可以引起正常糖脂浓度培养下INS-1细胞凋亡;②TXNIP可以通过内质网应激介导的途径、死亡受体途径和线粒体凋亡途径引起INS-1细胞的凋亡。关于三条途径在TXNIP引起凋亡中的作用大小及相互关系,则有待我们进一步研究分析证实。
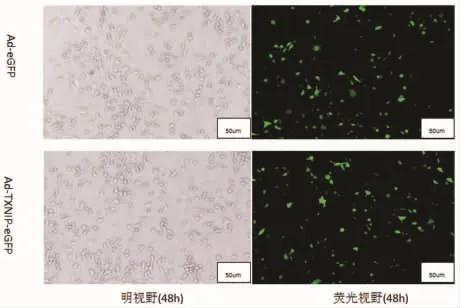
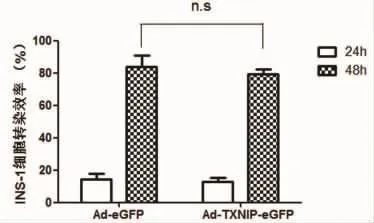
图1 转染48h胰岛细胞转染效率(n=8,n.s.not significant.)
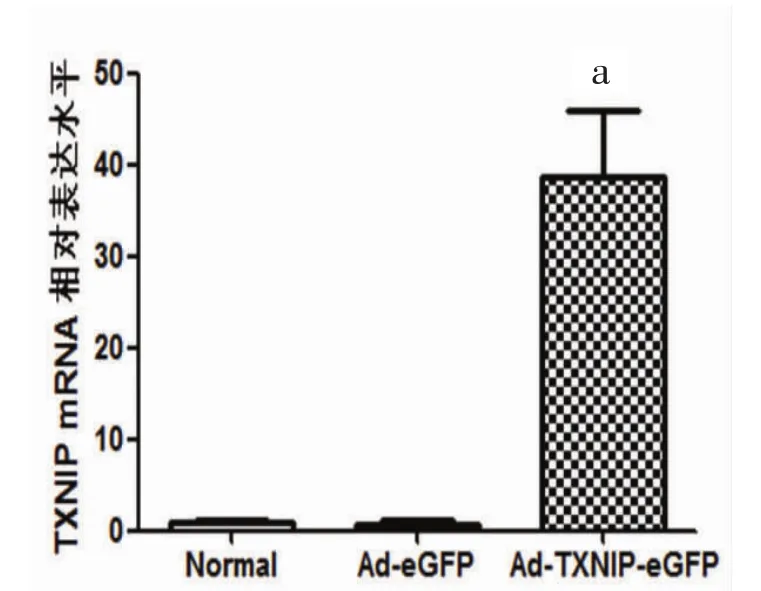
图2 Real-Time PCR方法测定转染INS-1细胞TXNIP的mRNA表达
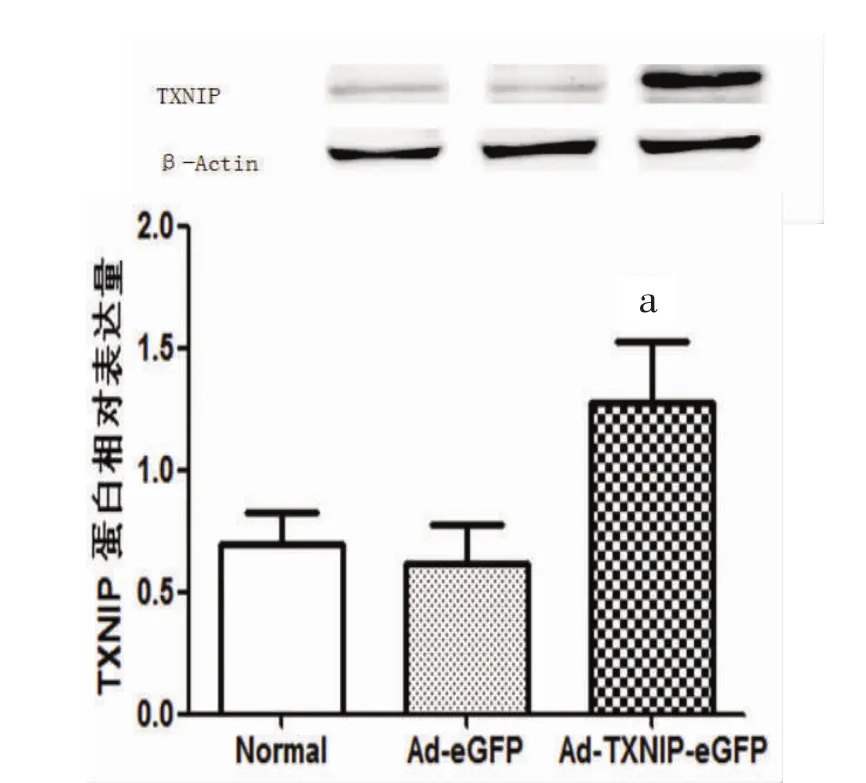
图3 Western Blot方法测定转染INS-1细胞TXNIP的蛋白表达
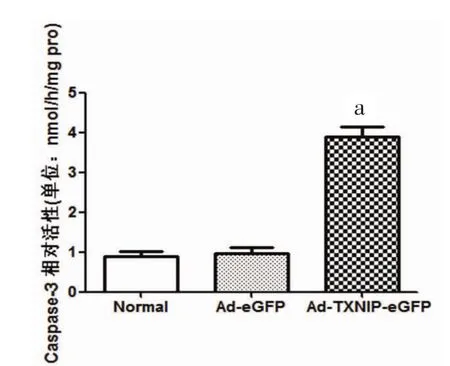
图4 转染INS-1细胞Caspase-3活性测定
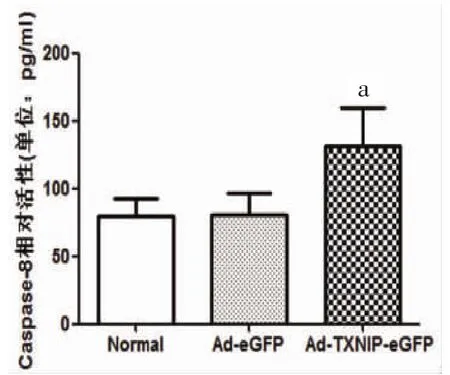
图5 转染INS-1细胞Caspase-8活性测定
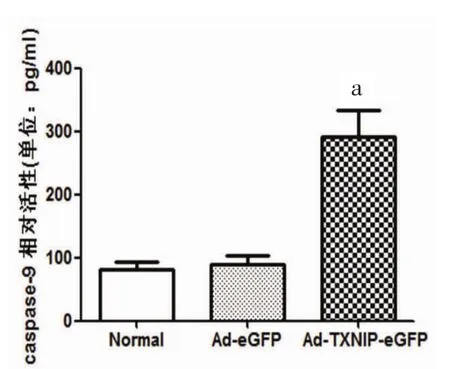
图6 转染INS-1细胞Caspase-9活性测定
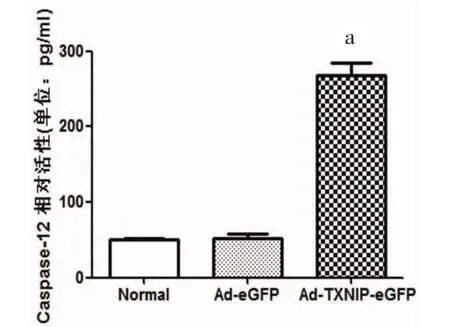
图7 转染INS-1细胞Caspase-12活性测定
[1]Parth P,Higgins LJ,Chutkow WA,et al.The interaction of thioredoxin with Txnip.Evidence for formation of a mixed disulfide by disulfide exchange.J Biol Chem,2006,281:21884-21891.
[2]Yang WY,Lu JM,Weng JP,et al.Prevalence of Diabetes among Men and Women in China.N Engl J Med,2010,362:1090-1101.
[3]Xu Y,Wang L,He J,et al.Prevalence and Control of Diabetes in Chinese AdultsDiabetes Control in Chinese Adults Diabetes Control in Chinese Adults.JAMA,2013,310:948-958.
[4]Chen KS,Deluca HF.Isolation and characterization of a novel cDNA from HL-60 cells treated with 1,25-dihydroxyvitamin D-3.BBA-GENE STRUCT EXPR,1994,1219:26-32.
[5]刘晓波,杨啸,姚艳玲,等.腺病毒过表达TXNIP对INS-1胰岛细胞损伤和凋亡的影响.中国心血管病研究,2014,12:1127-1132.
[6]Lee S,Kim SM,Dotimas J,et al.Thioredoxin-interacting protein regulates protein disulfide isomerases and endoplasmic reticulum stress.EMBO Mol Med,2014,6:732-743.
[7]Shore GC,Papa FR,Oakes SA.Signaling cell death from the endoplasmic reticulum stress response.Curr Opin Cell Biol,2011,23:143-149.
[8]关丽英,许彩民,潘华珍.内质网应激介导的细胞凋亡.生物化学与生物物理进展,2007,34:1136-1141.
[9]Ron D,Walter P.Signal integration in the endoplasmic reticulum unfolded protein response.Nat Rev Mol Cell Biol,2007,8:519-529.
[10]Oslowski CM,Hara T,O′Sullivan-Murphy B,et al.Thioredoxin-interacting protein mediates ER stress-induced βcell death through initiation of the inflammasome.Cell Metab,2012,16:265-273.
[11]Ferri KF,Kroemer G.Organelle-specific initiation of cell death pathways.Nat Cell Biol,2001,3:E255-263.
[12]刘洪娟,汲晨锋,高世勇,等.死亡受体介导细胞凋亡的研究进展.中草药,2009,S1:48-51.
[13]Ballinger SW,Patterson C,Yan CN,et al.Hydrogen peroxideand peroxynitrite-induced mitochondrial DNA damage and dysfunction in vascular endothelial and smooth muscle cells.Circ Res,2000,86:960-966.
[14]Stevens JM.Cytochrome c as an experimental model protein. Metallomics,2011,3:319-322.
[15]Gustavsson T,Trane M,Moparthi VK,et al.A cytochrome c fusion protein domain for convenient detection,quantification,and enhanced production of membrane proteins in Escherichia coli——expression and characterization of cytochrome-tagged Complex I subunits.Protein Sci,2010,19:1445-1460.
Effect of adenovirus-mediated TXNIP overexpression on INS-1 cell apoptosis pathway
WU Xiang-zheng,ZHANG Qian,LIANG Nan-nan,et al.Department of Physiology,Shanxi Medical University,Taiyuan 030001,China
JIAO Xiang-ying,E-mail:jiaoxy@gmail.com
Objective To observe if TXNIP overexpression alone can cause INS-1 cell apoptosis,and the effect of TXNIP on different apoptotic pathways,adenovirus carrying TXNIP gene was used to transfect INS-1 islet cells cultured in normal glucose and normal lipid concentration conditions.MethodsINS-1 islet cells in logarithmic growth phase were randomly divided into three groups:normal cultured group,empty adenovirus vector(Ad-eGFP)group and TXNIP overexpression(Ad-TXNIP-eGFP)group.All the cells were collected 48 h after transfection for further assay.ResultsTransfection efficiency reached its peak 48 h after the adenovirus transfection,and the expression of green fluorescent protein in three groups were nearly equally.Compared to the Ad-eGFP group,the expression of TXNIP mRNA(38.68±7.35 vs 0.73±0.39,P<0.01)and protein(1.28±0.25 vs 0.62±0.16,P<0.01)of Ad-TXNIP-eGFP group increased significantly,which meant adenovirus-mediated TXNIP overexpression was successful.Caspase-3 activity was significantly increased compared to Ad-eGFP group[(3.823± 0.238)nmol·h-1·mg-1vs(0.956±0.107)nmol·h-1·mg-1,P<0.01].To further elucidate the downward pathways may involve in TXNIP induced cell apoptosis,our results shown that Caspase-8[(132.10±27.33)pg/ml vs(81.01± 15.34)pg/ml,P<0.01],Caspase-9[(290.76±43.15)pg/ml vs(88.94±14.68)pg/ml,P<0.01]and Caspase-12 activity[(266.96±18.50)pg/ml vs(52.05±6.13)pg/ml,P<0.01]were all increased significantly when compared with the eGFP group.ConclusionTXNIP overexpression alone can cause INS-1 cell apoptosis,which were cultured in normal glucose and normal lipid concentration conditions.Furthermore,the apoptosis is mediated bythree different pathways,including mitochondria apoptosis pathway,death receptor pathway and endoplasmic reticulum stress pathway.
Thioredoxin interacting protein;INS-1 islet cells; Endoplasmic reticulum stress pathway;Death receptor pathway;Mitochondria apoptosis pathway;Apoptosis
山西医科大学青年基金资助项目(项目编号:Q02201208)
030001 山西省太原市,山西医科大学生理学系
焦向英,E-mail:jiaoxy@gmail.com
10.3969/j.issn.1672-5301.2016.02.026
R587.1
A
1672-5301(2016)02-0185-06
2015-09-25)

