胆盐水解酶基因在植物乳杆菌ST-Ⅲ中的表达
黄艳娜,毕雪威,游春苹,*
(1.光明乳业股份有限公司,乳业国家重点实验室,上海 200436;2.江南大学食品学院,江苏无锡 214122)
胆盐水解酶基因在植物乳杆菌ST-Ⅲ中的表达
黄艳娜1,毕雪威2,游春苹1,*
(1.光明乳业股份有限公司,乳业国家重点实验室,上海 200436;2.江南大学食品学院,江苏无锡 214122)
胆盐水解酶(Bile salt hydrolase,BSH)是微生物生长、繁殖过程中产生的一种胞内酶,因其与降低血胆固醇、预防心血管疾病有关而受到广泛关注。本研究通过基因工程技术实现了4种胆盐水解酶基因在LactobacillusplantarumST-Ⅲ的过表达,并利用茚三酮显色法测定了表达4种BSHs重组菌的酶活,结果显示表达BSH1重组菌的酶活最高,其次是BSH3和BSH2的重组菌,而以BSH4重组菌酶活最低。本研究结果表明,BSH1可能在L.plantarumST-Ⅲ水解胆盐方面起着更为重要的作用,其次为BSH3,而BSH2和BSH4在L.plantarumST-Ⅲ中对牛磺酸结合胆盐的水解能力较弱。
胆盐水解酶,植物乳杆菌ST-Ⅲ,克隆表达,酶活性
胆盐水解酶(Bile salt hydrolase,BSH,EC 3.5.1.24)是微生物生长、繁殖过程中产生的一种代谢产物。该酶是bsh基因编码的一种胞内酶,对氧气不敏感,适宜在微酸性环境下生长,能水解胃肠道中的结合态胆盐(牛磺胆酸盐和甘氨胆酸盐)为非结合态胆酸和游离氨基酸,从而使血清中胆固醇含量降低[1-2]。国内外大量临床实验证实,服用益生菌及其相关制品可减少人体血清胆固醇的含量,降低心血管疾病发病率。Smet等[3]研究表明:乳酸菌降血清胆固醇与该乳酸菌产生的BSH活力密切相关。所以研究胆盐水解酶的特性对于揭示益生菌降胆固醇的作用机理具有重要意义。
植物乳杆菌ST-Ⅲ是本实验室从酱菜中分离得到的一株益生菌,具有降胆固醇的功能[4]。任婧等[5-6]在大肠杆菌中分别表达了4种L.plantarumST-Ⅲ胆盐水解酶基因,结果显示4种BSHs均具有活性。赵时玮等[7]也对植物乳杆菌JPP2的胆盐水解酶bsh3基因进行了大肠杆菌中的表达。

表1 引物设计
黄茜等[8]对植物乳杆菌Yl的胆盐水解酶基因进行了克隆,研究表明表达产物主要以包涵体的形式存在。为改善BSHs异源表达包涵体的问题,杨士芹等[9]尝试密码子优化和选择大肠杆菌Rosetta为宿主的方法,克隆了嗜热乳杆菌和嗜酸乳杆菌中的胆盐水解酶基因(前者为bsh,后者为bshA和bshB),该研究仅通过LB平板中添加牛磺脱氧胆酸钠有沉淀生成初步判断重组菌具有水解胆盐的活性。而在本研究中,我们通过基因工程技术实现4种胆盐水解酶基因在植物乳杆菌ST-Ⅲ自身的过表达,一方面可以避免BSH在大肠杆菌中异源表达带来的包涵体问题,另一方面还可以直观的判断不同的胆盐水解酶基因对宿主水解胆盐的作用程度。本实验通过BSH酶活性的测定和菌株对胆盐的耐受性实验,解析不同胆盐水解酶在L.plantarumST-Ⅲ中的作用机制。
1 材料与方法
1.1材料与仪器
1.1.1菌株和质粒植物乳杆菌L.plantarumST-Ⅲ[4]和大肠杆菌EscherichiacoliJM109为本实验室保存,其基因型为:recA1,endA1,gyrA96,thi-1,hsdR17,supE44,relA1,Δ(lac-proAB+)/F′[traD36,proAB+,lacIq,lacZΔM15]。
质粒pIB184由本实验室保存。pIB184质粒为组成型表达质粒,P23启动子,可以在菌体生长过程中过表达插入基因。
1.1.2试剂Taq DNA聚合酶,T4 DNA连接酶,dNTP Mixture、DNA Marker、限制性内切酶BamH I和EcoR I 均购于TaKaRa生物工程(大连)有限公司;质粒小量快速提取试剂盒、基因组抽提试剂盒和琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司;茚三酮和红霉素购自上海生工生物工程有限公司;牛磺胆酸钠购自Sigma公司;其他化学试剂均为国产分析纯。
引物设计与DNA测序分析由上海生工生物工程有限公司提供。
1.1.3培养基LB培养基(/L):胰蛋白胨(Oxid,Hampshire,England)10 g,酵母提取物(Oxid)5 g,NaCl 10 g,固体培养基添加琼脂粉15 g/L。用于大肠杆菌的培养,其中重组大肠杆菌的培养需添加终浓度为250 μg/mL红霉素。MRS液体和固体培养基均购自Oxid公司,用于植物乳杆菌的培养,其中重组乳酸杆菌的培养需添加终浓度为10 μg/mL红霉素。
1.1.4仪器Biophotometer Plus核酸蛋白测定仪,5424R台式离心机,Eporator/43900电穿孔仪美国Eppendorf公司;Nanodrop 2000C微量分光光度计美国赛默飞世尔科技公司;MIR-154恒温培养箱日本三洋电器集团;MB-102恒温震荡金属浴杭州博日科技有限公司;Proflex PCR仪美国ABI公司。
1.2引物设计与目的基因的克隆
根据Genbank中公布的L.plantarumST-Ⅲ的bsh1(ADO00098),bsh2(ADN97280),bsh3(ADN99975)和bsh4(YP_003063652)的基因序列,选择pIB184为表达载体,引物设计如表1所示。
引入BamH I和EcoR I为酶切位点,以提取的L.plantarumST-Ⅲ基因组为模板,PCR扩增胆盐水解酶的四个同工酶基因。反应体系如下:PCR体系为50 μL:模板DNA 2 μL,上下游引物(10 μmol/L)各2 μL,dNTPs(10 mmol/L)2 μL,10×PCR buffer 5 μL,0.5 μL Taq DNA聚合酶(5 U/μL),ddH2O补足50 μL。PCR条件为:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃延伸10 min;4 ℃保存。扩增产物用1%琼脂糖凝胶电泳检测,采用PCR产物纯化试剂盒纯化PCR产物。
1.3重组表达质粒的构建
将质粒pIB184与基因片段分别进行BamH I和EcoR I双酶切,琼脂糖凝胶电泳回收DNA片段。按照质粒与基因片段浓度比为1∶3的比例进行16 ℃连接过夜,转化至E.coliJM109感受态细胞中,涂布于含终浓度为250 μg/mL红霉素的LB平板,挑选阳性克隆并鉴定。
1.4植物乳杆菌感受态的制备和重组L.plantarumST-Ⅲ菌株的构建
植物乳杆菌ST-Ⅲ感受态的制备。乳杆菌过夜培养后,按照1%的接种量接种至100 mL含有1%甘氨酸的MRS培养基中,37 ℃静置培养至OD600达到0.5~0.7左右;将培养液于冰上预冷10 min,4 ℃,5000 r/min离心5 min。用预冷的电击缓冲液(30%聚乙二醇)悬浮菌体,冰上放置10 min,4 ℃,5000 r/min离心5 min,菌体重新悬浮在1/100体积的电击缓冲液,分装,于-80 ℃冰箱中保存。
取3 μL重组质粒与100 μL的感受态细胞混合,移入电击杯中置冰上5 min,使用高压脉冲电穿孔仪,在1.5 kV条件下电击,电击5 ms左右。电击完毕后向电击杯中加入复苏培养基,混匀后移入离心管中,37 ℃静置培养2 h。取100 μL涂布于含终浓度为10 μg/mL红霉素的MRS平板,37 ℃培养至长出单菌落。挑单菌落,37 ℃培养24 h,PCR验证是否为阳性克隆。
1.5胆盐水解酶活性的测定
采用茚三酮显色法绘制牛磺酸的标准曲线[10]。准确吸取200 μg/mL的牛磺酸标准溶液0、0.2、0.4、0.6、0.8、1.0 mL,分别置于25 mL比色管中,各加水补足至4.0 mL。然后加入茚三酮显色液1.0 mL混合均匀,于沸水浴中加热16 min,取出迅速冷却至室温,加入5 mL碘酸钠稀释液,并加水定容。静置15 min后于570 nm波长处测其吸光度。以标准牛磺酸含量为横坐标,绘制其标准曲线。
胆盐水解酶活性的测定方法参照文献所述[11-13],稍加改动。采用细胞破碎后添加溶菌酶破壁的方法处理样品,细胞超声破碎条件为:工作时间3 s,间隔5 s,电压300 W,超声90次;样品超声处理后分别加入溶菌酶处理,以使细胞壁裂解完全。参照文献所述方法测定胆盐水解酶活性,即测定570 nm处吸光值。单位体积的粗酶液每分钟从底物释放1 nmol牛磺酸所需要的酶量定义为一个酶活单位(U)。
1.6数据统计分析
酶活测定实验中每个处理设置三次生物学重复,每个实验重复三次,采用SPSS 17.0软件进行数据的显著性分析。
2 结果与分析
2.1胆盐水解酶基因的PCR扩增和测序
以植物乳杆菌L.plantarumST-Ⅲ的基因组为模板,PCR扩增胆盐水解酶基因,琼脂糖凝胶电泳结果如图1所示。各基因均扩增出特异条带,大小与目的片段基本一致。将PCR产物送上海生工测序,结果显示bsh 1~bsh 4基因大小分别为975、1017、987、954 bp,经与NCBI中报道的L.plantarumST-Ⅲ中bsh1(ADO00098),bsh2(ADN97280),bsh3(ADN99975)和bsh4(YP_003063652)的基因序列比对分析,显示基因序列的同源性均为100%。
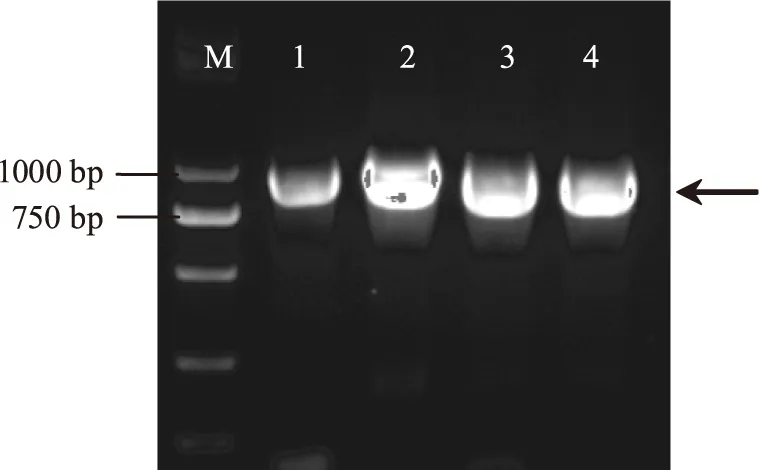
图1 胆盐水解酶基因PCR扩增产物琼脂糖电泳图Fig.1 The electrophoretogram of PCR product of the bile salt hydrolase genes.注:M:Marker;1:bsh1;2:bsh2;3:bsh3;4:bsh4。
2.2重组表达质粒的构建
将BamH I和EcoR I双酶切的四个DNA片段(bsh1~bsh4)和同样双酶切的质粒pIB184分别16 ℃连接10 h左右,连接产物转化E.coliJM109,复苏后涂终浓度为250 μg/mL红霉素的抗性LB平板。37 ℃过夜培养后挑选阳性克隆,培养后抽提质粒,并对质粒进行BamH I和EcoR I的双酶切验证。琼脂糖凝胶电泳如图2所示。如图所示,重组质粒经BamH I和EcoR I双酶切后均显示有较特异的两条带,且大小与质粒和目的片段基本一致。将四个重组质粒送上海生工测序,测序比对结果显示基因大小正确,表明所挑选单克隆为正确的重组子。
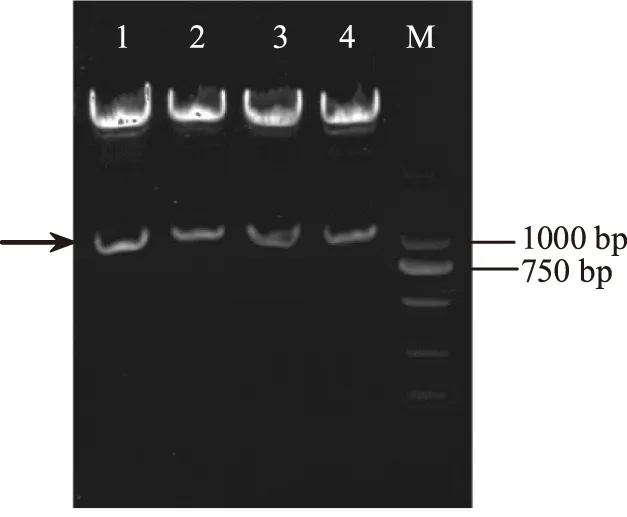
图2 重组质粒BamH I和EcoR I双酶切验证电泳图 Fig.2 The electrophoretogram of the recombinant plasmid digested by BamH I and EcoR I.注:1:pIB184bsh1;2:pIB184bsh2;3:pIB184bsh3;4:pIB184bsh4;M:Marker。
2.3表达胆盐水解酶的重组植物乳杆菌的构建
将表达胆盐水解酶的四种重组质粒(pIB184bsh 1~4)电击转化L.plantarumST-Ⅲ感受态细胞,复苏3 h后,涂含有10 μg/mL红霉素抗性MRS平板,37 ℃静置培养36 h,挑选单克隆。
将挑选的单克隆接种于含有10 μg/mL的MRS液体培养基中,37 ℃培养24 h后保种,其余菌体采用终浓度为10 μg/mL的溶菌酶处理后抽提质粒。以抽提的质粒为模板,以设计的pIB184质粒的测序引物(IB-F:ATCAGACCTAAGACTGATGAC;IB-R:CGATTACATGGATTGGATTAG)进行PCR扩增,琼脂糖凝胶电泳图如图3所示。从电泳图中我们可以看出,各重组质粒均扩增出大小正确的特异条带,送上海生工测序,与NCBI中报道的四个胆盐水解酶同工酶(bsh1~bsh4)的基因序列同源性均为100%,证明所挑选的单克隆为阳性。将表达bsh1~bsh4基因的重组植物乳杆菌分别命名为ST-Ⅲ/bsh1、ST-Ⅲ/bsh2、ST-Ⅲ/bsh3和ST-Ⅲ/bsh4。
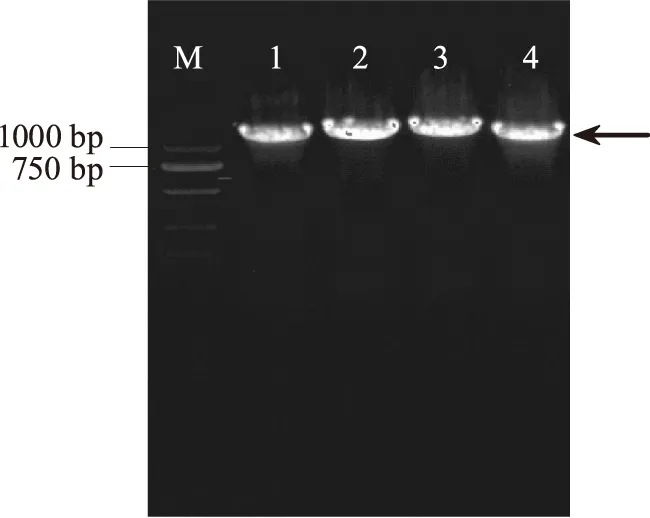
图3 重组菌胆盐水解酶基因PCR验证电泳图 Fig.3 The PCR electrophoretogram of bsh gene in the recombinant strains注:M:Marker;1:bsh1;2:bsh2;3:bsh3;4:bsh4。
2.4胆盐水解酶活性的测定
将L.plantarumST-Ⅲ及其重组菌分别接种于含有0.05%牛磺胆酸钠的MRS液体培养基中,并添加相应浓度的红霉素,37 ℃培养12 h。采用Biophotometer Plus核酸蛋白测定仪测定细胞浓度(OD600),并按照1.5所述方法收集菌体,测定胆盐水解酶酶活。以L.plantarumST-Ⅲ为对照,以超声破碎后的灭活粗酶液作空白,测定不同重组菌的胆盐水解酶的酶活性并比较其变化。牛磺酸的标准曲线方程:y=0.002x+0.113(R2=0.992)。
从表2中可看出,表达胆盐水解酶的重组菌在含有0.05%牛磺胆酸钠的培养基中细胞生长较宿主L.plantarumST-Ⅲ均有明显的提高。其中宿主L.plantarumST-Ⅲ在发酵12 h时OD600为0.946,而重组菌中以ST-Ⅲ/bsh3细胞浓度最高,OD600为2.15,是对照菌体浓度的2.28倍;其他三株重组菌OD600无显著差异(p>0.05),均略大于1.8,较对照提高了90%。L.plantarumST-Ⅲ在含有牛磺胆酸钠的培养基中的菌落状态如图4所示,随着MRS培养基中牛磺胆酸钠浓度的增加,L.plantarumST-Ⅲ生长逐渐变缓,且菌落形态逐渐减小,因此我们推测L.plantarumST-Ⅲ在含有牛磺胆酸钠MRS培养基中细胞生长速率的下降可能与其胆盐耐受性较差有关。从不同菌株的细胞生长情况来看,胆盐水解酶的表达可能在某种程度上增加了细胞耐受胆盐的水平,从而使得重组菌生长较对照有所提高。实验还发现,重组菌在含不同浓度牛磺胆酸钠MRS平板上胆盐耐受性无显著差异(结果未显示),原因有待进一步研究。
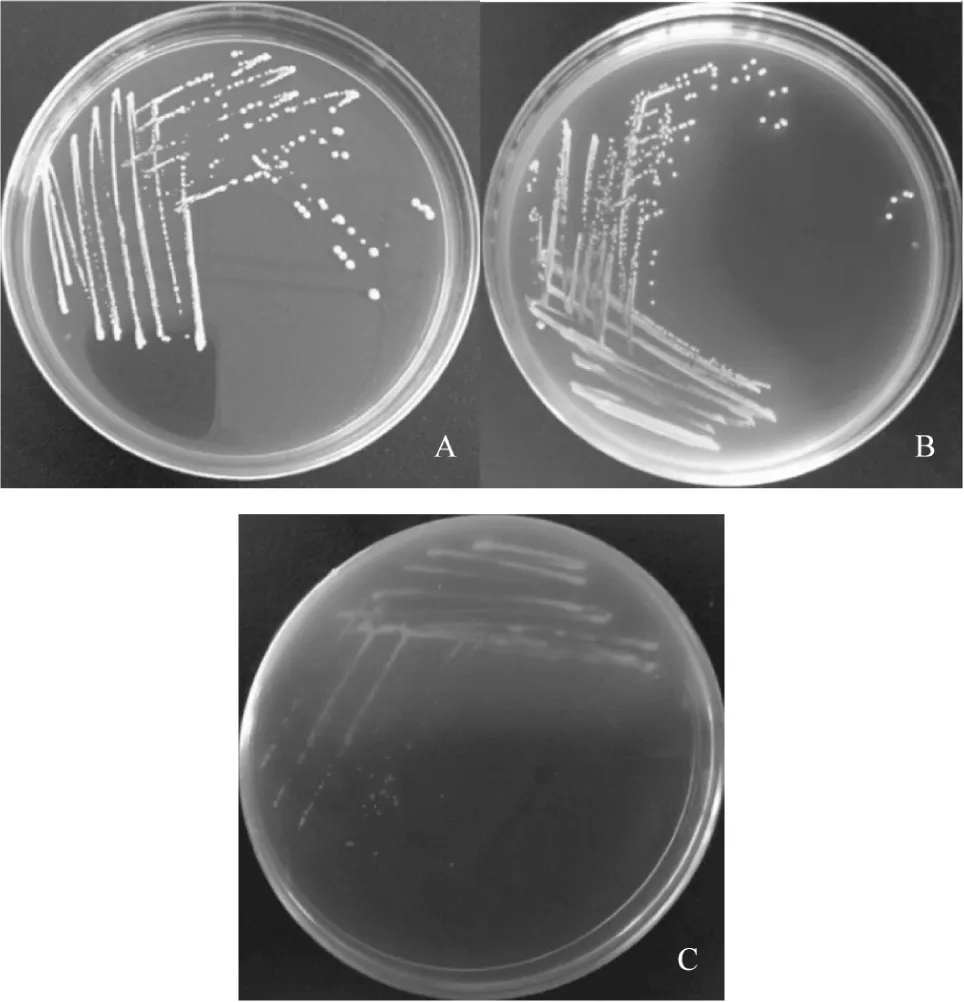
图4 L. plantarum ST-Ⅲ在不同浓度牛磺胆酸钠的MRS平板中的菌落生长Fig.4 The colonial morphology of L. plantarum ST-Ⅲ in MRS plate with sodium注:A:MRS;B:MRS+0.05%牛磺胆酸钠;C:MRS+0.1%牛磺胆酸钠。
胆盐水解酶的酶活性测定如表2所示。由表2可见,表达胆盐水解酶的重组菌酶活较对照L.plantarumST-Ⅲ酶活性均有一定的提高,其中以表达BSH1的重组菌胆盐水解酶酶活最高,为76.59 U/mL,是对照的2.25倍;其次是表达BSH3和BSH2重组菌,酶活性分别是对照的1.97和1.45倍,而以表达BSH4重组菌的酶活性最低,较对照提高了17%。由于L.plantarumST-Ⅲ本身具有胆盐水解酶,因此所测定的胆盐水解酶的酶活在某种程度上可能是酶活性的加和作用或有可能存在同工酶间的协同作用。任婧等[5-6]在大肠杆菌中表达植物乳杆菌ST-Ⅲ的4种胆盐水解酶基因(bsh1~bsh4),并对其酶活力进行测定,结果发现4种BSHs均具有水解胆盐的活力,酶活分别为29.00、20.49、24.90、21.13 U/mL,同时BSH1比其他3种BSHs表现出更高的水解能力。而在本研究中我们通过胆盐水解酶基因在自身中的过表达和酶活测定也得到了类似的结果,推测BSH1可能确实在水解结合型胆盐为非结合型胆盐过程中起着较其他BSHs更为重要的作用。Lambert等[14]在缺失BSH基因的乳酸乳球菌中表达L.plantarumWCSF1的4种BSHs基因,其中BSH1活性最高,BSH2未检测到酶活,BSH3和BSH4活性较低,且BSH4在牛磺酸结合型底物中无活性。这与本研究中BSH4较低的酶活结果相吻合(对照胆盐和BSH4水解酶活性分别为34.06、39.86 U/mL),因此我们推测ST-Ⅲ/bsh4较低的酶活可能与测定底物有关。另外,任婧和Lambert等[5-6,14]的研究均显示BSH3具有较其他胆盐水解酶更高的蛋白表达量,推测ST-Ⅲ/bsh3较高的酶活可能与此有关。有些研究表明,细胞的胆盐耐受性与胆盐水解酶的活性没有直接关系[15-16],这可能与酶活的测定方法不同所致,如实验条件和所选择的底物(如甘氨酸结合胆盐或牛磺酸结合胆盐)等[16]。

表2 胆盐水解酶活性的测定
3 结论
胆盐水解酶是植物乳杆菌降胆固醇的主要机理之一,通过胆盐水解酶的作用,同化或沉淀胆盐,以起到降低胆固醇的目的。目前多种微生物中胆盐水解酶已得到纯化和分离,如乳杆菌、双歧杆菌、肠球菌、梭状芽孢杆菌、类杆菌和链球菌等[17],也有越来越多的学者利用基因工程技术,将有关编码胆盐水解酶的基因转入到适当的宿主菌中进行诱导和表达,如大肠杆菌,以获取高产量的酶蛋白质产品。但由于大肠杆菌中重组蛋白BSH主要以包涵体的形式存在,因此影响了胆盐水解酶机理的研究。本研究通过基因工程技术实现了4种胆盐水解酶在L.plantarumST-Ⅲ的过表达,与对照L.plantarumST-Ⅲ相比,重组菌在含有0.05%牛磺胆酸钠的MRS培养基中细胞生长均有不同程度的提高,这可能与BSHs的表达提高了L.plantarumST-Ⅲ的胆盐耐受性有关。通过茚三酮显色法测定了表达4 种BSHs重组菌的酶活,结果显示ST-Ⅲ/bsh1酶活最高,为76.59 U/mL,是对照的2.25倍;其次是重组菌ST-Ⅲ/bsh3和ST-Ⅲ/bsh2,酶活性分别是对照L.plantarumST-Ⅲ的1.97和1.45倍,而以ST-Ⅲ/bsh4重组菌的酶活性最低,较对照仅提高了17%。从实验结果中我们推测BSH1可能具有较其他三种BSHs更高的水解胆盐的能力,其次为BSH3,而BSH2和BSH4在L.plantarumST-Ⅲ中对牛磺酸结合胆盐的水解能力较弱。
[1]Klaver E,Meer R. The assumed assimilation of cholesterol by lactobacilli and Bifidobacterium bifidum is due to their bile salt deconjugation activity[J]. Appl Environ Microbiol,1993,59:1120-1124.
[2]Li G J. Intestinal probiotics:Interactions with bile salts and reduction of cholesterol[J]. Procedia Environmental Sciences,2012,12:1180-1186.
[3]Smet,I De,Hoorde,L Van,Saeyer N De,et al.Invitrostudy of bile salt hydrolase(BSH)activity of BSH isogenic Lactobacillus plantarum 80 strains and estimation of cholesterol lowering through enhanced BSH activity[J]. Microbial Ecology in Health and Disease,1994,7(6):315-329.
[4]Liu,Z,Guo,B,Wang,Y,et al. Cholesterol removal from media by Lactobacillus plantarum ST-Ⅲ[J]. Milchwissenschaft,2008,
63,134-137.
[5]任婧,姚晶. 植物乳杆菌ST-Ⅲ胆盐水解酶的表达及其酶活力分析[J]. 食品科学,2012,33(17):165-168.
[6]Ren J,Sun K J,Wu Z J,et al. All 4 bile salt hydrolase proteins are responsible for the hydrolysis activity inLactobacillusplantarumST-Ⅲ[J]. J Food Sci,2011,76(9):622-628.
[7]赵时玮,任婧,王荫榆,等. 植物乳杆菌JPP2胆盐水解酶相关基因克隆和表达[J]. 工业微生物,2012,42(1):34-38.
[8]黄芮,黄璐,潘道东,等. 植物乳杆菌LactobacillusplantarumYI菌株胆盐水解酶基因(bsh)的克隆及重组表达[J]. 南京师范大学学报:自然科学版,2010,33(3):91-96.
[9]杨士芹,满朝新,曲行光,等. 不同来源胆盐水解酶基因在大肠杆菌中的表达[J]. 食品科学,2013,34(7):144-147.
[10]吴国峰,李国全,马永. 工业发酵分析[M]. 北京:化学工业出版社,2006.
[11]Corzo G,Gilliland S E. Measurement of bile salt hydrolase activity fromLactobacillusacidophilusbased on disappearance of conjugated bile salts[J]. J Dairy Sci,1999,82:466-471.
[12]刘慧,杜薇,张红星. 乳酸乳球菌乳酸亚种高产胆盐水解酶发酵条件的优化研究[J]. 食品科学,2006,27(11):322-326.
[13]刘慧,熊利霞,李金锭,等. 藏灵菇源干酪乳杆菌KL1 高产胆盐水解酶发酵条件的优化研究[J]. 中国农学通报,2008,24(12):114-118.
[14]Lambert J M,Bongers R S,de VOS W M,et al. Functional analysis of four bile salt hydrolase and penicillin acylase family members inLactobacillusplantarumWCFS1[J]. Appl Environ Microbiol,2008,74(15):4719-4726.
[15]Moser,S A,Savage D C. Bile salt hydrolase activity and resistance to toxicity of conjugated bile salts are unrelated properties in lactobacilli[J]. Appl Environ Microbiol,2001,67:3476-3480.
[16]Begley M,Hill C,Gahan C G. Bile salt hydrolase activity in probiotics[J]. Appl Environ Microbiol,2006,72(3):1729-1738.
[17]Kim G B,Lee B H. Biochemical and molecular insights into bile salt hydrolase in the gastrointestinal microflora:a review[J]. Asian-Aust J Anim Sci,2005,18:1505-1512.
Gene expression of the bile salt hydrolase inLactobacillusplantarumST-Ⅲ
HUANG Yan-na1,BI Xue-wei2,YOU Chun-ping1,*
(1.State Key Laboratory of Dairy Biotechnology,Dairy Research Institute,Bright Dairy & Food Co.,Ltd.,Shanghai 200436,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Bile salt hydrolase(BSH),the enzyme deconjugating bile potentially plays an important role in reduction of blood cholesterol level,which has received a widespread attention. In this study,the recombinantLactobacillusplantarumST-Ⅲ were constructed by overexpressing four BSH genes and the BSH enzyme activities were determined. The result showed thatL.plantarumST-Ⅲ harboring BSH1 had a higher enzyme activity than the other three strains,then was the strains harboring BSH3 and BSH2,and the lowest activity was shown in ST-Ⅲ overexpressing BSH4,which indicated that the BSH1 might play a more important role in the hydrolysis of the conjuncted bile salts,then was BSH3,BSH2 and BSH4 successively.
Bile salt hydrolase;LactobacillusplantarumST-Ⅲ;gene clone and overexpression;enzyme activity
2015-12-02
黄艳娜(1980-),女,博士,工程师,研究方向:益生菌代谢工程及代谢调控,E-mail:huangyanna@brightdairy.com。
游春苹(1981-),女,博士,高级工程师,研究方向:益生菌功能,E-mail:youchunping@brightdairy.com。
国家“十二五”科技支撑计划(2013BAD18B01, 2013BAD18B02)。
TS201.3
A
1002-0306(2016)11-0113-05
10.13386/j.issn1002-0306.2016.11.015

