鲢鱼滑在冻藏过程中的结构变化
林天泉,范大明,黄建联,周文果,张文海,周 琳,陈 卫,3,赵建新,张 灏,*
(1.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122;2.福建安井食品股份有限公司,福建厦门 361022;3.北京工商大学,北京食品营养与人类健康研究中心,北京 100048)
鲢鱼滑在冻藏过程中的结构变化
林天泉1,范大明1,黄建联2,周文果2,张文海2,周琳1,陈卫1,3,赵建新1,张灏1,*
(1.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122;2.福建安井食品股份有限公司,福建厦门 361022;3.北京工商大学,北京食品营养与人类健康研究中心,北京 100048)
为研究鲢鱼滑在-20 ℃冻藏过程中的结构变化,测定了鲢鱼滑盐溶性蛋白含量、活性巯基含量和Ca2+-ATPase活性,并结合圆二色光谱(CD)、扫描电镜(SEM)和低场核磁(LF-NMR)进行分析。结果发现,三个指标随冻藏时间延长逐渐下降,其中盐溶性蛋白含量从新鲜状态的58.2 mg/g降至17.3 mg/g,活性巯基含量从0.598 mol/105g降至0.204 mol/105g,Ca2+-ATPase活性从0.214 μmol/min·g降至0.051 μmol/min·g;CD扫描结果显示,冻藏初期α-螺旋主要向β-折叠转化,后主要转化为无规则结构;SEM结果显示,鲢鱼滑凝胶结构由于失水而逐渐收缩,表面光滑度降低,凝胶网络结构受损;LF-NMR的T2谱显示-20 ℃环境下有两种结合水的横向弛豫时间,分别为T21(0.09~1 ms)和T22(1~10 ms),随着冻藏时间的延长,T21无明显变化,T22总体呈现下降趋势,可知蛋白内部对水分的束缚力增强。从结构变化角度探究了鲢鱼滑在冻藏过程的品质变化。
鲢鱼滑,冻藏,蛋白质,结构变化
鱼滑是将鱼体经过采肉、漂洗、脱水后,进行绞碎,再加食盐、辅料等进行擂溃至粘稠状的鱼糜制品,因其味道鲜美、口感爽脆、品种多样,同时具有高蛋白、低脂肪的特点,日益为消费者熟知和喜爱[1]。鲢鱼肉营养丰富,以其为原料制成鱼滑可为其作为低值淡水鱼的转化和增值提供广阔的发展空间。由于鲢鱼滑水分及蛋白含量高,易发生变质,冻藏可有效控制微生物繁殖速率并防止腐败变质,延长货架期,但在冻藏过程中会发生蛋白质冷冻变性,其内部空间结构发生改变,导致外观、风味、质地变差[2],因此针对鲢鱼滑在冻藏期间的品质变化及机理的研究具有实用意义。目前国内外针对鱼滑的研究鲜见报道,刘洪亮[3]以不同鱼糜为原料制备鱼滑,研究不同鱼糜对其品质的影响,但并未探讨冻藏对鱼滑品质及结构的影响。而针对鱼肉在冻藏过程中的变化的研究较多,任丽娜[4]通过圆二和拉曼光谱分析鲢鱼肉肌原纤维蛋白溶液,发现在冻藏过程中,肌原纤维蛋白分子的α-螺旋结构发生变化,部分转化为β-折叠和无规卷曲结构,使蛋白质构象的紧密程度和稳定性有较大程度降低。Shann-Tzong Jiang[5]研究虱目鱼在-20 ℃冻藏18周后可溶肌动球蛋白含量和Ca2+-ATPase活性的变化,发现两者均降低。借助这些研究手段有助于明晰鲢鱼滑在冻藏过程中的结构变化。
本文通过测定盐溶性蛋白含量、活性巯基含量和Ca2+-ATPase活性,辅以圆二色光谱、扫描电镜和低场核磁等手段,探讨鲢鱼滑蛋白质在-20 ℃冻藏过程的结构变化,旨为抑制鱼滑蛋白质冷冻变性的研究提供理论支持。
1 材料与方法
1.1材料与仪器
新鲜鲢鱼购于无锡华润万家超市,体长为(35±3) cm,体重为(2000±200) g,体色银白;食盐市售;聚乙烯肠衣福建安井食品有限公司提供;纱布同盛卫生材料厂;色谱瓶上海兴纳生物科技有限公司;圆柱体塑料小皿广州市昕迪实验器材有限公司;氯化钾,钼酸铵,米吐尔,磷酸二氢钠,磷酸氢二钠,磷酸二氢钾,三羟甲基氨基甲烷(Tris),马来酸(Mal),十二烷基磺酸钠(SDS),乙二胺四乙酸(EDTA),浓硫酸,戊二醛国药集团化学试剂有限公司,均为分析纯;二硫代硝基苯甲酸(DTNB)Sigma公司,分析纯;BCA试剂盒上海碧云天生物技术有限公司。
MO-385型莫菲绞肉机佛山桃花岛电器有限公司;实验斩拌机福建安井食品有限公司;SU504型手动U型封口机河北衡水鸿昊企业有限责任公司;手动灌肠机福建安井食品有限公司;双槽恒温水浴锅南京先欧仪器制造公司;MK3型全自动酶标仪美国Thermos Scientific公司;LGJ-15D型冷冻干燥机北京四环科学仪器厂;D-78532型高速冷冻离心机德国Hettich公司;MOS-450型圆二色光谱仪法国Biologic公司;UV-1800型紫外-可见光分光光度计日本岛津公司;TM3030型扫描电子显微镜日本Hitachi公司;MiniMR-60型低频核磁共振仪上海纽迈电子科技公司;定时恒温磁力搅拌器上海沪西分析仪器有限公司。
1.2实验方法
1.2.1工艺流程鲢鱼→去头、鳞、皮及内脏→手工采肉→绞肉(直径为3 mm)→漂洗→脱水→斩拌→装样
操作要点如下:
漂洗:用以鱼肉质量5倍体积的5 ℃的去离子水将采得的鱼肉漂洗2次,再用0.3%的NaCl(5 ℃以下)漂洗1次,每次漂洗5 min,静置3 min后倾去水及表面杂质;
脱水:用纱布挤压脱水至水分为80%~85%[5](用烘干法[6]测定鱼肉水分);
斩拌:以500 g为一份进行斩拌,空斩2 min,加蒸馏水调水分至85%,再加2.5%的食盐斩拌3 min,制成鱼滑;
装样:一部分灌入直径为25 mm的聚乙烯肠衣中(长度为15 cm),供SEM观察用;一部分装入色谱瓶中(约1 g),供低场核磁T2谱测定用;剩余部分灌入圆柱体塑料小皿(直径40 mm,高17 mm)中,用刮板将样品表面刮平后盖上盖子,用于测定其他指标。除新鲜状态的样品外其他样品装好后立即放入-20 ℃冷柜中冻藏,以冻藏1、3、7、15、25、40、60、90 d为测试时间点取样进行4 ℃空气解冻,测定各指标[7]。
1.2.2盐溶性蛋白提取与测定参照Lian P Z等[8]的方法进行盐溶性蛋白的提取和测定。在每个测试时间点从塑料小皿取10 g鱼滑加入100 mL低盐离子磷酸缓冲液(0.05 mol/L的KCl,0.02 mol/L的NaH2PO4-Na2HPO4),用高速分散器以1500 r/min匀浆5 min,然后用高速冷冻离心机匀浆液在9000 r/min,4 ℃条件下离心10 min后取沉淀加入高盐离子磷酸缓冲液(0.6 mol/L的KCl,0.02 mol/L的NaH2PO4-Na2HPO4),充分匀浆后置于4 ℃环境中抽提1 h,抽提完毕用高速冷冻离心机在9000 r/min、4 ℃条件下离心10 min。上清液即为肌原纤维蛋白溶液。盐溶性蛋白含量采用BCA法测定[9]。
1.2.3活性巯基含量的测定参照Yongsawatdigul J等[10]的方法进行活性巯基含量测定。取1 mL肌原纤维蛋白溶液,加入9 mL 0.2 mol/L的Tris-Mal缓冲液(pH7.0),其中含有2%的SDS和10 mmol/L的EDTA,充分混匀后,取出4 mL该液体,向其中加入0.04 mL 0.1%的DTNB溶液(溶于0.2 mol/L的Tris-Mal缓冲液中,pH8.0)。在40 ℃条件下水浴加热25 min,然后测定其在412 nm处的吸光值,以13600 L/(mol·cm)摩尔消光系数计算总巯基含量(SH)。空白组用0.6 mol/L的KCl溶液代替。计算式为:
1.2.4Ca2+-ATPase活性的测定参考Liu R[11]的测定方法并稍作修改,计算式为:
活性=(A-B)/(T×酶蛋白质含量)
式中,A为1 mL反应液生成的磷酸含量(μmol),B为空白值(μmol),T为反应时间(min),酶蛋白质含量为1 mL反应液中含的酶量(mg)。
1.2.5圆二色光谱(CD)测定参照Liu R等[11]的方法进行CD光谱的测定。取每个时间点的肌原纤维蛋白溶液,用去离子水将浓度稀释为0.1 mg/mL,采用MOS-450圆二色光谱仪,选用光径为0.1 cm的石英样品池,在远紫外区(190~250 nm)对0.1 mg/mL的蛋白液进行扫描,得出远紫外CD谱后,用SELCON3程序模拟得出α-螺旋、β-折叠、转角和无规则卷曲二级结构单元的百分比。圆二色性用平均残基椭圆值[θ]表示,单位为del·cm2·dmol-1。
1.2.6扫描电镜(SEM)观察参照Yongsawatdigul J[10]等的方法进行SEM制样及观察。将灌入肠衣的样品取出,采用二段式加热,45 ℃、90 ℃分别加热3 min,冷却后切成2 mm×1 mm×2 mm的小块,用质量分数为3%的戊二醛溶液将其浸泡,在4 ℃下固定24 h,再用浓度为0.1 mol/L的磷酸盐缓冲液(pH7.2)漂洗3次,依次用质量分数30%、50%、70%、90%和100%的乙醇溶液梯度脱水10 min,脱水后样品采用冷冻干燥机干燥。在真空离子溅射喷金后,用SEM观察,加速电压为20 kV。
1.2.7T2弛豫时间测定将每个测试时间点的样品取出放入冻融核磁系统中,在-20 ℃下恒温约15 min后,使用核磁共振分析软件以及反演软件测试样品的T2谱,实验参数为CPMG:P90(μs)=2.6,P180(μs)=5.6,SW(kHz)=250,RFD(μs)=10,TW(ms)=1000,RG1=30,DRG1=3,NS=64,TE(ms)=0.0656,NECH=1000,PRG=2。
1.3数据分析
采用SPSS19.0软件对实验数据进行方差分析和显著性分析,使用Microsoft Excel 2013软件作图。
2 结果与分析
2.1冻藏过程中盐溶性蛋白含量的变化
盐溶性蛋白含量是反映鱼糜及其鱼糜制品蛋白质结构变化的有效指标[12]。图1显示了鲢鱼滑的盐溶性蛋白含量随冻藏时间的延长所发生的变化。

图1 冻藏过程中鲢鱼滑盐溶性蛋白含量的变化Fig.1 Changes in salt extractable protein content of silver carp slide during frozen storage
可见在冻藏期间,盐溶性蛋白含量呈现逐步下降的趋势,在25 d下降速率较快(p<0.05),之后随着冻藏时间的延长,下降速率有所减小,说明在冻藏初期,冰晶形成对鲢鱼滑蛋白结构产生较大影响,之后逐渐达到平衡,使下降速率减缓[12]。冻藏90 d后,盐溶性蛋白含量从新鲜状态的58.2 mg/g降至17.3 mg/g,降幅为70.3%。这与张静雅[13]针对白鲢鱼糜蛋白冷冻变性的研究结果一致,在冻藏过程中,由于与肌动球蛋白结合的部分结合水形成冰晶,肌动球蛋白为维持原有的稳定性,相互之间生成氢键、疏水键、二硫键和盐键,形成不溶性聚集体,导致盐溶性降低。
2.2冻藏过程中活性巯基含量的变化
肌球蛋白分子中含有三类活性巯基:SH1、SH2和SHa,前两者分布在肌球蛋白的头部,与Ca2+-ATPase活性密切相关,后者分布于轻酶解肌球蛋白,与肌球蛋白重链的氧化密切相关。因此活性巯基含量的变化在一定程度上反映了肌球蛋白的变性程度[14]。鲢鱼滑的活性巯基含量随冻藏时间的变化规律如图2所示。
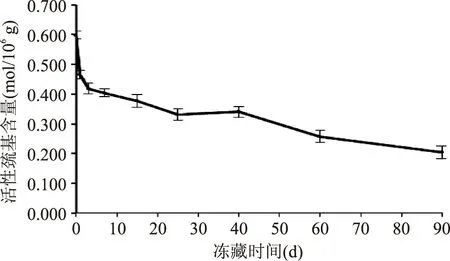
图2 冻藏过程中鲢鱼滑活性巯基含量的变化Fig.2 Changes in active sulfhydryl content of silver carp slide during frozen storage
冻藏期间,鲢鱼滑的活性巯基含量随冻藏时间的延长总体上呈现下降趋势,与盐溶性蛋白含量的变化趋势相关性较高(r=0.971),这与Chudima[15]的研究结果相符。这是因为在冻藏过程中,蛋白质发生聚集变性,活性巯基被逐渐氧化为二硫键,导致活性巯基含量降低。在40 d时活性巯基的含量产生波动,稍有上升,这可能是因为鲢鱼滑内部的肌原纤维蛋白在聚集变性的同时部分肽链展开,暴露出分子内部的巯基,仍未被氧化为二硫键,导致含量升高。王发祥等[16]在研究中也发现冻藏期间草鱼肌原纤维蛋白分子内部的巯基会暴露出来,进而被氧化为二硫键。冻藏90 d后,活性巯基含量从新鲜状态的0.598 mol/105g降至0.204 mol/105g,降幅为65.9%。
2.3冻藏过程中Ca2+-ATPase活性的变化
Ca2+-ATPase位于鱼肉肌球蛋白的球状头部,在冻藏过程中,Ca2+-ATPase活性会由于冰晶形成和离子强度的升高发生改变,因此其常作为评价肌原纤维蛋白冷冻变性的指标[14],鲢鱼滑的Ca2+-ATPase活性随冻藏时间的变化规律如图3所示。
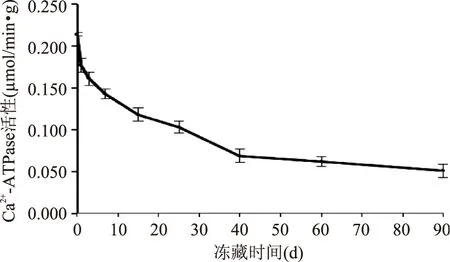
图3 冻藏过程中鲢鱼滑Ca2+-ATPase活性的变化Fig.3 Changes in Ca2+-ATPase activity of silver carp slide during frozen storage
鲢鱼滑的Ca2+-ATPase活性随冻藏时间的延长逐渐下降(p<0.05),与活性巯基含量的下降趋势具有较高的相关性(r=0.957)。在冻藏前40 d,Ca2+-ATPase活性下降速率较大,在冻藏初期尤为明显;冻藏90 d后,Ca2+-ATPase活性从新鲜状态的0.214 μmol/min·g降至0.051 μmol/min·g,降幅为76.1%。Benjakul等[17]认为Ca2+-ATPase活性的下降是由于形成的冰晶促使蛋白质三级结构发生改变,蛋白发生了聚集变性,体系内离子强度上升,蛋白质分子之间发生相互作用导致的。
2.4冻藏过程中蛋白二级结构的变化
为进一步研究冻藏过程中鲢鱼滑肌原纤维蛋白二级结构的变化,采用CD光谱仪对冻藏期间的肌原纤维蛋白水溶液进行扫描,结果如图4所示。
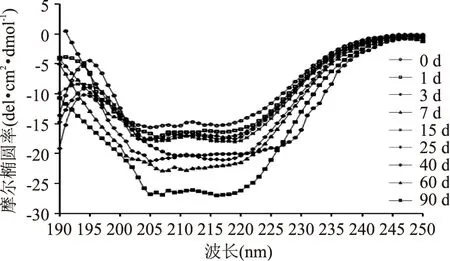
图4 冻藏过程中鲢鱼滑肌原纤维蛋白溶液的CD光谱变化Fig.4 Changes in CD spectra of myofibrillar protein solution of silver carp slide during frozen storage
图4显示在冻藏初期,鲢鱼滑样品在192~195 nm出现正峰,具有α-螺旋结构特点。在208 nm及222 nm出现的α-螺旋特征负峰,随着冻藏时间的延长逐渐变小;在216 nm处出现β-折叠特征负峰[18]。
表1显示了利用SELCON3拟合程序估算得出的鲢鱼滑肌原纤维蛋白二级结构含量。由表1可知,在90 d冻藏期间,α-螺旋结构含量从32.7%下降至15.4%。冻藏7 d后,α-螺旋结构含量与0 d时相比较低,具有显著性差异(p<0.05)。而β-折叠结构含量从10.1%升高到90 d的20.6%。冻藏7 d后,β-折叠含量百分比数值与0 d时相比具有显著性差异(p<0.05);转角结构含量稍有降低,但规律不明显;无规则结构含量增加至46.7%。在冻藏初期,α-螺旋结构含量降低,β-折叠结构含量升高,转角结构和无规则结构含量无明显变化,说明α-螺旋结构解旋,主要向β-折叠结构转化,推测是因为冻藏初期蛋白质结构发生变化形成分子内氢键,促使天然α-螺旋结构转化为较为稳定的β-折叠结构[19]。随着冻藏期的延长,β-折叠结构含量趋于稳定,α-螺旋结构主要转化为无规则结构。

表1 冻藏过程中鲢鱼滑肌原纤维蛋白
2.5冻藏过程中超微结构的变化
图5为鲢鱼滑样品在各个时间点的扫描电镜图。由图5可见,新鲜状态下的鲢鱼滑凝胶结构光滑均一且呈现多孔结构,形成的凝胶网络较好;经过冻藏处理,样品开始出现片层结构,且伴有聚集体的产生,出现鳞片化趋向[13],表明蛋白质有失水现象。冻藏时间越长,失水程度越高,光滑度和密实度越低,形成的凝胶更为杂乱;冻藏90 d后,样品蛋白形成的凝胶由于失水严重出现较大颗粒的聚集体并伴有断裂、破碎现象,结构发生收缩,这说明冻藏期间的失水现象影响了肌原纤维蛋白的凝胶形成能力。

图5 不同冻藏时期鲢鱼滑凝胶的扫描电镜图(2500×)Fig.5 Scanning electron micrographs of silver carp slide during different frozen storage(2500×)
2.6冻藏过程中T2的变化
T2弛豫时间反映了样品内部氢质子所处的化学环境,与氢质子所受的束缚力及其自由度有关,而氢质子的束缚程度又与样品的内部结构密切相关。水分子与底物结合越紧密,氢质子受束缚越大或自由度越小,T2弛豫时间越短,反之则T2弛豫时间越长[20-21]。测定冻结状态下不同冻藏时间下的鲢鱼滑的弛豫时间T2,可以得出鲢鱼滑内部未冻结水的分布情况,辅助分析冻藏过程中其内部结构的变化,从图6中看出冻结状态下鲢鱼滑样品的T2谱有两个峰,分别为T21(0.09~1 ms)与T22(1~10 ms),而10 ms之后没有信号,这与Ahmad M U等[21]定义的1~10 ms的信号属于结合水的结论相符。初步推测T21为与鲢鱼滑肌原纤维蛋白大分子结合的强结合水,T22为弱结合水。图7显示了T21、T22及T22峰面积百分比(P22)随冻藏时间的变化。P22可用来估算氢质子的相对含量。T21无明显变化,可能是由于这部分结合水含量极少且与肌原纤维蛋白分子结合紧密,因此冻藏导致的变化很小;随着冻藏时间的延长,T22总体呈现下降趋势,可知样品蛋白三维结构发生聚集,对水分的束缚力增强,同时由P22逐渐下降的规律可以推测有部分弱结合水被挤出蛋白三维网络结构,自由度变高,可能形成冰晶,导致其相对含量降低。而在第7 d时T22有所增大的原因还需进一步探讨。由此可见,测定鲢鱼滑的T2分布可在一定程度上反映其结构的变化。
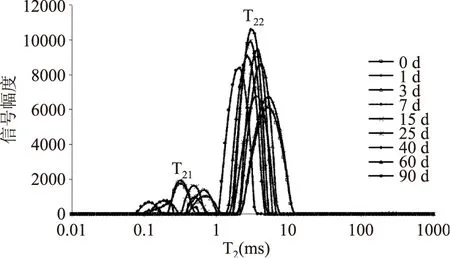
图6 不同冻藏时期鲢鱼滑的T2谱图Fig.6 T2 spectra of silver carp slideduring different frozen storage
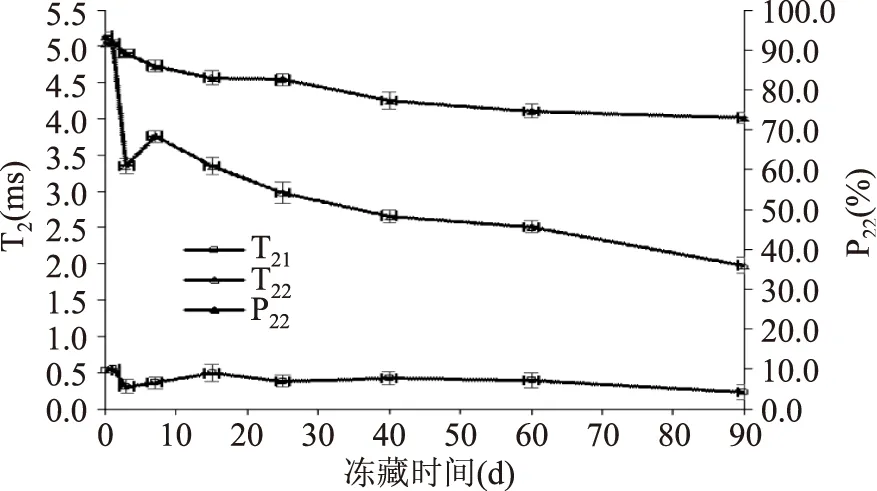
图7 冻藏过程中鲢鱼滑T21、T22及P22的变化Fig.7 Changes in T21,T22and P22 of silver carp slide during frozen storage
3 结论
本研究分析了鲢鱼滑在冻藏过程中的盐溶性蛋白含量、活性巯基含量、Ca2+-ATPase活性、蛋白二级结构、超微结构及T2弛豫时间的变化。前三个指标呈下降趋势;CD结果显示,在冻藏初期,α-螺旋结构向β-折叠结构转化,转角和无规则结构含量无明显变化,之后α-螺旋结构逐渐转化无规则结构;SEM结果显示凝胶结构逐渐收缩,表面光滑度下降,凝胶形成能力降低;T2谱显示T21(0.09~1 ms)和T22(1~10 ms)两个信号峰,推测分别为与鲢鱼滑肌原纤维蛋白大分子结合的强结合水和弱结合水。随着冻藏时间的延长,T22发生左移,说明样品内部对水分束缚力增强。本研究从结构变化角度分析鲢鱼滑在冻藏过程中的变化,能够为其蛋白质冷冻变性的机制探讨提供重要的参考依据。明确鲢鱼滑在冻藏过程中的结构变化可为研究其蛋白冷冻变性机制提供基础,进而开发出有效的保护剂。
[1]李国军.鱼滑的制作[J].农产品加工(创新版),2012,8(10):51.
[2]Chen H S,Kong B H,Guo Y Y,et al.The effectiveness of cryoprotectants in inhibiting multiple freeze-thaw-induced functional and rheological changes in the myofibrillar proteins of common carp(Cyprinuscarpio)surimi[J].Food Biophysics,2013,8(4):302-310.
[3]刘洪亮,张庆玉,王颖,等.不同鱼糜对鱼滑加工品质的影响[J].食品研究与开发,2015,36(18):35-38.
[4]任丽娜.白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D].无锡:江南大学,2014.
[5]Jiang S T,Hwang B S,Tsao C Y.Protein denaturation and changes in nucleotides of fish muscle during frozen storage[J]. Journal of Agricultural and Food Chemistry,1987,35(1):22-27.
[6]GB/T 5009.3-2010,食品中水分的测定[S].北京:中国标准出版社,2010.
[7]邓泽新,廖泉,吴卫国.海藻糖对草鱼鱼糜肌原纤维蛋白冷冻变性作用的影响[J].农产品加工(学刊),2014(4):13-15,18.
[8]Lian P Z,Lee C M,Hufnagel L.Physicochemical properties of frozen red hake(Urophycischuss)mince as affected by cryoprotective ingredients[J].Journal of Food Science,2000,65(7):1117-1123.
[9]韩富亮,袁春龙,郭安鹊,等.二喹啉甲酸法(BCA)分析蛋白多肽的原理、影响因素和优点[J].食品与发酵工业,2014(11):202-207.
[10]Yongsawatdigul J,Park J W.Thermal denaturation and aggregation of threadfin bream actomyosin[J].Food Chemistry,2003,83(3):409-416.
[11]Liu R,Zhao S M,Xiong S B,et al.Studies on fish and pork paste gelation by dynamic rheology and circular dichroism[J]. Journal of Food Science,2007,72(7):399-403.
[12]FBadii,NKHowell.A comparison of biochemical changes in cod(Gadusmorhua)and haddock(Melanogrammusaeglefinus)fillets during frozen storage[J].Journal of the Science of Food and Agriculture,2002,82(1):87-97.
[13]张静雅.白鲢鱼糜蛋白的冷冻变性机理及抗冻剂的应用研究[D].合肥:合肥工业大学,2012.
[14]周爱梅,龚杰,邢彩云,等.罗非鱼与鳙鱼鱼糜蛋白在冻藏中的生化及凝胶特性变化[J].华南农业大学学报,2005(3):103-107.
[15]Chudima.Physicochemical Changes of Four Tropical Fish(Bigeyesnapper,bigeyecroaker,lizardfishandthreadfin)Muscle
Proteins during Frozen Storage and their Gelling Ability[D]. Thailand:Prince of Songkla University,2002.
[16]王发祥,李强,俞健,等.草鱼冷藏过程中肌肉蛋白质结构特征的变化[J].食品与发酵工业,2015(6):196-199.
[17]Benjakul S,Visessanguan W,Thongkaew C,et al.Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J].Food Research International,2003,36(8):787-795.
[18]Greenfield N J.Applications of circular dichroism in protein and peptide analysis[J].Trac-Trends In Analytical Chemistry,1999,18(4):236-244.
[19]Sánchez-González I,Carmona P,Moreno P,et al.Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and Raman spectroscopy[J].Food Chemistry,2008,106(1):56-64.
[20]杨赫鸿,李沛军,孔保华,等.低场核磁共振技术在肉品科学研究中的应用[J].食品工业科技,2012(13):400-405.
[21]Ahmad M U,Tashiro Y,Matsukawa S,et al.Gelation mechanism of surimi studied by1H NMR relaxation measurements[J].Journal of Food Science,2007,72(6):362-367.
Structural changes of silver carp slide during frozen storage
LIN Tian-quan1,FAN Da-ming1,HUANG Jian-lian2,ZHOU Wen-guo2,ZHANG Wen-hai2,ZHOU Lin1,CHEN Wei1,3,ZHAO Jian-xin1,ZHANG Hao1,*
(1.State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Fujian Anjoyfood Share Co.,Ltd.,Xiamen 361022,China;3.Beijing Innovation Centre of Food Nutrition and Human Health,Beijing Technology & Business University,Beijing 100048,China)
To analyze the structural changes of silver carp slide during frozen storage,the salt extractable protein content,active sulfhydryl content and Ca2+-ATPase activity were evaluated with circular dichroism spectra(CD),low-field nuclear magnetic resonance(LF-NMR)and scanning electron microscopy(SEM). The results indicated that these three indexes were decreased with the extension of storage time. The salt extractable protein content,active sulfhydryl content and Ca2+-ATPase activity were decreased from 58.2 mg/g to 17.3 mg/g,0.598 mol/105g to 0.204 mol/105g and 0.214 μmol/min·g to 0.051 μmol/min·g respectively. CD analysis showed thatα-helix transformed toβ-sheet first during early period,then transformed to random coil. SEM results indicated that silver carp slide gel shrank due to dehydration gradually,which caused the reduction of surface smoothness and gel-forming ability. The LF-NMR T2transverse relaxation time data demonstrated that the two bound water populations were T21(0.09~1 ms)and T22(1~10 ms). With the extension of frozen time,T21had no significant changes,while T22decreased on the whole,it indicated that the internal moisture binding force was enhanced. It provided biological evidences to discuss the changes of the quality of silver carp slide during frozen storage.
silver carp slide;frozen storage;protein;structural changes
2016-01-05
林天泉(1991-),男,硕士研究生,研究方向:食品生物技术,E-mail:lintianq@163.com。
张灏(1962-),男,教授,研究方向:食品生物技术,E-mail:zhanghao@jiangnan.edu.cn。
江苏省产学研联合创新资金(SBY2015020156);“十二五”农村领域国家科技计划课题(2014BAD04B03);“十二五”农村领域国家科技计划课题(2012BAD28B05-04)。
TS254.4
A
1002-0306(2016)12-0155-06
10.13386/j.issn1002-0306.2016.12.022

