冻融冻藏中卡拉胶对面筋蛋白分子量及超微结构的影响
汪星星,余小林,胡卓炎,周沫霖,赵 雷
(华南农业大学食品学院,广东广州 510642)
冻融冻藏中卡拉胶对面筋蛋白分子量及超微结构的影响
汪星星,余小林,胡卓炎,周沫霖,赵雷*
(华南农业大学食品学院,广东广州 510642)
实验采用空间排阻色谱和多角度激发光光散射联用(SEC-MALLS)、聚丙烯酰胺凝胶电泳(SDS-PAGE)以及扫描电镜(SEM)研究面筋蛋白在冻融冻藏(以10 d作为一个冻融周期,在每个冻融周期的第5 d,将冷冻在-18 ℃的样品升温至0 ℃,并在此温度下保持12 h后降温至-18 ℃继续冻藏)中添加卡拉胶对面筋蛋白分子量及其分布、蛋白质亚基、自由巯基含量及超微结构的影响。结果表明,随着冻融时间的延长,面筋蛋白的分子量下降,主要集中在105~106u,添加卡拉胶明显减缓了分子量下降。冻融过程中,面筋蛋白亚基没有发生变化,自由巯基含量增加,相同时间下添加卡拉胶组面筋蛋白的自由巯基含量低于空白组,冻融120 d后空白组为4.89 μmol/g而卡拉胶添加组为4.13 μmol/g。通过SEM观察超微结构,冻融过程中空白组面筋蛋白网络结构明显弱化,冻融120 d后有直径50 μm的孔洞出现,而卡拉胶添加组孔洞大小相对均一。说明添加卡拉胶能有效减缓冰晶对面筋蛋白的破坏,抑制面筋蛋白解聚作用。
面筋蛋白,卡拉胶,冻融,分子量及分布,超微结构
随着烘焙行业的快速发展,冷冻技术被越来越多的应用到面团生产中,冷冻面团技术得到迅速发展[1]。但是冷冻储藏过程会对面团品质和稳定性产生极大的负面影响,温度的波动使冰晶发生重结晶,水分迁移和重新分布,导致蛋白质交联作用减弱从而破坏面筋蛋白的网络结构,使面团出现裂纹、持气力下降、比容减小、面包品质下降、货架期缩短等问题[2-3]。已有研究报道面筋蛋白在面制品中发挥着重要作用,而长时间的冻藏会对面筋蛋白的分子链及聚集态产生明显的影响[4-5],如何降低冻藏过程对面筋蛋白的破坏程度是冷冻面团行业面临的挑战之一。
本实验采用空间排阻色谱和多角度激发光光散射联用(SEC-MALLS)、聚丙烯酰胺凝胶电泳(SDS-PAGE)、Ellman’s试剂比色法以及扫描电镜(SEM)等方法,探讨冻融冻藏过程中卡拉胶对面筋蛋白分子量及其分布、自由巯基以及超微结构的影响,以期为卡拉胶在冷冻面团中的作用机理提供理论基础。
1 材料与方法
1.1材料与仪器
高筋面粉深圳市泰东源实业有限公司;卡拉胶、牛血清白蛋白Sigma公司;冰乙酸、5,5′-二硫代双(2-硝基苯甲酸)(DTNB)、甲叉双丙烯酰胺(Bis)、丙烯酰胺(Acr)、四甲基乙二胺(TEMED)、过硫酸铵、三羟甲基氨基甲烷(Tris)、甘氨酸、盐酸、盐酸胍等均为分析纯。
JJJM54S面筋洗涤仪上海嘉定粮油仪器有限公司;Watrs高效液相色谱、Waters717紫外检测器美国Waters;Biosep SEC-4000凝胶色谱柱美国Phenomenex;Optilab rEX示差检测器、DAWN HELEOSII十八角度光散射仪检测器美国Wyatt;DYCZ-24DN电泳仪北京市六一仪器厂;XL-30-ESEM扫描电镜荷兰FEI公司。
1.2实验方法
1.2.1面筋蛋白的制备参考赵雷的方法[5]。准确称取10.0 g小麦面粉于面筋洗涤仪洗涤杯中,洗涤两次,第一次采用250 mL NaCl溶液(5%)去除淀粉和球蛋白,第二次采用250 mL蒸馏水去除NaCl和清蛋白,洗涤完成后,用碘-碘化钾溶液确定淀粉被完全去除。冷冻干燥、粉碎、过120目筛,置于干燥器中保存备用。
1.2.2样品的处理及冻融样品的处理:称取两组10.0 g面筋蛋白,分别缓慢溶于100 mL蒸馏水中,空白组不加卡拉胶,另一组加入0.9%(90 mg)卡拉胶,置于磁力搅拌器上搅拌120 min,于4 ℃下静置8 h后取出,3500 r/min下离心20 min去除上层水分,-80 ℃预冻2 h后,置于-18 ℃冷冻储藏。冻融方式:以10 d作为一个冻融周期,在每个冻融周期的第5 d,将样品放入0 ℃中保持12 h后放入-18 ℃继续冻藏,如此往复。在第0、60、120 d分别取样,将取出的样品冷冻干燥、粉碎、过120目筛,得到不同冻融时间的样品。
1.2.3面筋蛋白溶液的制备取0.5 g面筋蛋白样品,缓慢加入到25 mL乙酸溶液(500 mmol/L)中,磁力搅拌24 h。将溶解后的样品,12000 r/min离心30 min,上清液保存备用。
(5) 川藏高速公路的大规模修建,人类活动在短时间内对坡体的应力场、渗流场、温度场等产生了较大的改变,使原有的自然营力条件下形成的边坡稳定性失去平衡而导致崩塌的发生,这是工程建设期间崩塌灾害呈现大规模上升的直接原因。
1.2.4SEC-MALLS测定采用 SEC-MALLS 测量面筋蛋白分子量分布时,用乙酸溶液将上清液配制成浓度3 mg/mL的蛋白溶液,流动相为500 mmol/L的乙酸溶液,紫外检测波长为220 nm。分离条件:流速1.0 mL/min,进样量150 mL,柱温40 ℃。仪器校正的方法按照文献[12]方法操作,采用牛血清白蛋白BAS为标准品,测得比折光指数增量dn/dc=(0.1767±0.0028) mL/g。
1.2.5SDS-PAGE电泳参考Panozzo[13]的实验方法。分离胶浓度为13%,浓缩胶浓度为4%,样品缓冲液为:62.5 mmol/L Tris-HCl,10%丙三醇,2% SDS,5%巯基乙醇,pH6.8。上样量:5 μL;80 V 40 min,120V 60 min稳压电泳,照相分析。
1.2.6自由巯基含量的测定参考Stathopoulos[14]的实验方法。取75 mg样品与1 mL Tris-Gly缓冲液(pH=8.0)混匀后加4.7 g盐酸胍,用缓冲液定容至10 mL。取样液1 mL加4 mL脲(8 mol/L)和0.1 mL DTNB(4 mg/mL),混匀后于412 nm处测吸光值。自由巯基含量(-SH)的计算公式如式(1)。
自由巯基含量(μmol/g)=73.53×A412D/C
式(1)
式中:A412:412 nm 处的吸光值;D:稀释因子(2.51);C:样品浓度(mg/mL)。
1.2.7扫描电镜的测定将面筋蛋白冷冻干燥后切断,经离子溅射喷金后,置于扫描电子显微镜下观察样品横断面的结构。
1.2.8数据分析取3次测定结果的平均值,数据采用OriginPro8.0作图。利用Duncan’s新复极差检验(p<0.05),评价样品平均值之间的差异显著性。
2 结果与讨论
2.1冻融过程中添加卡拉胶对面筋蛋白分子量及分布的影响
图1为空白组和添加0.9%卡拉胶的面筋蛋白经不同冻融时间后的紫外图谱。在4.0~14.0 min之间持续有物质被洗脱出来,分别在5.35、7.60、10.8和11.8 min左右出现了4个峰。根据空间排阻色谱法的原理,在7.00 min之前被洗脱出来的是面筋蛋白高分子聚合物,而7.00 min之后洗脱出来的是分子量相对较小的蛋白质。对于未添加卡拉胶的空白组面筋蛋白,随着冻融时间的延长紫外图谱中各峰的保留时间都有所延长,峰1的保留时间从未冻藏时的5.37 min增加到冻融120 d后的5.44 min,峰2由未冻藏时的7.51 min增加到冻融120 d后的7.62 min,延长0.11 min,说明整个冻融过程中,面筋蛋白的分子量会下降,主要归因于冻融过程中温度的上下波动引起冰晶的生长和迁移对面筋蛋白造成破坏,使面筋蛋白中高分子量聚合物发生解聚,并且解聚程度随着冻融时间的延长而加剧[4]。添加卡拉胶后的面筋蛋白峰1的保留时间从5.35 min增长到冻融120 d时的5.43 min,峰2的保留时间几乎没有明显的变化,说明添加卡拉胶可以减少冻融时间对面筋蛋白分子量的影响。
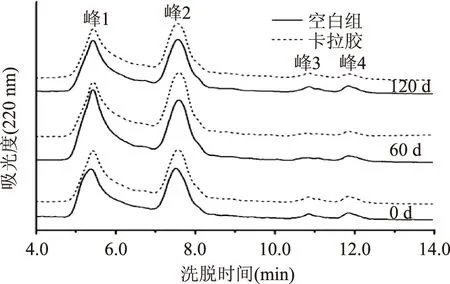
图1 空白组和添加卡拉胶组面筋蛋白不同冻融时间后经SEC分离后检测的紫外图谱Fig.1 SEC profiles showing changes in gluten with carrageenan after freeze-thaw for different time
图2是空白组和卡拉胶添加组的面筋蛋白经不同冻融时间后重均分子量的分布图。如图所示,面筋蛋白的分子量在105~109u之间,分布广泛,在洗脱时间为7.50 min分子量达到最低之后有一定的上涨趋势,这可能是因为面筋蛋白中残留少量的清蛋白和球蛋白,而这两种分子量较小的蛋白会跟随小分子量的麦谷蛋白被洗脱出来,从而影响dn/dc的数值,当dn/dc发生变化时必然会影响重均分子量的计算,导致出现分子量上升的现象[12]。这部分蛋白质分子量低于105u,研究表明小麦面筋蛋白中高分子量谷蛋白聚合物含量的高低是影响面团和面包品质好坏的重要因素之一,因此高分子量聚合物的变化是研究的重点。
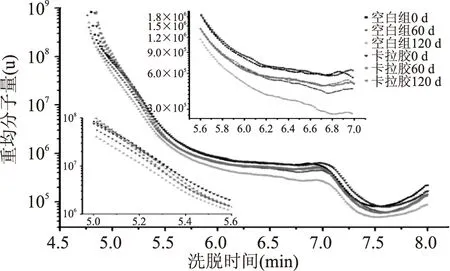
图2 空白组和添加卡拉胶组面筋蛋白经不同冻融时间后重均分子量的变化Fig.2 Effect of carrageenan on molecular mass of gluten protein after freeze-thaw for different time
由图2可以看出,当洗脱时间为4.70~5.60 min时,面筋蛋白分子量分布范围为106~108u,在此范围内冻融时间对面筋蛋白的分子量影响较小;对于空白组,随着冻融时间的延长,面筋蛋白的分子量随之下降,冻融120 d下降最明显;而添加卡拉胶的面筋蛋白分子量变化小于空白组。当洗脱时间为5.60~7.00 min时,面筋蛋白的分子量分布范围在105~2×106u,冻融时间对面筋蛋白的分子量变化的影响显著。对于空白组,冻融60 d后面筋蛋白的分子量从原样品的6.0×105~1.8×106u下降到6.0×105~1.5×106u,冻融120 d后分子量进一步下降到3.0×105~1.2×106u左右,说明0~-18 ℃的温度波动导致了面筋蛋白中的水分发生了剧烈的迁移和重结晶现象,这种机械作用的结果使面筋蛋白发生解聚现象,集中在105~106u范围内,并且随着时间的延长,蛋白质解聚越严重,分子量降低越明显;而对于添加卡拉胶的面筋蛋白,其分子量的大小和分布与空白组0 d没有明显差别,随着冻融时间的延长,分子量也会下降,但下降趋势较小。当冻融时间达到60 d时,分子量从原样品的6.0×105~1.8×106u下降到6.0×105~1.5×106u左右,延长冻融时间至120 d时,分子量几乎没有变化,并且都接近空白组冻融60 d样品的分子量。由于卡拉胶具有很好的持水性和稳定性,在冻融冻藏过程中能够有效的抑制水分的迁移和冰晶体积的变大,减少冰晶体对面筋蛋白的破坏,保护面筋蛋白的网络结构[15];也有研究发现卡拉胶易与低分子量的疏水蛋白通过含硫的基团发生交联作用[9],使低分子量的蛋白聚集在一起,冻融冻藏过程中添加卡拉胶组的面筋蛋白重均分子量的下降程度相比空白组要小。
2.2冻藏过程中添加卡拉胶对蛋白质亚基的影响
图3为空白组和卡拉胶添加组面筋蛋白经过不同冻融时间后的SDS-PAGE电泳图。根据SDS-PAGE电泳的原理,HWM-GS(High molecular weight glutenin subunits,高分子量麦谷蛋白亚基)处于凝胶板的上部,醇溶蛋白处在下部[13]。从图3的电泳条带可以很直观的看出,蛋白质分子量在25 ku处有很明显的分界,25 ku分子量以上的蛋白质占较大比例,25 ku以下则含量很少。分子量在75~150 ku之间有三条很清晰的条带,属于HWM-GS,分子量最大且迁移率最慢;37~50 ku之间的是ω-醇溶蛋白,迁移率较慢。25~37 ku之间图谱的颜色较深,含量较多,是LWM-GS(Low molecular weight glutenin subunits,低分子量麦谷蛋白亚基)和α/β,γ-醇溶蛋白的混合物,分子量较小,迁移率很快。最底端的部分是含量极少的清蛋白和球蛋白,分子量最小,迁移率最快。空白组面筋蛋白,经过不同冻融时间电泳条带数目和相对迁移率没有发生明显变化。添加卡拉胶的面筋蛋白样品经过不同冻融时间后其电泳条带也没有发生变化,而在37 ku处电泳条带颜色加深,是该分子量蛋白的含量增多。卡拉胶的添加使之形成蛋白-多糖分散体系,增加了蛋白的亲水性,使蛋白的溶解性增加[16-17],样液蛋白质浓度增加造成的条带颜色加深。但从整个电泳图谱来看,电泳条带数量没有发生变化,说明蛋白质亚基没有发生变化。在整个冻融冻藏过程中,无论是否添加卡拉胶,面筋蛋白的亚基都不会随着冻融时间的延长产生明显变化。
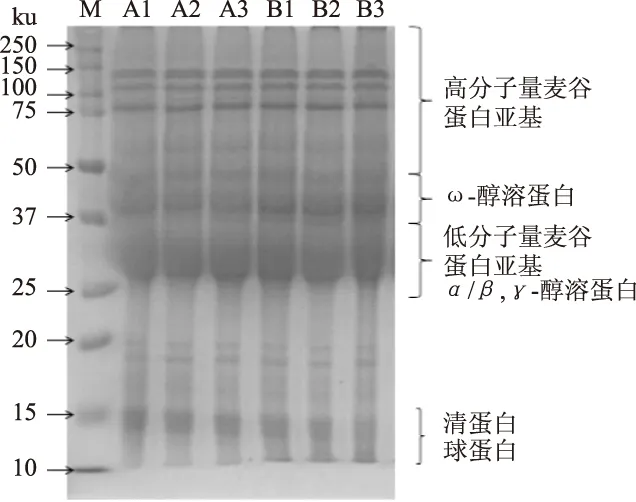
图3 面筋蛋白SDS-PAGE电泳图Fig.3 SDS-PAGE of gluten 注:A1、A2、A3分别为空白组面筋蛋白冻融0、60、120 d的电泳条带,B1、B2、B3分别为添加卡拉胶的面筋蛋白冻融合0、60、120 d的电泳条带。
2.3冻藏过程中添加卡拉胶对面筋蛋白自由巯基含量的影响
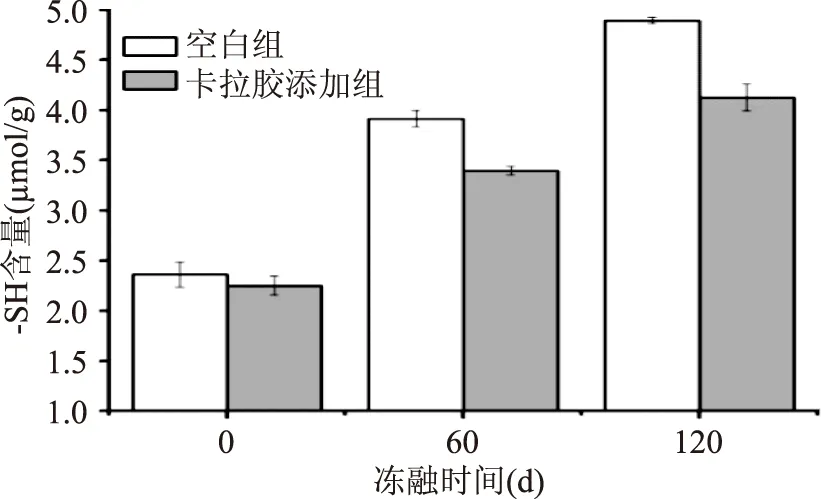
图4 空白组和添加卡拉胶组面筋蛋白经不同冻融时间后自由巯基含量的变化Fig.4 Effect of carrageenan on-SH content of gluten after freeze-thaw for different time
图4为空白组和卡拉胶添加组面筋蛋白经不同冻融时间后自由巯基的含量,反映二硫键在冻融过程中的变化。由图4可知,随着冻融时间的延长,所有面筋蛋白中自由巯基的含量均呈现增加的趋势;对于空白组,未冻藏时面筋蛋白的自由巯基含量为2.36 μmol/g,冻融60 d和120 d后自由巯基含量显著增加,分别达到3.92 μmol/g和4.89 μmol/g(p<0.05),说明随着冻融时间的延长,面筋蛋白分子内和分子间的二硫键发生断裂,自由巯基含量增加,分子量下降。而卡拉胶添加组的面筋蛋白,在未冻藏时自由巯基含量为2.25 μmol/g,冻融后其含量也会上升,冻融60 d和120 d 后分别增加到3.42 μmol/g和4.13 μmol/g,均接近空白组冻融60 d时自由巯基的含量,且由图2可知,添加卡拉胶冻融60 d和120 d后面筋蛋白的分子量略微下降,但都接近空白组冻融60 d后的实验结果。这充分说明面筋蛋白在反复冻融过程中二硫键会发生断裂,形成自由巯基,导致面筋蛋白高聚物发生解聚,分子量降低[18];而添加卡拉胶能够在一定程度上保护二硫键防止断裂,抑制面筋蛋白发生解聚。
2.4冻藏过程中添加卡拉胶对面筋蛋白超微结构的影响
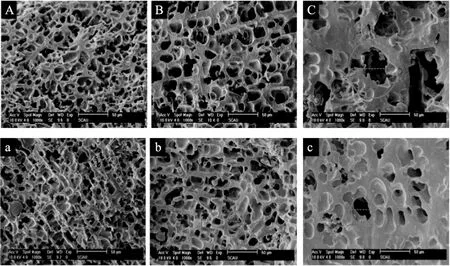
图5 面筋蛋白的SEM图(1000×)Fig.5 SEM photographs of gluten after different for freeze-thaw time(1000×)注:A、B、C分别为空白组面筋蛋白冻融0、60、120 d的SEM图,a、b、c分别为添加卡拉胶的面筋蛋白冻融0、60、120 d的SEM图。
图5为空白组和卡拉胶添加组面筋蛋白经不同冻融时间放大1000倍下的扫描电镜图。由图可看出,面筋蛋白呈现三维网络结构,随着冻融时间的延长,面筋蛋白的网络结构仍然存在,但是孔径增加。对于空白组,未冻藏的面筋蛋白呈现三维网络状结构,孔洞分布均匀且大小均一,直径在10~15 μm左右;冻融60 d后,网络发生了明显的疏松,孔径大小增大到20~30 μm;冻融120 d后,可以清晰的看出面筋蛋白网络结构的弱化,孔隙变得大小不一,有直径超过50 μm的孔洞出现,说明水分的迁移和冰晶体的生长与重结晶会对面筋蛋白的网络结构造成破坏,对它的超微结构产生影响,并且这种影响随着冻融时间的延长而加剧。添加卡拉胶的面筋蛋白在未冻藏时呈现绵密细致的孔径分布,冻融60 d后孔径略有变化,约为15~20 μm,但仍然分布均匀,冻融120 d后,面筋蛋白产生了大小不一的孔洞,有聚集的小孔洞和分散的大孔,但是其被破坏程度远小于空白组样品。在冻融冻藏过程中,冰晶体的迁移和重结晶导致二硫键的断裂和分子量的下降,引起面筋蛋白的微观结构的弱化,添加卡拉胶能有效抑制冻融过程对面筋蛋白网络结构的破坏,卡拉胶具有较强的吸水性,吸水后充分分散在面筋蛋白中,使面筋蛋白形成更加均匀的网络结构,并且卡拉胶的存在能够减缓水分的迁移,降低冰晶的生长速度,减弱了由于冰晶生长造成的面筋蛋白网络结构的破坏,从而保护面筋蛋白的超微结构[19]。3结论
冻藏时间延长和温度波动导致面筋蛋白发生解聚作用,分子量明显下降,尤其是在105~106u,冻融120 d后面筋蛋白的分子量从原样品的6.0×105~1.8×106u下降到3.0×105~1.2×106u,麦谷蛋白和醇溶蛋白亚基没有产生变化,但自由巯基含量增加,冻融120 d空白组面筋蛋白自由巯基含量增加到4.89 μmol/g,网络结构明显弱化。而添加卡拉胶后,冻融过程中分子量也会下降,但是相对较小,冻融120 d后重均分子量在6.0×105~1.5×106u左右,自由巯基含量与空白组相比也较低,为4.13 μmol/g,说明卡拉胶在一定程度上保护二硫键不被破坏,抑制了解聚现象的发生。二硫键断裂和分子量下降与面筋蛋白网络结构有密切联系,卡拉胶能有效抑制冻融过程对面筋蛋白微观结构的破坏,添加卡拉胶的面筋蛋白在未冻藏时显示出绵密细致的孔径分布,冻融120 d后孔径大小仍然相对均一,被破坏程度远小于空白组。综上所述,卡拉胶对于提高面筋蛋白的冷冻稳定性具有良好效果,对面筋蛋白具有一定的保护作用。
[1]Wang P,Xu L,Nikoo M,et al. Effect of frozen storage on the conformational,thermal and microscopic properties of gluten:comparative studies on Gluten-,Glutenin-and Gliadin-rich fractions[J].Food Hydrocolloids,2014,35:238-246.
[2]Ding X,Zhang H,Wang L,et al. Effect of barley antifreeze protein on thermal properties and water state of dough during freezing and freeze-thaw cycles[J]. Food Hydrocolloids,2015,47:32-40.
[3]李杰平,杨哪,徐学明. 冻结和冻藏对冷冻面团流变学以及汤包皮质构特性的影响[J]. 食品工业科技,2012,33(7):71-74.
[4]Zhao L,Li L,Liu G Q,et al. Effect of frozen storage on molecular weight,size distribution and conformation of gluten by SAXS and SEC-MALLS[J]. Molecules,2012,17(6):7169-7182.
[5]赵雷. 冻藏对面筋蛋白分子量、链结构及聚集态影响的研究[D]. 广州:华南理工大学,2012.
[6]Correa M J,Ferrer E,Anon C,et al. Interaction of modified celluloses and pectins with gluten proteins[J]. Food Hydrocolloids,2014,35:91-99.
[7]赵雷,汪星星,胡卓炎,等. 小角 X-射线法解析恒温冻藏过程对面筋蛋白分子链结构的影响[J]. 现代食品科技,2016,32(1):1-7.
[8]Dodic J,Pejin D,Dodic S,et al. Effects of hydrophilic
hydrocolloids on dough and bread performance of samples made from frozen doughs[J]. Journal of Food Science,2007,72(4):235-241.
[9]Leon A,Ribotta P,Ausar S,et al. Interactions of different carrageenan isoforms and flour components in breadmaking[J]. Journal of Agricultural and Food Chemistry,2000,48:2634-2638.
[10]Rosell C,Rojas J,Benedito C,et al. Influence of hydrocolloids on dough rheology and bread quality[J]. Food Hydrocolloids,2001,15(1):75-81.
[11]Selomulyo V,Zhou W. Frozen bread dough:effects of freezing storage and dough improvers[J]. Journal of Cereal Science,2007,45(1):1-17.
[12]Bean S,Lookhart G. Factors influencing the characterization of gluten proteins by size exclusion chromatography and multiangle laser lightscattering(SEC MALLS)[J]. Cereal Chemistry,2001,78:608-618.
[13]Panozzo A,Manzocco L,Lippe L,et al. Effect of Pulsed Light on Structure and Immunoreactivity of Gluten[J]. Food Chemistry,2016,194:366-372.
[14]Stathopoulos C,Tsiami A,David J,et al. Effect of heat on rheology,surface hydrophobicity and molecular weight distribution of glutens extracted from flours with different bread-making quality[J]. Journal of Cereal Science,2008,47:134-143.
[15]Kamińska A,Matusiak M,Samborska K,et al. The influence of kappa carrageenan and its hydrolysates on the recrystallization process in sorbet[J]. Journal of Food Engineering,2015,167:162-165.
[16]孙哲浩. 蛋白质与多糖类在水相介质中交互作用机理的研究[D].广州:华南理工大学,2001.
[17]Spada C,Marczak L,Tessaro C,et al. Interactions between soy protein from water-soluble soy extract and polysaccharides in solutions with polydextrose[J]. Carbohydrate Polymers,2015,134:119-127.
[18]Zhao L,Li L,Liu G Q,et al. Effect of Freeze-thaw Cycles on the Molecular Weight and Size Distribution of Gluten[J]. Food Research International,2013,53(1):409-416.
[19]Linlaud N,Rerrer E,Puppo M C,et al. Hydrocolloid interaction with water,protein and starch in wheat dough[J]. Journal of Agricultural and Food Chemistry,2011,59:713-719.
Effects of carrageenan on the molecular weight and microstructure of gluten during freeze-thaw cycles storage
WANG Xing-xing,YU Xiao-lin,HU Zhuo-yan,ZHOU Mo-lin,ZHAO Lei*
(College of Food Science,South China Agricultural University,Guangzhou 510642,China)
In this paper,the effects of freeze-thaw cycles(frozen at-18 ℃ with cycling to 0 ℃ for 12 h and then back to -18 ℃ per 10 days)on molecular weight and distribution,protein subunits,free sulfhydryl group and microscopic property of gluten with carrageenan were studied by the multiangle laser light scattering(MALLS)in combination with size exclusion chromatography(SEC),sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE)and scanning electron microscopy(SEM). The results showed that during the freeze-thaw cycles,the molecular weight of the gluten was significantly decreased,especially in 105~106u,while the molecular weight of the gluten added carrageenan descreased slightly contrast with the control. The SDS-PAGE profiles revealed that there were no remarkable difference and relative mobilities of band for the gluten protein subunits. The free sulphydryl group content increased during the storage,the 4.89 μmol/g for control compared with 4.13 μmol/g for the gluten added carrageenan stored for 120 days,which implying the carrageenan can offer protection to the disulfide bonds. SEM photographs showed that the network was weakened with increasing freeze-thaw cycles storage time,the pore size of the control sample was increased to 50 μm after stored for 120 days,while the gluten added carrageenan was highly uniform in size. These results indicated that the addition of carrageenan could reduce the depolymerisation caused by recrystallization and protect the structure of gluten.
gluten;carrageenan;freeze-thaw;molecular weight and distribution;microscopic property
2015-12-18
汪星星(1991-),女,硕士研究生,研究方向:农产品加工与贮藏,E-mail:xwzm627@163.com。
赵雷(1982-),男,副教授,研究方向:天然产物及高附加值修饰,E-mail:zl00700@163.com。
国家自然科学基金项目(31301412);广东省自然科学基金项目(S2013040014403);广东省科技计划项目(2015A020209143)。
TS210.1
A
1002-0306(2016)12-0089-05
10.13386/j.issn1002-0306.2016.12.009

