河蚬盐溶蛋白的提取及其加工特性
王伯华,王晨曦,刘丽萍,杨品红,周顺祥
(1.湖南文理学院生命与环境科学学院,湖南 常德 415000;2.环洞庭湖水产健康养殖及加工湖南省重点实验室,湖南 常德 415000;3.顺祥食品有限公司,湖南 益阳 413200)
河蚬(Corbicula fluminea)是一种杂食性双壳贝类。河蚬生长速度快、繁殖率高,环境适应能力强,常常成为当地水域的优势底栖种群。河蚬不仅在我国太湖、洪泽湖、洞庭湖、大通湖等各大水域都有分布,且已传播遍布世界各地,常被国外列入高危入侵物种[1]。河蚬肉质鲜嫩,营养价值高[2],具有抑制肿瘤[3-4]、增强免疫力[5]、抗氧化[6-7]等多种生理活性。我国每年以数万吨的规模出口鲜活河蚬至国外[8],国内对河蚬的加工利用率较低,鲜销为主,少部分以蚬干、罐头等产品形式存在。因此,开展河蚬资源的综合利用研究十分必要。
盐溶蛋白主要指肌原纤维蛋白,是一类结构蛋白,在肌肉中具有重要功能,含量高,约占蛋白总量的50%左右。盐溶蛋白与肌肉的嫩度、口感紧密相关,生物学性质重要[9]。盐溶蛋白具有在热诱导条件下形成凝胶的能力,这对肉制品的保水性、质构、风味等特征极其重要[10]。不同肉类的盐溶蛋白含量不同,理化性质各异,加工性能差异显著[11]。关于畜禽类盐溶蛋白功能特性[12-13]的研究较多,也有学者进行了鲢鱼[14]、鲨鱼[15]、鱿鱼[16]、河蚌[17]等水产品盐溶蛋白特性的研究,而目前关于河蚬盐溶蛋白的研究尚未见报道。
本试验优化了河蚬盐溶蛋白的提取条件,并对其不同温度时的持水性、持油性、起泡能力、乳化性质等加工性能进行了探究,以期为河蚬的高值化加工提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜河蚬(壳长2.0 cm~3.0 cm):市售;大豆分离蛋白(食品级):山东富禾生物科技有限公司;植物调和油(食品级):山东鲁花集团有限公司;氢氧化钠、氯化钠、碘化钾、硫酸(分析纯):国药集团化学试剂有限公司;硫酸铜、酒石酸钾钠、盐酸(分析纯):天津市科密欧化学试剂有限公司;牛血清白蛋白(分析纯):北京驰明瑞生物科技有限公司。
1.2 仪器与设备
pH-40A型pH计:杭州陆恒生物有限公司;LD4-2A离心机:北京恒奥德科技有限公司;A-88匀浆机:江苏省金坛市医疗仪器厂;AL204天平:北京赛多利斯仪器系统有限公司;WFZ UV-2000分光光度计:尤尼柯(上海)仪器有限公司;TDL-40B离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 河蚬盐溶性蛋白的提取方法
1)暂养取肉:将新鲜河蚬置于清水中,暂养1d~2d,至其吐出泥沙。去壳取肉备用。
2)捣碎:将20 g河蚬肉放入高速组织捣碎机中,加入80 mL 4℃的预冷超纯水,捣成匀浆液。
3)离心:将河蚬匀浆液3 000 r/min离心15 min后去上清液,重复该步骤两次,取出沉淀物放至烧杯中。
4)静置:加入30 mL不同试验浓度的NaCl溶液,将匀浆液置于4℃的环境下,不同试验时间后用纱布对其进行初滤,滤液3 000 r/min离心5 min,所得上清液为河蚬盐溶蛋白,上清液冷冻干燥后,用作功能特性的研究。
1.3.2 盐溶蛋白得率的测定
盐溶蛋白含量的测定及标准曲线的制作采用双缩脲法进行。盐溶蛋白得率计算公式如下。

1.3.3 河蚬盐溶蛋白提取工艺的优化
1.3.3.1 单因素试验
分别在不同 NaCl浓度(0.3、0.4、0.5、0.6、0.7 mol/L)、不同固液比[1∶2、1∶3、1∶4、1∶5、1∶6(g/mL)]、不同浸提时间(5、10、15、20、25 h)、不同浸提 pH 值(4.0、5.0、6.0、7.0、8.0)的条件下提取盐溶蛋白,测定各单因素试验的盐溶蛋白得率。
1.3.3.2 正交试验
利用SPSS 26.0软件设计L9(3)4正交试验,因素水平见表1。

表1 正交试验因素水平Table 1 Factors and levels of orthogonal test
1.3.4 河蚬盐溶蛋白功能特性的研究方法
1.3.4.1 持水性的测定
称取0.3 g冻干样品(m)放入15 mL离心管中,离心管和样品的质量记为m1,向离心管中加入4 mL蒸馏水,混匀。将样品管分别于不同温度(20、30、40、50、60℃)水浴锅中保温30 min,平衡至室温后2 000 r/min离心25 min,离心管和沉淀物的质量记为m2。持水性按公式(1)计算。

1.3.4.2 持油性的测定
称量0.3g冻干样品(m)至具刻度离心管,加入4 mL植物调和油,充分混匀。将水浴锅设置为不同试验温度(20、30、40、50、60℃),样品管分别静置保温 30 min,冷却后于2 000 r/min离心20 min。读取游离油的体积(V)用于计算持油性[18]。持油性按公式(2)计算。

1.3.4.3 起泡性及泡沫稳定性的测定
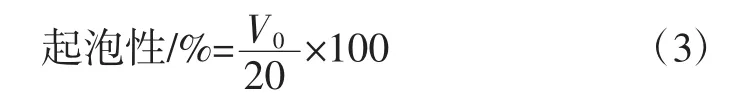
将上述测定起泡性后的样品,静置于室温环境30 min,及时记录泡沫体积(V30)用于计算其稳定性。泡沫稳定性按公式(4)计算。

1.3.4.4 乳化性及乳化稳定性的测定
分别取20 mL不同浓度(0.2%、0.4%、0.6%、0.8%、1.0%)的盐溶蛋白溶液于50 mL烧杯中,匀浆30 s,调节pH值。再加入20 mL大豆油,在10 000 r/min的速度下匀浆1 min后,置于样品管,1 500 r/min离心10 min,记录此时乳化层体积(V1)和离心管中总液体体积(V2)。乳化性按公式(5)计算。

将以上样品置于80℃水浴锅中30 min,取出冷却后离心,记录此时的乳化层体积(V3),计算其稳定性,乳化稳定性按公式(6)计算。

1.4 数据处理
试验重复3次,数据以平均值±标准差表示。采用SPSS 26.0软件进行数据统计及分析。
2 结果与分析
2.1 蛋白质含量标准曲线
图1为采用双缩脲法所得的标准曲线,y=0.097 9x+0.005 1,其R2=0.999 9,拟合度高,可用于后续试验中盐溶蛋白浓度的测定。

图1 蛋白质标准曲线Fig.1 Protein standard curve
2.2 盐溶蛋白提取工艺优化单因素试验
2.2.1 盐浓度对盐溶蛋白得率的影响
盐浓度对盐溶蛋白得率的影响见图2。
新常态的背景下,电商冲击下的连锁零售企业在管理模式上也需要不断地与时俱进,创新体制。接着在现代化信息技术的作用下,实现各个环节的经营管理模式,展现无缝接的体感模式。例如:电商冲击下的连锁零售企业在支付模式上可以进行创新,并在此基础上,开发支付宝支付、微信支付等主要内容。这样不仅满足了消费者的心理状态,同时也可以利用微信,构建属于自身微信公众号,推进商品的品牌性构建,提高忠诚度。

图2 盐浓度对盐溶蛋白得率的影响Fig.2 Effect of salt concentration on salt-soluble protein yield
从图2可知,NaCl浓度低于0.5 mol/L时,盐溶蛋白得率与NaCl浓度呈现正相关,0.5 mol/L时得率达到最高值(6.21%),盐浓度继续增加时,盐溶蛋白得率下降。可见,NaCl浓度0.5 mol/L时盐溶蛋白已基本溶出,盐浓度过高会使得蛋白发生盐析变性,反而降低得率,与李强等[19]的研究情况一致。后续采用NaCl浓度0.5 mol/L进行试验。
2.2.2 固液比对盐溶蛋白得率的影响
固液比对盐溶蛋白得率的影响见图3。

图3 固液比对盐溶蛋白得率的影响Fig.3 Effect of solid-liquid ratio on salt-soluble protein yield
由图 3 可以看出,固液比在 1∶2(g/mL)~1∶5(g/mL)时,提高溶剂的用量,可使盐溶蛋白得率不断增加,达到1∶5(g/mL)之后,盐溶蛋白的提取率不再增加。说明固液比为1∶5(g/mL)时盐溶蛋白已充分溶出,故采用固液比 1∶5(g/mL)进行后续试验。
2.2.3 浸提时间对盐溶蛋白得率的影响
浸提时间对盐溶蛋白得率的影响见图4。

图4 浸提时间对盐溶蛋白得率的影响Fig.4 Effect of leaching time on salt-soluble protein yield
由图4可以看出,通过延长浸提时间,可使盐溶蛋白的溶出更加充分。浸提20 h时,提取率可达7.15%,进一步提高浸提时间,蛋白得率不再继续增加。考虑到提取时间过长也可能造成蛋白质不稳定性增加,而蛋白分子一定程度的变性、沉淀会降低盐溶蛋白得率,后续采用浸提20 h进行试验。本研究结果与宋宏新等[20]的研究结果类似。
2.2.4 pH值对盐溶蛋白得率的影响
pH值对盐溶蛋白得率的影响见图5。

图5 pH值对盐溶蛋白得率的影响Fig.5 Effect of pH value on salt-soluble protein yield
由图5可以看出,pH值在7.0时,盐溶蛋白得率较高。pH值在5.0时,因为接近河蚬蛋白的等电点,蛋白颗粒碰撞概率增大,沉淀增多,造成盐溶蛋白提取量减少。升高pH值偏离等电点后,蛋白表面净电荷增加,电荷排斥作用使得蛋白间结构较松散,与水分子的作用增强,增加了蛋白溶解性,提高了蛋白得率[21]。后续采用pH7.0进行试验。
2.3 盐溶蛋白提取正交试验结果与分析
盐溶蛋白提取正交试验结果见表2。
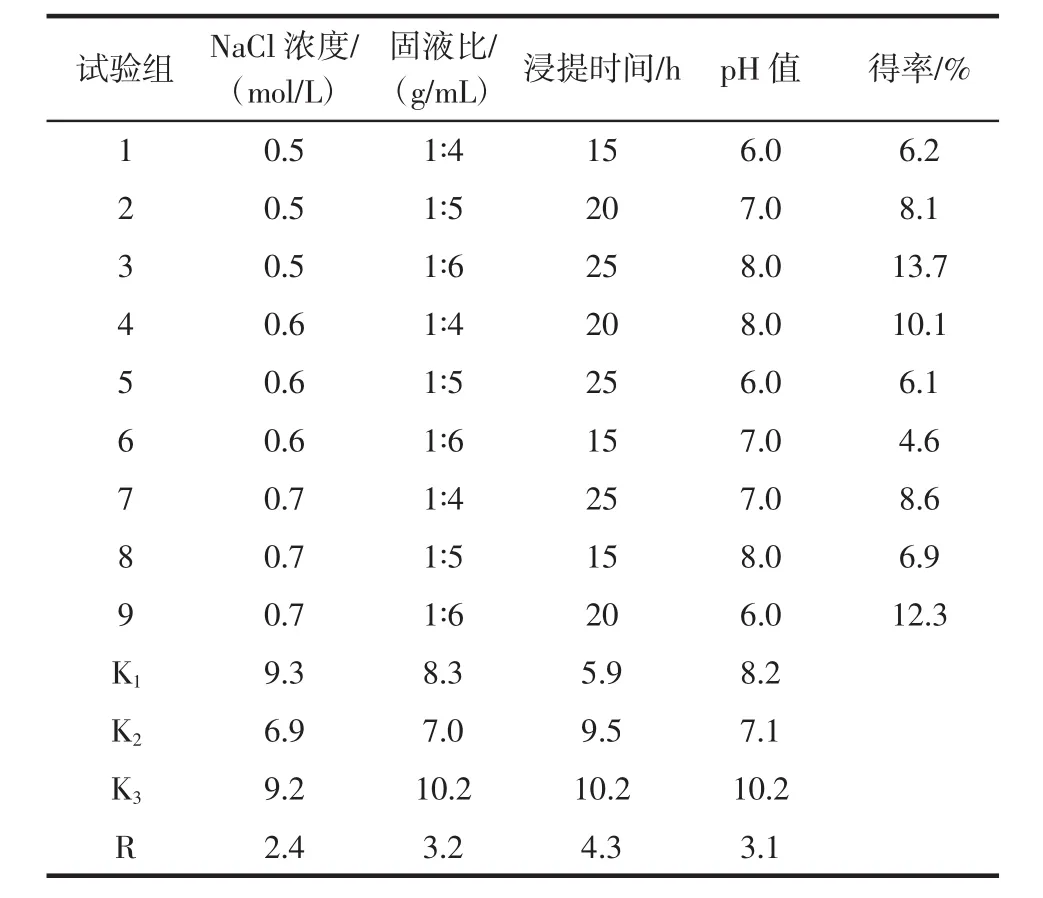
表2 正交试验结果Table 2 Orthogonal test results
由表2可以看出,河蚬盐溶蛋白提取的最佳工艺组合:提取液 NaCl浓度为 0.5 mol/L、固液比 1∶6(g/mL)、浸提时间25 h、pH8.0,对应正交试验组合为A1B3C3D3。根据极差R分析,浸提时间对NaCl溶蛋白提取影响最大,其次为固液比、pH值和NaCl浓度。最佳工艺参数组合正好列在正交试验组3,此时河蚬盐溶蛋白得率达到最大值(13.7%),优于河蚌[17]、鳕鱼[22]、白鲢[14]中盐溶蛋白的得率。
2.4 河蚬盐溶蛋白的加工特性
2.4.1 持水性和持油性
蛋白质持水性和持油性是各类食品加工的重要性能指标。蛋白质持水性佳可以结合极性较强的风味物质,持油性则影响着加工过程中产品对油脂成分的吸收和保持,均有利于产品风味的改善和提升[17]。温度对蛋白质持水性和持油性的影响见图6和图7。

图6 温度对蛋白质持水性的影响Fig.6 Effect of temperature on protein water holding capacity

图7 温度对蛋白质持油性的影响Fig.7 Effect of temperature on protein oil holding capacity
由图6可以看出,温度在20℃~40℃时,河蚬盐溶蛋白的持水性较稳定,30℃时其持水性可达2.41 g/g,40℃之后随温度升高持水性开始减弱。可能是因温度过高导致蛋白质变性,蛋白质-水合作用减弱,导致其持水性下降[23]。与大豆分离蛋白相比,20、30℃时河蚬盐溶蛋白的持水性更低,当温度高于40℃之后,盐溶蛋白持水性更高。
从图7可以看出,河蚬盐溶蛋白的持油性比大豆分离蛋白更优,20℃时其持油性达到最大值(3.16 mL/g)。可能是因其含有较多的亲脂基团,与油脂的结合力较强。河蚬盐溶蛋白与大豆分离蛋白的持油性均随着温度的升高而降低,可能是因为温度升高,油的黏度减弱,更易流动,造成持油性下降[23]。河蚬盐溶蛋白持油性较好,高温时仍能保持稳定的持油性,十分有利于肉糜制品等食品的加工。
2.4.2 起泡能力及泡沫稳定性
蛋白质起泡能力及泡沫稳定性影响到加工过程中起泡或泡沫的形成及保持能力,起泡性能好可以促进食品结构松散,改善适口性。河蚬盐溶蛋白和大豆分离蛋白的起泡性能如图8和图9所示。

图8 蛋白质浓度对起泡性的影响Fig.8 Effect of protein concentration on protein foaming

图9 蛋白质浓度对泡沫稳定性的影响Fig.9 Effect of protein concentration on protein foam stability
由图8可知,与大豆分离蛋白类似,河蚬盐溶蛋白的起泡性与蛋白质浓度整体呈正相关,起泡性最大值为67.8%。因为蛋白质浓度增加时,泡沫界面的亲水和疏水基团数量增多,利于气泡的产生,从而增加其起泡性[24]。
由图9可知,蛋白质浓度在0.4%~1.0%时,河蚬盐溶蛋白的泡沫稳定性不断减弱,泡沫稳定性最大值为65.7%。河蚬盐溶蛋白的起泡能力和泡沫稳定性均弱于大豆分离蛋白。
2.4.3 乳化能力及乳化稳定性
由于蛋白质富含亲水和亲油基团,能够在微小油滴周围形成油水界面,阻止油滴的聚集,促使油相和水相的乳化。河蚬盐溶蛋白的乳化性能见图10和图11。

图10 蛋白质浓度对乳化性的影响Fig.10 Effect of protein concentration on emulsification

图11 蛋白质浓度对乳化稳定性的影响Fig.11 Effect of protein concentration on emulsification stability
由图10可知,随着蛋白浓度增加,河蚬盐溶蛋白乳化性呈上升趋势,乳化性最大为56.8%。因为蛋白质浓度增加使得油水界面吸附的蛋白质增多,界面膜厚度增加,从而改善乳化能力。由图11可知,蛋白质浓度为0.6%时,乳化稳定性可达94.5%。蛋白质浓度继续增加,乳化稳定性有所下降,可能是因为界面吸附的蛋白质浓度达到一定量时,油水界面之间的蛋白质分子相互作用增加,促使油滴聚集,降低了体系的乳化稳定性[25]。河蚬盐溶蛋白的乳化性能总体与大豆分离蛋白相当。
3 结论
本文优化了河蚬盐溶蛋白的提取工艺,在NaCl浓度为 0.5 mol/L、pH8.0、固液比 1∶6(g/mL)时浸提25 h蛋白得率最高,可达到13.7%。对河蚬盐溶蛋白的加工特性进行了测定,发现其持水性最高为2.41 g/g,且在40℃~60℃时高于大豆分离蛋白;持油性可达3.16 mL/g,优于大豆分离蛋白。起泡能力和起泡稳定性分别可达67.8%和65.7%,低于大豆分离蛋白。乳化能力和乳化稳定性最大值分别为56.8%和94.5%,总体与大豆分离蛋白相当。可见,河蚬盐溶蛋白具有较好的加工特性,是良好的功能性蛋白资源。

