HPLC法同时测定党参中5种核苷和碱基
王高峰
(贵州工程职业学院 生命科学系,贵州铜仁 565200)
HPLC法同时测定党参中5种核苷和碱基
王高峰
(贵州工程职业学院 生命科学系,贵州铜仁 565200)
建立了超声辅助提取结合高效液相色谱(HPLC)测定党参中胞苷、尿苷、腺嘌呤、鸟苷和腺苷含量的方法。党参的最佳提取条件为:20倍量的纯净水超声提取60 min,提取2次。采用Venusil MP C18(2)色谱柱(4.6 mm×250 mm,5 μm)分离和测定目标分析物,流动相为甲醇-水梯度洗脱,检测波长260 nm,体积流量1.0 mL/min,柱温35 ℃。结果表明,5种化学成分的质量浓度与峰面积的线性关系良好(R2>0.9995),平均回收率为97.05%~101.08%,RSD≤3.01%。不同产地党参核苷类成分含量有所差异,18个党参样品中胞苷、尿苷、腺嘌呤、鸟苷、腺苷及核苷总量介于68.71~478.82、171.33~629.60、33.63~140.05、221.31~651.37、143.26~511.78、679.87~2011.67 μg/g之间。本研究所建立方法操作简便,精密度、稳定性和重复性良好,准确可靠,适用于党参药材中5种核苷和碱基成分的同时测定,为全面客观地认识党参药材功效物质基础、丰富和发展党参药材多指标评价体系研究提供科学依据。
高效液相色谱法,党参,核苷,碱基
党参(RadixCodonopsis)具有健脾益肺、养血生津等功效,为常用补气中药之一[1],现代药理学研究证实,其水溶性成分具有显著的抗胃溃疡、抗氧化、抗血小板聚集、抗血栓等多种生物活性[2],常用于冠心病、高脂血症、调节胃肠功能、肿瘤等[3]患者的保健和治疗作用。现行版中国药典(2010年版一部)以党参中醇溶性浸出物(45%乙醇)的含量来控制党参药材的质量,规定其质量分数不得少于55.0%,但未明确具体的指标成分,以此作为药材质量控制标准过于笼统[1]。前期研究工作表明,党参中含有腺苷[4]、尿嘧啶[5]等核苷类物质,而核苷类物质具有调节免疫功能、调节血糖、促进肠道修复、降低血压、抗心律失常、抗缺血性损伤等生物活性[6],因此,本实验通过HPLC法建立同时测定党参中核苷及游离碱基成分的方法,对其成分进行定性定量分析,以期为全面客观地认识党参药材物质基础、丰富和发展党参药材多指标评价体系研究提供科学依据。
1 材料与方法
1.1材料与仪器
党参新鲜根山西省平顺县青羊镇老马岭村等地,每份样品均取自30株成熟植株根以保证样品代性,经作者本人鉴定为桔梗科植物党参Codonopsispilosula(Franch.)Nannf. 的干燥根(表1),均为人工栽培样品;甲醇色谱纯,美国Fisher公司;其他试剂均为分析纯;水娃哈哈牌纯净水。
尿苷对照品、腺嘌呤对照品、腺苷对照品(批号:110887-200202、886-200001、110879-200202)中国食品药品检定研究院;胞苷对照品、鸟苷对照品南京都莱生物技术有限公司,纯度大于98%。
LC-20A型高效液相色谱仪日本岛津,PDA检测器;DZF-6050MBE型电热恒温真空干燥箱上海博讯实业有限公司;SB-5200DTN型超声波清洗机宁波新芝生物科技股份有限公司;TDZ5-WS型多管架自动平衡离心机湖南赛特湘仪离心机仪器有限公司;CP225D型分析天平德国Sartorius公司。
1.2实验方法
1.2.1色谱条件色谱柱:VenusilMP C18(2)柱(4.6 mm×250 mm,5 μm);流动相:A相为甲醇,B相为水,进行梯度洗脱(0 min,1% A;10 min,5% A;15 min,15% A;21 min,17% A;25 min,20% A;30 min,24% A);检测波长:260 nm;体积流量:1.0 mL/min;进样量:20 μL;柱温:35 ℃。
1.2.2对照品溶液的制备分别精密称取减压干燥至恒重的胞苷、尿苷、腺嘌呤、鸟苷和腺苷对照品适量,加纯净水溶解并制成质量浓度分别为0.58、0.55、0.55、0.55、0.59 mg/mL的对照品贮备液,备用。
1.2.3供试品溶液的制备精密称取党参粉末(过50目筛)1.0 g,置50 mL具塞锥形瓶中,精密加纯净水20 mL,室温下超声提取60 min(超声功率600 W,工作频率40 kHz),放至室温,摇匀,倒入离心管中,4000 r/min离心10 min,过滤,重复操作1次,合并提取液,以纯净水定容至50 mL量瓶中,用前倒入离心管中,4000 r/min离心15 min,取上清液以0.45 μm 微孔滤膜滤过,即得。
1.2.4标准曲线、检测限和定量限分别精密吸取各对照品贮备液适量,加纯净水定容至25 mL制成混合对照品溶液,胞苷、尿苷、腺嘌呤、鸟苷和腺苷质量浓度分别为58.00、66.00、22.00、110.00、59.00 μg/mL,置于4 ℃的冰箱内,临用前以0.45 μm微孔滤膜滤过。并逐级稀释,得到一系列不同质量浓度的5种核苷混合对照品溶液,在1.2.1项条件下进行测定,以对照品的峰面积(y)对相应的质量浓度(x)进行线性回归,得回归方程、相关系数和线性范围;逐步稀释各对照品溶液,按信噪比(S/N)约为3计算检测限(LOD),以S/N约为10计算定量限(LOQ)。
1.2.5精密度实验分别精密取含胞苷、尿苷、腺嘌呤、鸟苷和腺苷58.00、66.00、22.00、110.00、59.00 μg/mL的混合对照品溶液,按1.2.1项条件下同一天内进样6次,以测定的平均峰面积计算日内精密度;连续测定3 d,以测定的平均峰面积计算日间精密度。
1.2.6重复性实验取同一党参样品6份(S16),按1.2.3项下条件制备供试品溶液,记录其色谱峰面积,通过计算RSD以考察本方法的重复性。
1.2.7稳定性实验将配制好的供试品溶液(S16)在常温条件下密闭放置,分别于0、2、4、8、12、24 h测定,记录其色谱峰面积,通过计算RSD以考察本样品的稳定性。
1.2.8加样回收率实验精密称取已知含量的党参样品约0.50 g(S16),共9份,分别精密加入胞苷、尿苷、腺嘌呤、鸟苷和腺苷对照品贮备溶液适量,按1.2.3项下条件制备供试品溶液,验证本方法的准确性,计算加样回收率。
1.2.9样品含量测定制备18批样品溶液,平行3份,测定其5种核苷和碱基的含量。
1.3数据统计分析
采用SPSS18.0统计软件进行数据处理与分析。
2 结果与讨论
2.1色谱条件的选择与优化
核苷和碱基类化合物极性大,较难分离,本实验比较了以下4种色谱柱Innoval AQ C18柱(250 mm×4.6 mm,5 μm),Venusil XBP C18(L)柱(250 mm×4.6 mm,5 μm),Durashell C18柱(250 mm×4.6 mm,5 μm)和Venusil MP C18(2)柱(250 mm×4.6 mm,5 μm)。实验结果表明,Venusil MP C18(2)柱(250 mm×4.6 mm,5 μm)对5种核苷和碱基类成分达到了良好的分离,第2~3种色谱柱不能很好的分离5种核苷和碱基类成分,而第1种色谱柱峰形较差。同时比较了不同的流动相组成如乙腈-水、甲醇-水、乙腈-甲酸水溶液和甲醇-甲酸水溶液对样品的分离效果,发现甲醇-水做流动相时分析物的分离效果较好。因此最终选择了Venusil MP C18(2)柱(250 mm×4.6 mm,5 μm)和甲醇-水系统梯度洗脱。在190~400 nm下用PDA检测器对混合对照品进行光谱扫描并保存全光谱,可以观测到胞苷、尿苷、腺嘌呤、鸟苷和腺苷在260 nm处都有较大的吸收峰,故选择260 nm作为其检测波长。按照1.2项条件下色谱条件进行分析,各成分分离度良好,对照品和样品色谱图见图1。
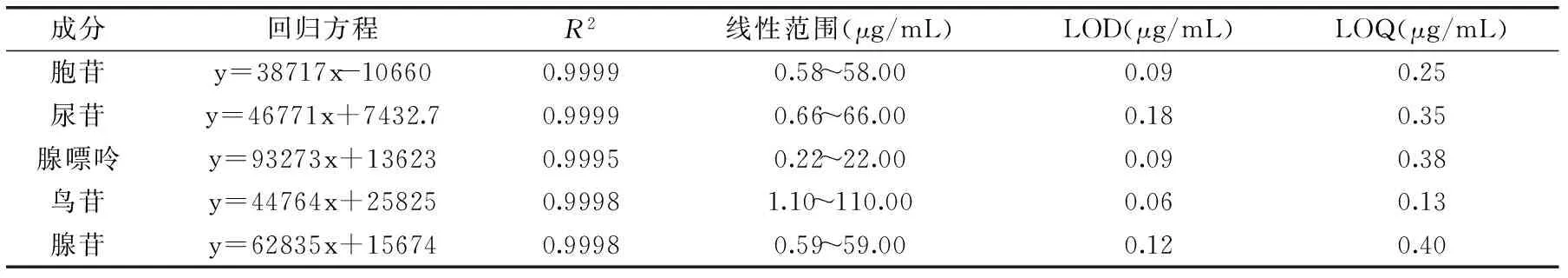
表3 对照品的线性关系和范围Table 3 Linearity and ranges of control products
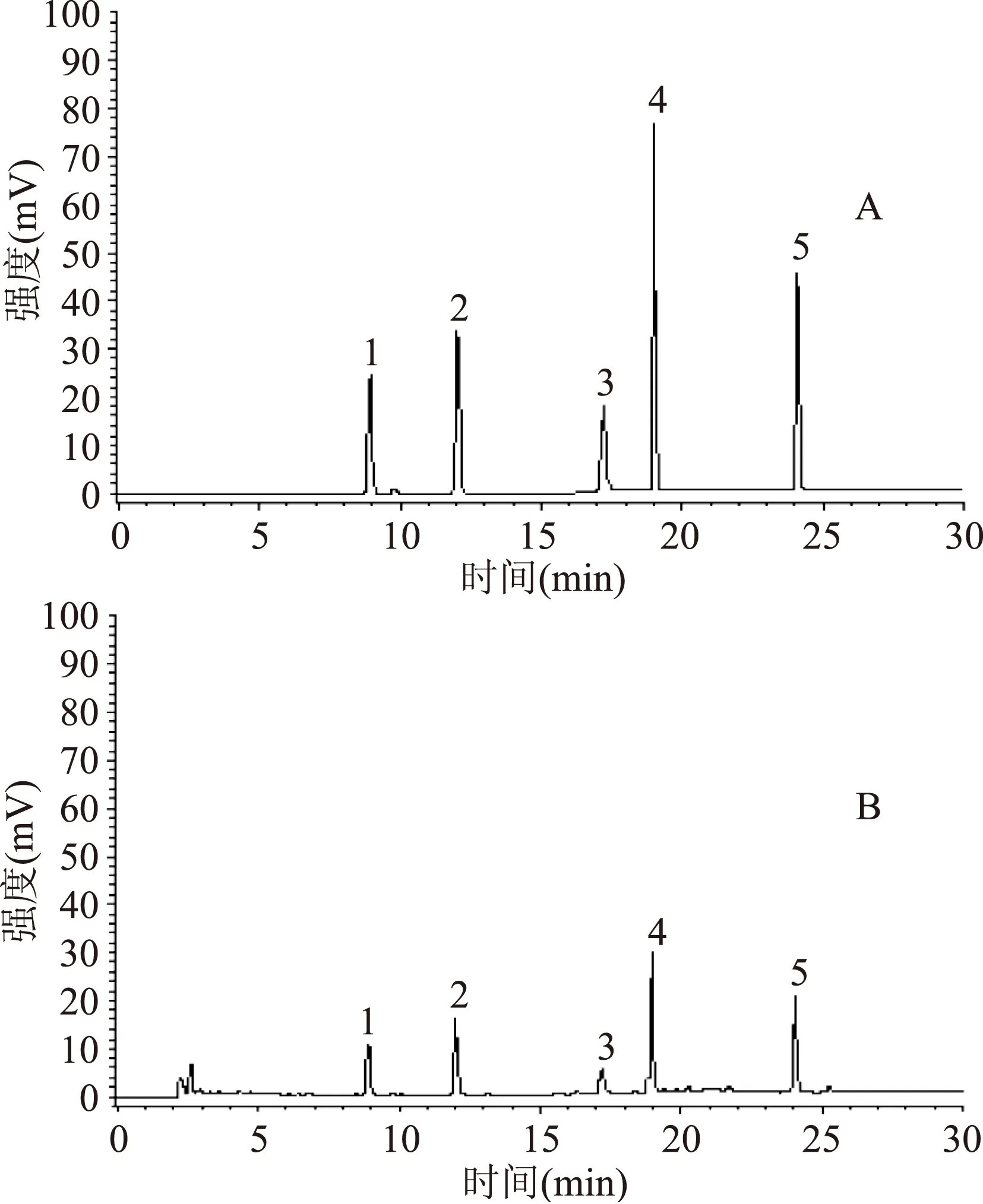
图1 对照品(A)及S16号样品(B)的HPLC图Fig.1 HPLC fingerprinting of control products(A)and S16 sample(B)注:1.胞苷;2.尿苷;3.腺嘌呤;4.鸟苷;5.腺苷。
2.2提取条件的选择与优化
目前文献中多采用回流提取法[7]和超声提取法[8],本实验考察了这2种方法,以获得最佳的提取效率。结果表明,党参中5种成分的总量平均值超声提取法(1186.10±0.01 μg/g)显著高于回流提取法(593.04±0.09 μg/g),故选择超声提取法。以5种核苷和碱基的总量为考察指标,选取甲醇和水的体积比(A)、提取时间(B)、溶剂用量(C)和提取次数(D)为考察因素,采用L9(34)正交实验设计进行实验(表2)。由表2可知,供试品最佳提取工艺为加20倍量的纯净水超声提取2次,每次60 min。
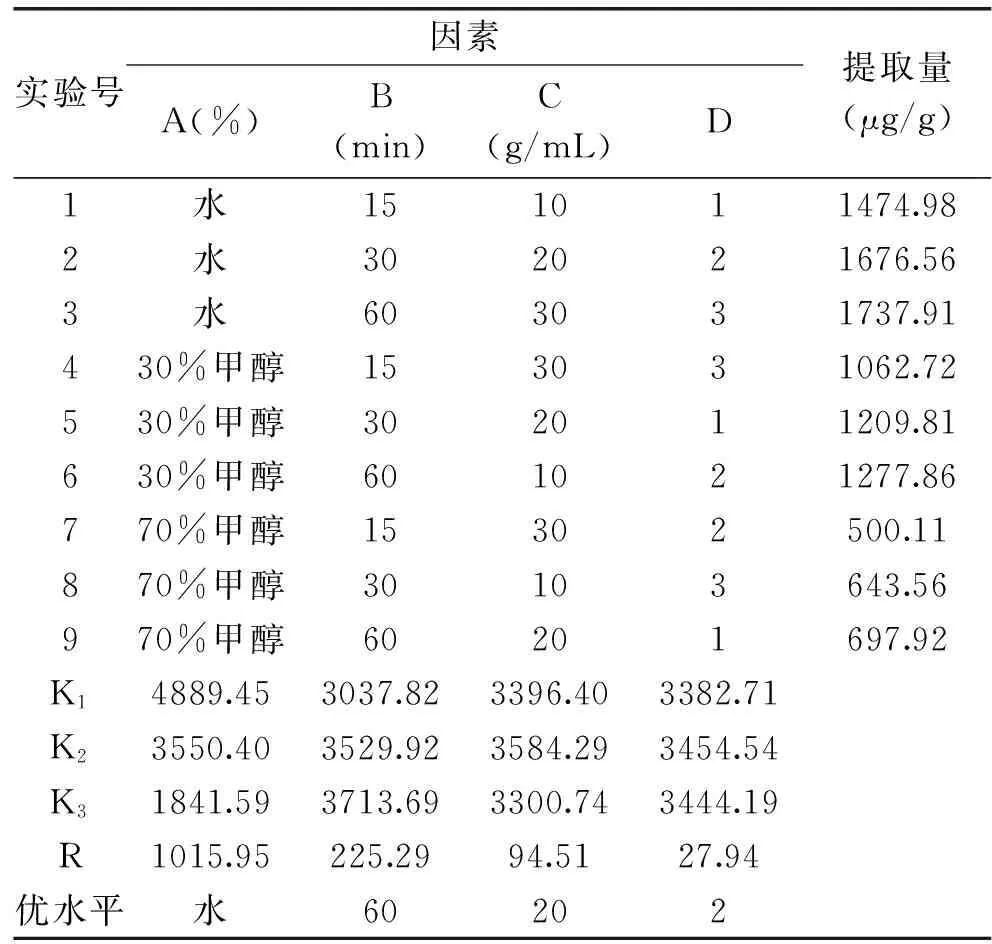
表2 超声提取正交实验结果Table 2 Results of orthogonal experiment of ultrasonic extraction
2.3标准曲线、检测限和定量限
结果表明,胞苷、尿苷、腺嘌呤、鸟苷和腺苷质量浓度分别在0.58~58.00、0.66~66.00、0.22~22.00、1.10~110.00、0.59~59.00 μg/mL范围内与峰面积具有良好的线性关系,相关系数达到0.9995以上,结果见表3。
2.4精密度实验
胞苷、尿苷、腺嘌呤、鸟苷和腺苷日内精密度RSD分别为0.97%、0.86%、1.10%、1.05%、0.84%,其日间精密度RSD分别为1.37%、1.46%、1.23%、1.51%、1.84%。结果表明,以胞苷、尿苷、腺嘌呤、鸟苷和腺苷所建立的高效液相色谱法及检测仪器检测时精密度良好。
2.5重复性实验
胞苷、尿苷、腺嘌呤、鸟苷和腺苷的含量分别为227.60±0.09、330.08±0.03、83.36±0.04、362.08±0.02、252.24±0.04 μg/g,RSD分别为2.29%、1.50%、1.24%、1.83%、1.79%,表明该方法的重复性较好。
2.6稳定性实验
胞苷、尿苷、腺嘌呤、鸟苷和腺苷色谱峰面积的RSD分别为2.76%、1.91%、2.65%、2.38%、2.63%,说明供试品溶液至少在24 h内稳定。
2.7加样回收率实验
党参(S16)中5种核苷和碱基的平均回收率在97.05%~101.08%,RSD 1.19%~3.01%,符合分析要求,结果见表4。表明上述实验方法的准确度较高,能应用于党参中核苷和碱基类活性成分的检测与分析。
2.8样品的含量测定
按外标两点法定量,分别计算胞苷、尿苷、腺嘌呤、鸟苷和腺苷的含量,结果见表5。
由表5可知,18批党参药材均含有胞苷、尿苷、腺嘌呤、鸟苷和腺苷成分,表明不同产地党参中核苷和碱基类成分较为相似。18批党参样品的含量测定结果显示:胞苷、尿苷、腺嘌呤、鸟苷、腺苷及核苷总含量分别在范围68.71~478.82、171.33~629.60、33.63~140.05、221.31~651.37、143.26~511.78、679.87~2011.67 μg/g,平均含量分别为222.36、369.11、55.72、458.20、333.96、1440.82 μg/g。表明不同产地党参药材中各核苷和碱基的含量具有明显差异,产于山西省平顺县龙溪镇和杏城镇的党参品种含量较高,也与其历来党参(潞党)的道地产区相映证[9]。同时作者也发现相同种植区的不同种植基地的党参药材中核苷和碱基的含量也有一定差异,这是否与环境条件、栽培技术、田间管理等有关[10-11]。因此,进行党参栽培时,栽培基地的选择对党参的品质形成具有重大影响,文中实验结果将对党参的栽培基地选择具有一定的指导意义。
同时,本文对平顺县虹梯关乡界畔峧村的不同生长年限中核苷和碱基化合物的测定表明,胞苷和腺嘌呤随着生长年限的增加而增加,与王爱娜[12]对党参中苍术内酯Ⅲ的研究结果相一致,而尿苷、鸟苷、腺苷及核苷总量随着生长年限呈现递减的趋势,与王秀文[13]对党参中党参炔苷等化合物的研究结果类似,进一步表明生长年限对党参化学成分有显著性影响。本研究中不同生长年限的党参样本量较少,为了进一步证实不同生长年限党参与其品质形成的相关性,后续研究将采集更多的党参药材样本进行系统研究。
样品山西省平顺县东寺头乡秦光村(S5)栽培过程中使用壮根灵导致其核苷和碱基含量显著低于其他样品,与陈玉武[14]对党参栽培过程中喷施党参壮根灵而降低党参炔苷含量的研究结果类似,全面评价壮根灵对党参药材品质的影响有待进一步研究。
结果表明,不同产地的党参药材质量差异较大,故有必要对党参药材的质量进行评价,以往对党参的质量控制研究报道很多,但至今尚无统一规范的质量控制方法,本方法可作为《中国药典》质量标准的定量评价指标之一,该方法也为党参生产过程中产地环境选择、农艺措施提供了新的分析方法和依据。
3 结论
党参在民间传统用法是水煎剂,本文采用HPLC-UV方法,根据样品峰最大吸收波长和保留时间鉴定了党参中的5个化合物,结果表明,党参有紫外吸收的水溶性成分主要是核苷和碱基化合物。党参所含核苷和碱基化合物可作为该药材质量评价的指标性成分之一,核苷和碱基化合物已被证实是重要的生物活性物质,与党参药效(增强免疫功能、降血糖、降血压等)具有一定的关联性。鉴于核苷和碱基类成分在党参药材中含量为679.8672~2011.6720 μg/g,进一步探讨以其含量高低作为党参药材质量优劣的衡量指标,很有必要。本方法操作简便,精密度、稳定性和重复性良好,结果稳定可靠,可作为党参药材的一个重要鉴别和质量评价手段之一,同时为阐明党参及其相关制剂的药理作用和质量综合评价提供了坚实的基础。
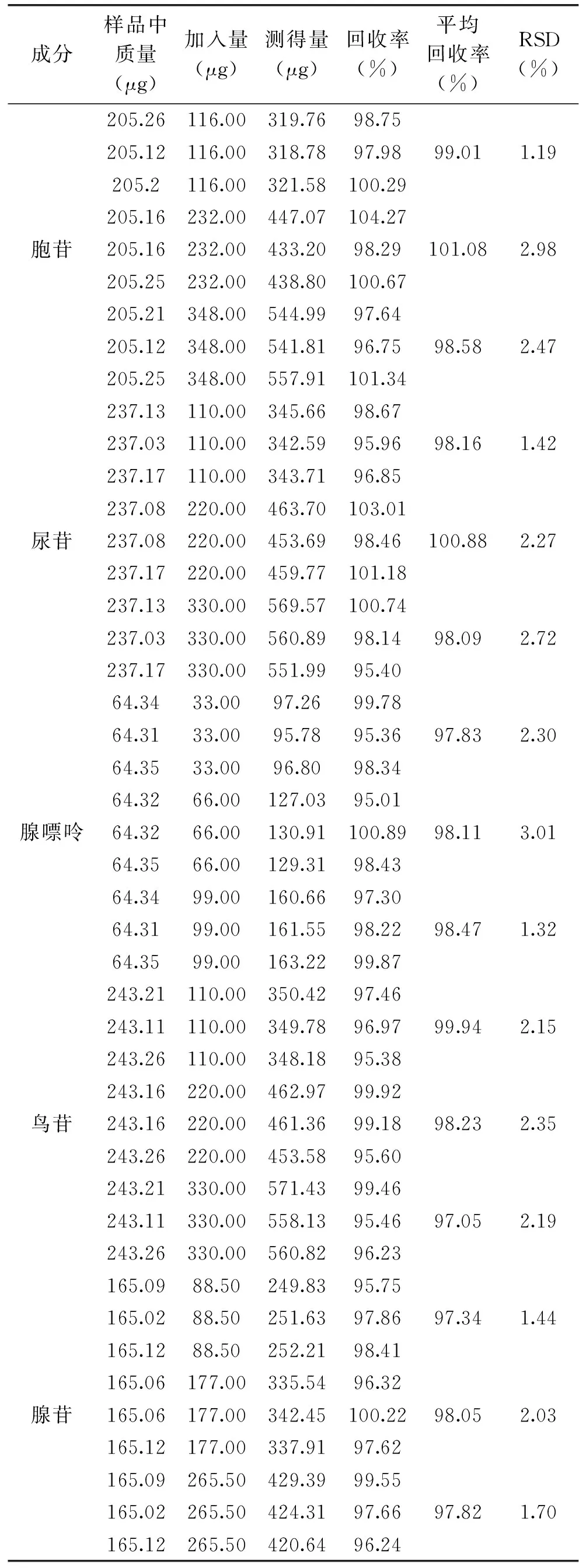
表4 加样回收率实验结果(n=3)Table 4 Results of the recovery rate test(n=3)
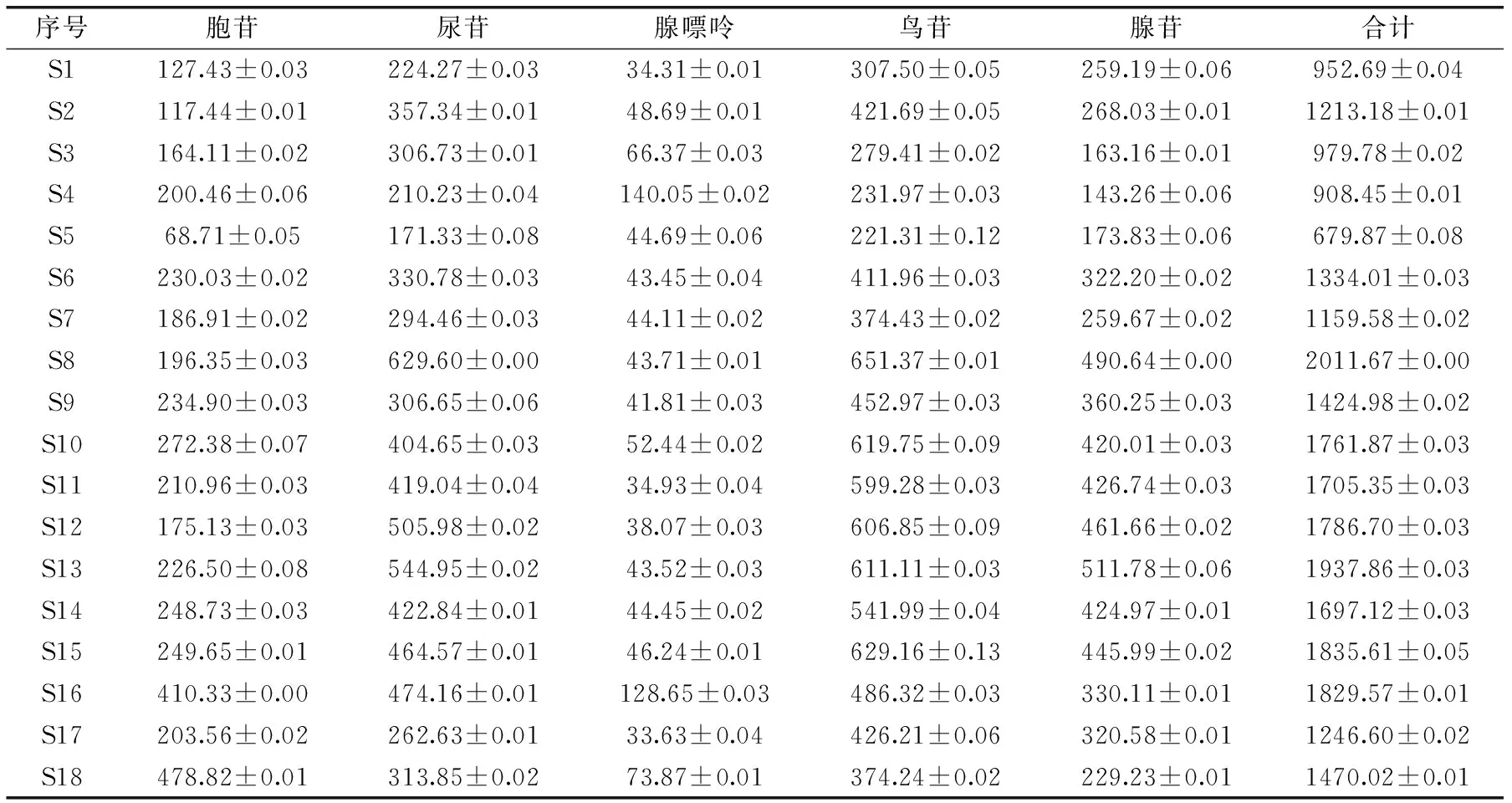
表5 不同产地党参药材中核苷和碱基的含量测定(μg/g,n=3)Table 5 Contents determination of nucleosides and bases in Radix Codonopsis materials from different producing areas(μg/g,n=3)
[1]国家药典委员会编. 中华人民共和国药典(2010年版 一部)[S]. 北京:中国医药科技出版社,2010:264-265.
[2]朱焰,魏均娴. 党参属药用植物研究状况[J].天然产物研究与开发,1994,6(1):70-75.
[3]冯佩佩,李忠祥,原忠. 党参属药用植物化学成分和药理研究进展[J]. 沈阳药科大学学报,2012,29(4):307-311.
[4]LI Chia-ying,XU Hong-xi,HAN Quan-bin,et al. Quality assessment of Radix Codonopsis by quantitative nuclear magnetic resonance[J]. Journal of Chromatography A,2009,1216(11):2124-2129.
[5]贺庆,朱恩圆,王峥涛,等. 党参化学成分的研究[J]. 中国药学杂志,2006,41(1):10-12.
[6]张雪梅,杨丰庆,夏之宁. 食品中核苷类成分的药理作用
研究进展[J]. 食品科学,2012,33(9):277-282.
[7]周菊峰,黄兰芳,郭方遒. LC-ESI-MS快速同时测定冬虫夏草中主要核苷类成分[J]. 中国中药杂志,2009,34(18):2349-2352.
[8]DUAN Bao-zhong,WANG Li-zhi,DAI Xin-hua,et al. Identification and Quantitative Analysis of Nucleosides and Nucleobases in Aqueous Extracts of Fritillaria Cirrhosa D. DON. Using HPLC-DAD and HPLC-ESI-MS[J]. Analytical Letters,2011,44(15):2491-2502.
[9]李震宇,王爱娜,刘晓节,等. 潞党参极性和非极性成分HPLC指纹图谱研究[J]. 山西医科大学学报,2011,42(1):56-62.
[10]邹元锋,刘莎,陈兴福,等. RP-HPLC同时测定党参中党参炔苷与苍术内酯[J]. 药物分析杂志,2011,31(5):923-926.
[11]段琦梅,梁宗锁,杨东风,等. 党参质量评价体系的建立及不同产地党参质量差异性分析[J]. 中草药,2012,43(5):995-999.
[12]王爱娜,秦雪梅,张勇,等. 高效液相色谱法测定不同产地党参中苍术内酯的含量[J]. 中国药学杂志,2005,40(18):1436-1437.
[13]王秀文,赵慧辉,刘养清,等. 不同生长年限山西党参的RP-HPLC指纹图谱研究[J]. 中国中医药信息杂志,2010,17(3):45-46.
[14]陈玉武,丁永辉,李成义,等. 党参壮根灵对党参质量影响的研究[J]. 药物分析杂志,2011,31(2):254-257.
Simultaneous determination of five nucleosides and bases inRadixCodonopsisby high performance liquid chromatography
WANG Gao-feng
(Department of Life Sciences,Guizhou Engineering Vocational College,Tongren 565200,China)
Ultrasonic assisted extraction and methods of HPLC were established to determine cytidine,uridine,adenine,guanosine and adenosine inRadixCodonopsis. The best extraction condition for Radix Codonopsis was 20 times the amount of pure water to extract by ultrasonic for 60 min,and repeat it for 2 times. Samples were separated and determined by a Venusil MP C18(2)(4.6 mm×250 mm,5 μm)using methanol-water system as mobile phase. Flow rate was 1.0 mL·min-1,and detection wavelength for fingerprinting was 260 nm with 35 ℃ for column temperature. Mass concentration of 5 components had good linear relation with peak areas(R2>0.9995). And average recovery rates were from 97.05% to 101.81% with RSD ≤ 3.01%. The contents of nucleosides inRadixCodonopsisfrom different producing areas were different. The contents of cytidine,uridine,adenine,guanosine,adenosine and total nucleosides in 18 samples were listed as the followings:68.71~478.82,171.33~629.60,33.63~140.05,221.31~651.37,143.26~511.78 and 679.87~2011.67 μg/g. The method in this study was easily performed with good precision,stability and reproducibility,accurate and reliable,so it was suitable to simultaneously determine the 5 components of nucleosides and bases inRadixCodonopsis. This provide scientific basis for objectively recognizing material basis of pesticide effect ofRadixCodonopsisand developing multi-index evaluation system.
HPLC;RadixCodonopsis;nucleosides;bases
2015-07-15
王高峰(1979-),男,本科,讲师,主要从事生物制药的教学与研究工作,E-mail:80887665@qq.com。
TS207.3
A
1002-0306(2016)05-0315-05
10.13386/j.issn1002-0306.2016.05.055

