原花青素对营养肥胖模型大鼠肠道消化酶活性的影响
李雅梅,方 烁,肖俊松,曹雁平
(北京工商大学,北京市食品添加剂工程技术研究中心,食品质量与安全北京实验室,北京 100048)
原花青素对营养肥胖模型大鼠肠道消化酶活性的影响
李雅梅,方烁,肖俊松*,曹雁平
(北京工商大学,北京市食品添加剂工程技术研究中心,食品质量与安全北京实验室,北京 100048)
以高脂饲料喂养Wistar大鼠建立营养肥胖模型,然后以200 mg/(kg·bw·d)葡萄籽原花青素提取物灌胃6周,研究其对大鼠体重,以及蛋白酶、淀粉酶、脂肪酶、α-葡萄糖苷酶、β-葡萄糖苷酶等肠道内酶活性的影响。造模结束时,模型组、灌胃组体重及Lee’s指数无显著区别,且显著高于正常组(p<0.05);灌胃6周葡萄籽原花青素后,灌胃组体重及Lee’s指数显著低于模型组(p<0.05)。灌胃组大鼠肠道蛋白酶、脂肪酶活性显著(p<0.05)高于模型组和正常组;灌胃组淀粉酶活性显著(p<0.05)高于正常组,与模型组无显著区别(p>0.05);灌胃组α-葡萄糖苷酶活性与模型组和正常组无显著区别;灌胃组β-葡萄糖苷酶活性显著(p<0.05)低于模型组和正常组。实验结果显示200 mg/(kg·bw·d)浓度的提取物可显著抑制大鼠肥胖,且提高了肠道消化酶的活性,有利于营养物质的吸收利用,同时降低了二糖酶中β-葡萄糖苷酶的活性,有利于降低血糖。
葡萄籽原花青素,肥胖,肠道酶活,大鼠
肥胖是一种由多种因素引起的慢性代谢性疾病,是长期能量摄入大于消耗所引起的以脂质代谢异常为主的代谢失调症。肥胖已成为当今社会严重危害公众健康的问题,与炎症、糖尿病、高血压、心脑血管疾病及胰岛素抵抗的发生密切相关[1]。已有流行病学和临床研究表明,肥胖是心脑血管疾病和糖尿病的独立危险因素,对血压、血糖、血脂水平均有影响[1]。
原花青素(Proanthocyanidin)是广泛存在于植物中的一类天然多酚,由多个黄烷-3-醇单元通过C4-C6或C4-C8键连接而成,3位羟基可与没食子酸儿茶素发生酯化[2]。原花色素根据结构不同,构成单元组成不同,分别称为原花青素(Procyanidin)、原雀翠素(prodelphinidin)、原菲瑟素(profisetinidin)、原刺槐素(prorobinetinidin)等。原花青素有良好的抗氧化、清除自由基、减肥、消炎和降低胰岛素抵抗的生理活性[3]。流行病学调查显示,膳食中原花青素等多酚类物质的摄入,能显著降低肥胖、糖尿病等代谢疾病发病几率[4]。原花青素在葡萄、高粱、可可、苹果等食物中大量存在,其中葡萄籽是商业原花青素的重要来源。
人体自身对原花青素的利用度并不高。原花青素进入肠道后仅少量被肠道吸收进入血液,大部分通过肠道菌群代谢以及粪便排出体外[5]。Serra等[6]用葡萄籽原花青素灌胃大鼠,发现在血浆中的原花青素及其衍生物含量分别只有0.85~8.55 μmol/L和0.06~23.90 μmol/L,原花青素二聚体B2的生物利用率仅在8%~11%之间,大部分通过肠道菌群代谢。
目前,关于葡萄籽提取物原花青素预防和治疗肥胖的报道还很少,本文以高脂膳食诱导营养肥胖模型,然后以葡萄籽原花青素灌胃,从肠道消化酶的角度,探索葡萄籽原花青素对大鼠肠道代谢情况的影响,为进一步研究其预防和治疗肥胖等代谢综合征提供依据。
1 材料与方法
1.1材料与仪器
葡萄籽原花青素提取物(原花青素含量≥95%)天津尖峰天然产物公司;Wistar雄性大鼠购自北京维通利华实验动物有限公司;脂肪酶试剂盒、淀粉酶试剂盒、考马斯亮蓝试剂盒、福林酚试剂均购自南京建成生物工程研究所;对硝基苯-α-D-吡喃葡萄糖苷、对硝基苯-β-D-吡喃葡萄糖苷购自美国阿法埃莎;其他试剂均为国产分析纯。
Multiskan MK3型全自动多功能酶标仪美国Thermo公司;UV-2000型紫外可见分光光度计日本岛津公司;CR21-GIII型高速冷冻离心机日本Hitachi公司。
1.2实验方法
1.2.1动物分组及处理出生3周Wistar雄性大鼠45只。首重(90±10)g,SPF级动物房饲养,温度25 ℃左右,湿度60%,光照10~12 h/d。适应饲喂2 d后开始造模。
造模方法[7]:随机抽取7只大鼠,饲喂标准大鼠日粮,剩余大鼠饲喂高脂饲料。每周定期测量大鼠体重体长。8周后,称量大鼠体重,以体重超过正常组大鼠平均体重20%的为造模成功。
灌胃阶段,正常组继续给予标准大鼠日粮,灌胃无菌水;造模成功的大鼠随机分成灌胃组和模型组,每组7只,继续饲喂高脂饲料,并分别灌胃原花青素200 mg/(kg·bw·d)和无菌水。灌胃阶段每周测量大鼠体重体长。
灌胃6周以后,禁食12 h,肌肉注射2%的戊巴比妥0.6 mL麻醉后,股动脉取血致死,取回肠内容物,-80 ℃保存待测。
1.2.2生长性能测定根据下式计算李氏指数即Lee’s指数[8]:
式中,体重单位为g;体长:大鼠鼻尖到肛门的长度,cm。
Lee’s指数是评价成年肥胖模型大鼠肥胖程度的指标,肥胖大鼠较正常大鼠Lee’s指数明显增加[7]。
1.2.3粗酶液的制备取0.15 g大鼠肠道内容物,加入1 mL 0.1 mol/L磷酸盐缓冲液(pH7.4),充分振荡混匀 3000 r/min低温离心30 min,上清液即为粗酶提取液,-80 ℃保存待测。采用考马斯亮蓝试剂盒测定粗酶液中蛋白含量。
1.2.4蛋白酶酶活的测定[9-10]
1.2.4.1制备酪氨酸标准曲线取浓度为10、20、30、40、50、60 μg/mL酪氨酸-磷酸盐溶液各2 mL,加入0.55 mol/L碳酸钠5 mL使呈碱性,然后加入1 mL福林酚,37 ℃水浴显色15 min,680 nm下测吸光度值。取2 mL纯水加入如上试剂反应后作为空白对照。根据吸光度和对应酪氨酸浓度绘制标准曲线,方程为y=0.0186x+0.02(R2=0.9997)。
1.2.4.2底物与酶的反应取0.3 mL粗酶液用磷酸盐缓冲液(pH7.4)稀释至3 mL于37 ℃水浴预热3~5 min,加入于37 ℃水浴预热5 min的0.5%酪素2 mL,混合均匀后于37 ℃水浴中准确反应15 min。反应后加入3 mL 10%三氯乙酸终止反应,10000 r/min离心15 min,取上清液2 mL,加入5 mL 0.55 mol/L碳酸钠碱化,然后加入福林试剂1 mL,混匀后37 ℃水浴显色15 min,680 nm下测吸光度值。
1.2.4.3蛋白酶比活力定义在37 ℃下每毫克蛋白每分钟水解酪蛋白产生1 μg酪氨酸即为一个酶活力单位。

式中:C为样品测得光密度查曲线对应的酪氨酸量,μg;F为粗酶液稀释倍数;15为反应时间,min;W为粗酶液蛋白含量,mg;k为标准曲线斜率倒数,1/0.0186;OD为吸光度值。
1.2.5淀粉酶、脂肪酶酶活的测定用淀粉酶试剂盒(碘法)测定各组样品粗酶液中淀粉酶活力[11-12],用脂肪酶试剂盒测定各组样品粗酶液中脂肪酶活力[13-14],方法参照试剂盒说明书。
1.2.6α-葡萄糖苷酶、β-葡萄糖苷酶酶活的测定pNPG法测α-葡萄糖苷酶、β-葡萄糖苷酶酶活[15-19]。
1.2.6.1绘制PNP标准曲线分别取1 mmol/L对硝基苯酚溶液0.1、0.2、0.3、0.4、0.5、0.6 mL,各加入2 mL 1 mol/L碳酸钠,补充缓冲液使其终浓度为0.01、0.02、0.03、0.04、0.05、0.06 mol/L。于400 nm处测定吸光度值,绘制对硝基苯酚—光密度曲线,得到曲线方程y=17.374x+0.009(R2=0.9981)。
1.2.6.2底物与酶的反应取粗酶液0.3 mL用的磷酸氢二钠—柠檬酸缓冲(pH6.0)稀释至1.2 mL后于37 ℃水浴预热5 min,加入底物1.6 mmol/L的pNPG溶液(37 ℃预热10 min)0.3 mL,混匀后37 ℃水浴准确反应30 min,然后用3.5 mL 0.5 mol/mL碳酸钠溶液终止反应,于400 nm处测定吸光度值。
1.2.6.3酶比活力定义在上述条件下,每毫克蛋白每分钟内催化生成1 μmol对硝基苯酚为一个酶活力单位。

式中:C为对应对硝基苯酚浓度-光密度曲线上的值,μg;30,反应时间,min;F,原酶液稀释倍数;W,粗酶液蛋白含量,mg;k为标准曲线斜率倒数,1/17.374;OD为吸光度值。
1.2.7数据处理与统计分析各组大鼠每个样品做三次平行,采用Origin 8.5绘图。数据采用SPSS statistics 17.0软件进行分析,利用单因素方差分析进行显著性检验,并采用邓肯(Duncan)新复极差法对正常组、模型组、灌胃组各指标进行两两比较。
2 结果与分析
2.1原花青素对肥胖模型大鼠体重及肥胖程度的影响
图1代表灌胃期间大鼠体重的变化,由图1可以发现在灌胃初期模型组、灌胃组与正常组体重差距明显(p<0.05),灌胃第1周体重平均水平分别为(592.38±9.42)、(578.56±16.14)、(486.71±5.06)g,随着灌胃时间的延长,模型组体重与正常组体重依然差距明显(p<0.05),而灌胃组大鼠体重逐渐远离模型组并靠近正常组,灌胃第6周灌胃组、模型组、正常组体重平均水平分别为(610±24.46)、(685±12.51)、(564.5±8.19)g,说明原花青素可抑制高脂饲喂大鼠体重的增加,且效果与灌胃时间有关。
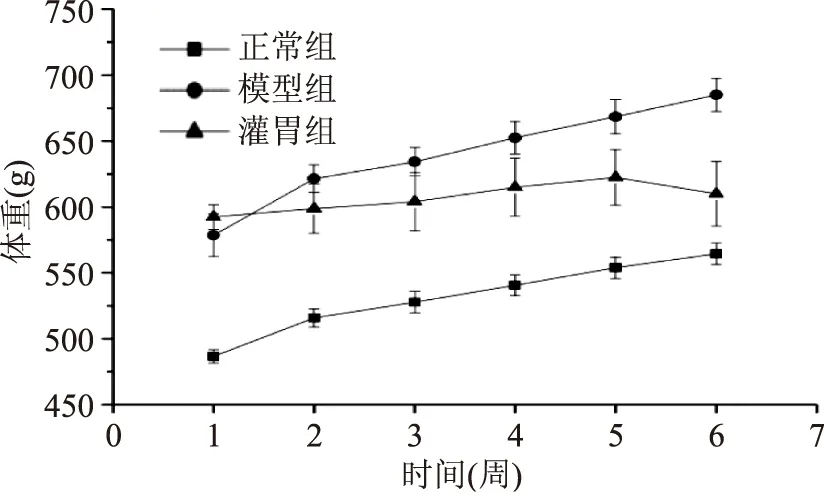
图1 灌胃期间各组大鼠体重变化Fig.1 Weight changes of three groups during gavage
图2代表灌胃期间大鼠Lee’s指数的变化,揭示了大鼠肥胖程度的变化情况。由图2可以发现在灌胃初始阶段灌胃组与模型组Lee’s指数无明显差异且显著高于正常组,平均水平分别为348.48±5.24、350.33±3.8、328.01±3.76,灌胃过程中灌胃组与正常组的Lee’s指数数值、变化趋势一直保持一致,且逐渐接近,灌胃第6周灌胃组Lee’s指数接近正常水平并显著低于模型组,说明原花青素对于肥胖大鼠具有一定的减重效果,且效果与灌胃时间有关。

图2 灌胃期间各组大鼠Lee指数变化Fig.2 Lee’s index changes of three groups during gavage
2.2原花青素对肠道蛋白酶活力的影响
图3代表各组大鼠肠道内容物测得蛋白酶活力的差异,由图3结果可看出,灌胃组大鼠肠道蛋白酶活力较正常组与模型组均有极显著性提高(p<0.01),而模型组较正常组大鼠肠道蛋白酶活力降低但并无显著区别(p>0.05)。说明肥胖对肠道蛋白酶活性有一定的抑制作用,而原花青素可改善这种抑制,并且对肠道蛋白酶有显著地激活作用。
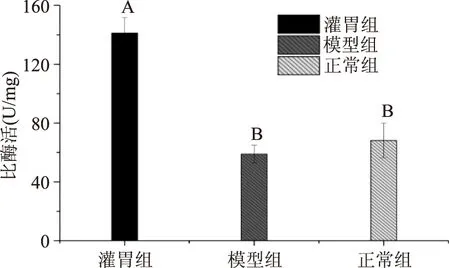
图3 大鼠肠道蛋白酶活力Fig.3 Activity of proteinase from rat intestinal 注:大写字母不同表示有极显著差异(p<0.01);小写字母不同表示有显著差异(p<0.05);图4~图7同。
2.3原花青素对肠道淀粉酶活力的影响
图4代表各组肠道内容物测得淀粉酶活力的差异,由图4结果可以看出,灌胃组大鼠肠道淀粉酶活力较正常组有显著性提高(p<0.05),而较模型组大鼠肠道淀粉酶活力虽有提高,但并不显著(p>0.05);模型组与正常组淀粉酶活性也无显著差异(p>0.05)。说明肥胖对肠道淀粉酶的代谢活动影响不大,而原花青素可显著提高肠道淀粉酶的活性。

图4 大鼠肠道淀粉酶活力Fig.4 Activity of amylase from rat intestinal
2.4原花青素对肠道脂肪酶活力的影响
图5各组肠道内容物测得脂肪酶活力的差异,由图5结果可看出,灌胃组大鼠肠道脂肪酶活力较正常组有显著性提高(p<0.05),较模型组有极显著性增高(p<0.01),而模型组较正常组大鼠肠道脂肪酶活力虽有一定抑制,但并不显著(p>0.05)。说明肥胖对肠道脂肪酶的活性影响不大,而原花青素可显著提高肠道脂肪酶的活性。
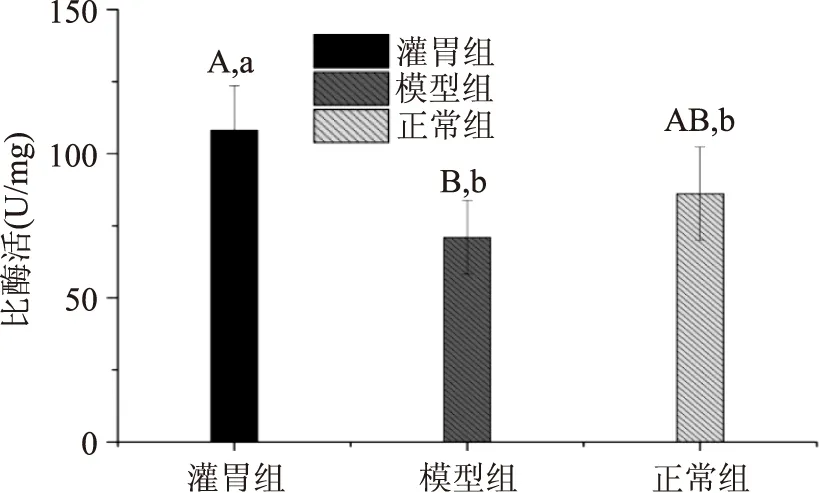
图5 各组脂肪酶活力Fig.5 Lipase activities of three groups
2.5原花青素对肠道α-葡萄糖苷酶活力的影响
图6代表各组肠道内容物测得α-葡萄糖苷酶活力的情况,由图6结果可看出,各组大鼠肠道α-葡萄糖苷酶活力并无显著性差异(p>0.05)。肥胖与原花青素对肠道α-葡萄糖苷酶均无明显作用。
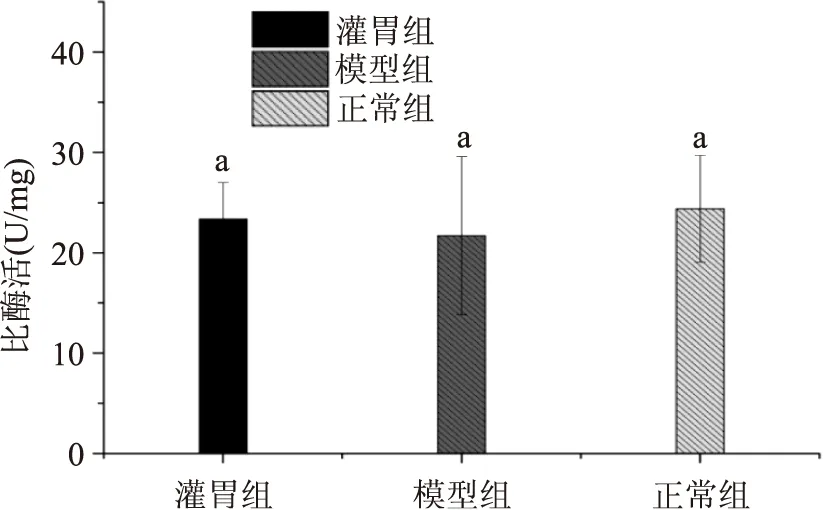
图6 各组α-葡萄糖苷酶活力Fig.6 Alpha-glucosidase activities of three groups
2.6原花青素对肠道β-葡萄糖苷酶活力的影响
图7代表各组肠道内容物测得β-葡萄糖苷酶活力的差异,由图7结果可看出,灌胃组大鼠肠道β-葡萄糖苷酶活力较正常组与模型组均极显著性降低(p<0.01),模型组酶活力水平极显著高于正常组(p<0.01)。说明肥胖使肠道β-葡萄糖苷酶活性显著增高,而原花青素可显著抑制肠道β-葡萄糖苷酶活性,使其达到正常水平。

图7 不同组β-葡萄糖苷酶活力Fig.7 Beta-glucosidase activities of three groups
3 讨论与结论
葡萄籽原花青素对高脂膳食诱导的肥胖大鼠有较好的减重效果,肥胖程度在灌胃6周后基本达到正常水平。用原花青素灌胃后肥胖大鼠肠道消化酶类诸如蛋白酶、淀粉酶、脂肪酶较正常大鼠有一定程度的提高,但淀粉酶和脂肪酶的这种变化并不显著;而经过原花青素灌胃处理6周后,抑制作用得到了明显改善,且较正常水平均有一定的提高。说明原花青素可提高肥胖大鼠肠道消化酶如蛋白酶、淀粉酶、脂肪酶的活力,从而提高其消化能力,这一结论与文献报道中基本相符[11-12]。而通过对二糖酶α-葡萄糖苷酶及β-葡萄糖苷酶酶活力的检测结果分析可知,肥胖模型组大鼠两种酶活力综合水平显著高于正常组大鼠,从而印证了肥胖症往往伴随高血糖症状。而原花青素灌胃处理过后的大鼠β-葡萄糖苷酶活力显著降低,说明原花青素可抑制肥胖大鼠肠道β-葡萄糖苷酶的活力,从而改善其高血糖症状。
从肠道酶活角度研究原花青素对肥胖的影响是一种创新的手段,是对先前其他研究方面的补充,也为原花青素作为功能性成分在食品、饲料等的生产使用提供进一步的科学依据。但利用大鼠肠道内容物进行肠道内酶活力的测定,由于酶量较少、易失活,且大鼠个体差异较大,得到的实验结果有待进一步验证。因此,可在此基础上考虑对肠道酶进行分离纯化,进一步进行分子水平的研究。
[1]王勇,孙超,吕彬,等. 原花青素对肥胖小鼠脂肪沉积的抑制[J]. 西北农业学报,2010,20(6):23-28.
[2]李绮丽,彭芳刚,刘德明,等. 红莲外皮原花青素的纯化与分析[J]. 食品科学,2014,35(3):106-110.
[3]Pinent M,Bladé C,Salvadó MJ,et al. Procyanidin effects on adipocyte-related pathologies[J]. Crit Rev Food Sci Nutr,2006,46:543-550.
[4]Kimeberly AG,Joshua DL. Laboratory,Epidemiological,and human intervention studies show that tea(Camellia sinensis)may be useful in the prevention of obesity[J]. J Nutr,2010,140:3446-3453.
[5]Lee HC,Jenner AM,Low CS,et al. Effect of tea phenolics and their aromatic fecal bactorial metabolites on intestinal microbiota[J]. Res Microbiol,2006,157:876-884.
[6]Serra A,Macià A,Maria PR,et al. Determination of
procyanidins and their metabolites in plasma samples by improved liquid chromatograghy-tandem mass spectrometry[J]. J Chromatogr B,2009,877:1169-1176.
[7]肖俊松,王莹,宋雪琳,等. 原花青素对营养肥胖模型大鼠氧化应激的影响[J]. 食品科学,2014,35(3):183-186.
[8]职冬丽,王明明. 苍术山楂颗粒对幼龄营养性肥胖大鼠糖脂代谢的影响[J]. 长春中医药大学学报,2014,30(4):593-595.
[9]杨金玉,张海金,武书庚,等. 葡萄原花青素的生理活性及其在家禽上的应用[J]. 动物营养学报,2014,26(2):311-321.
[10]Ximena Terra,Victor Pelleres,Anna Ardevol. Modulatory effect of grape seed proanthocyanidins on local and systemic inflammation in diet-induced rats[J]. Journal of Nutritional Biochemistry,2011,22:380-387.
[11]解玲娜,茅玲玲,刘畅,等. 葡萄籽原花青素对断奶仔猪消化道酶活、内脏相对重量及血细胞参数的影响[J]. 北京农学院学报,2012,27(4):13-15.
[12]卢俊姣,翟少伟. 饲料中添加葡多酚对吉富罗非鱼生长性能、肠道消化酶活性、血脂水平和肝胰脏抗氧化能力的影响[J]. 动物营养学报,2014,26(4):1095-1102.
[13]汪水平,陈祖鸿,刁程,等. 葡萄籽提取物原花青素对肉兔生长发育、血清酶活性及消化代谢的影响[J]. 中国兽医学报,2014,34(7):1143-1150.
[14]Tebib K,Rouanet JM,Beson CP. Effect of grape seed tannins on the activity of some rat intestinal enzyme activities[J]. Enzyme Protein,1994,48(1):51-60.
[15]宋卓,王征. 食物多酚对肠道糖吸收和代谢的影响[J]. 中国食物与营养,2014,20(5):64-68.
[16]周俊华,胡景初,滕红. 松针原花青素的提取及其降血糖作用研究[J]. 中国处方药,2014,12(9):122-123.
[17]Hamida Jdir,Bassem Khemakham,Mouna Chakroun,et al. Diplotaxis simplex suppresses postprandial hyperglycemia in mice by inhibiting key-enzymes linked to type 2 diabetes[J]. Revista Brasileira de Farmacognosia,2015,25(2):152-157.
[18]孟文,贺炜,钟英丽,等. 紫甘薯花青素体外抑制α-葡萄糖苷酶活性研究[J]. 食品科学,2011,32(17):32-36.
[19]Dikshit R,Tallapragada P. Partial Purification and Characterization of beta-glucosidase from Monascus sanguineus[J]. Brazilian Archives of Biology and Technology,2015,58(2):185-191.
权威·核心·领先·实用·全面
Effect of proancyanidins on intestinal enzyme activityin nutritional obese rats
LI Ya-mei,FANG Shuo,XIAO Jun-song*,CAO Yan-ping
(Beijing Engineering and Technology Research Center of Food Additives,Beijing Laboratoryfor Food Quality and Safety,Beijing Technology and Business University,Beijing 100048,China)
Nutritional obese model was induced by feeding Wistar rats with high-fat diet. And then the model rats were treated with 200 mg/(kg·bw·d)of grape seed procyanidins by gavage for 6 weeks. Detected effect of procyanidin on obesity and activities of intestinal protease,amylase,lipase,alpha-glucosidase,beta-glucosidase. There was no significantly(p<0.05)difference in weight and Lee’s index between model group and ig group,while both the two groups were significantly different with normal group in weight and Lee’s index. After the 6 weeks’ gavage of grape seed procyanidins,weight and Lee’s index of ig group were significantly(p<0.05)lower than model group.The activities of intestinal protease and lipase of ig group were significantly(p<0.05)higher than that of model group and normal group,the amylase activity of ig group was significantly(p<0.05)higher than normal group,but it was not significantly(p>0.05)different with model group. There’s no significant(p>0.05)difference in intestinalα-glucosidase activity of three groups,whileβ-glucosidase activity of ig group were significantly(p<0.05)lower compared with the model group and normal group. The results showed that 200 mg/(kg·bw·d)of grape seed procyanidins could significantly inhibit obesity,and increase the activity of intestinal digestive enzyme to promote the absorption of nutrients,and reduce the activity of beta-glucosidase to lower blood glucose.
grape seed procyanidins;obesity;enzyme activity;rat
2015-11-09
李雅梅(1990-),女,硕士研究生,研究方向:功能性食品,E-mail:13161990942@163.com。
肖俊松(1980-),男,博士,副教授,研究方向:功能性食品,E-mail:xiaojs@th.btbu.edu.cn。
国家自然科学基金青年项目(31201323);北京市属高等学校高层次人才引进与培养三年行动计划(0142132014);“十二五”科技支撑项目(2011BAD23B02)。
TS201.4
A
1002-0306(2016)10-0364-05
10.13386/j.issn1002-0306.2016.10.067

