基于核酸适配体和核酶的功能化核酸传感方法研究
李盼盼,何婧琳,李 婷,杨 婵,肖 慧,黄思颖,曹 忠
(长沙理工大学化学与生物工程学院,电力与交通材料保护湖南省重点实验室,微纳生物传感与食品安全检测协同创新中心,湖南长沙410114)
基于核酸适配体和核酶的功能化核酸传感方法研究
李盼盼,何婧琳*,李婷,杨婵,肖慧,黄思颖,曹忠*
(长沙理工大学化学与生物工程学院,电力与交通材料保护湖南省重点实验室,微纳生物传感与食品安全检测协同创新中心,湖南长沙410114)
在生物分子的研究中,核酸适配体和DNA核酶是具有特殊功能的核酸分子。该综述讨论了这些功能分子、其传统筛选过程、独特的性质和它们在生物传感领域中的应用。核酸适配体和DNA核酶在分子识别的研究方面起到非常大的作用,这些特别的应用显示功能核酸在基因学和蛋白质学中具有极大潜力。
核酸适配体;SELEX技术;DNA核酶;传感分析
0 引言
随着科学研究的快速发展,人们发现核酸分子除了能够和序列互补的核酸分子进行杂交外,某些特定序列还具有特殊功能,如能高特异性结合靶分子或类似辅酶的催化功能,人们把这类具有特殊功能的核酸分子称为功能核酸[1-3]。功能核酸的出现拓宽了人们的视野,打破了人们对核酸只作为遗传信息存储和转运载体的传统观念,加深了对核酸的进一步理解,并且为生物分子的研究提供了新的视角[4]。由于功能核酸在分子识别方面的特殊功能,在生化分析和生物传感领域的研究者越来越多的应用功能核酸,并建立了一系列以功能核酸为分子探针的检测体系。在生物传感体系中,由于功能核酸不仅保持了核酸本身的特性,而且还能高特异性结合某些特定的目标分子或以其作为辅酶对某些反应进行催化,因此功能核酸大大扩展了人们对核酸分子的研究和利用。
随着分析科学、分子生物学等学科的发展及计算机技术的不断更新,为人们研究功能核酸与其靶分子目标物之间的结合作用机理提供了更多可能性。在通常情况下,体外的功能核酸是以随机自由态的空间构象存在,然而有目标分子存在时,功能核酸通过碱基之间的互补配对、静电作用力、氢键、疏水堆积作用、范德华力等与目标分子紧密结合,使核酸链折叠引发构象改变,最终形成热力学稳定的空间构象,如发夹(hairpin)、茎环(stem-loop)、假结(pseudoknot)、G-四链体(G-quartet)等结构[5-7]。这种空间构象、微环境的变化为生物传感器的设计与建立提供了良好的平台。
1 功能核酸的产生-SELEX技术
20世纪90年代,Ellington[8]和Tuerk[9]等报道通过利用一种基于随机寡核苷酸文库进行体外筛选和扩增相结合的方法,成功筛选出了能高特异性吸附噬菌体T4 DNA聚合酶和有机染料分子的寡核苷酸配基,并将这种新的筛选技术称为指数富集的配基系统进化技术(Systematic Evolution of Ligands by Exponential Enrichment,SELEX)。SELEX技术是一种分子进化工程技术,其筛选过程类似于达尔文进化理论。利用SELEX技术可以筛选出由体外化学合成的具有一定特殊功能的寡核苷酸。SELEX技术筛选过程如图1所示[10],首先通过体外化学合成一个高容量的单链寡核苷酸文库,该文库可以是由DNA文库、RNA文库或者是修饰化的RNA文库组成;其次通过模拟大自然的进化,采用特定方法纯化分离将文库中弱亲和力和无特异性的核酸序列排除,再用PCR仪进行扩增,进入下一轮筛选,经过多次重复筛选、分离、扩增可将高亲和力的核酸序列指数放大富集,最终获取与靶分子具有高亲和力的功能核酸。
SELEX技术创立至今经过了20多年的发展,已经出现了多种灵活的筛选方式。其中筛选的靶分子也从最初的重金属离子、有机小分子、蛋白质、核酸等发展到细胞、组织,甚至整个有机体。SELEX技术不仅在生物分子领域有着广泛的应用,在环境检测、疾病诊断、药物筛选等领域也显示出良好的应用前景[11-12]。
2 功能核酸的分类及特点
目前,利用SELEX技术可以筛选出能高特异性结合靶分子,具有分子识别功能的一类DNA或者RNA分子,即核酸适配体(aptamer)[13]。同样,该技术还可以筛选出另一类功能核酸,它们是具有催化活性和结构识别能力的单链RNA或DNA片段,即核酶(RNAzyme)和脱氧核酶(DNAzyme)[14-15]。除此之外,还有一些具有其他功能的核酸,如富含T的核酸序列能特异性识别Hg2+形成“T-Hg2+-T”结构[16-19];富含C的核酸序列能特异性识别Ag+形成“C-Ag+-C”结构[20-21];富含G的核酸序列能特异性识别K+或Pb2+形成G-四链体结构[22-23]及具有发夹结构的茎环双标记寡核苷酸探针的分子信标[24-26]。

图1 SELEX技术筛选过程示意图[10]Fig.1 Scheme for a selection process by SELEX[10]
由于功能核酸的空间结构及与配体相互作用的多样性,通过SELEX技术筛选的靶标物不仅有金属离子、有机小分子、肽、蛋白质,甚至发展到了细菌、细胞、病毒、组织等。通过体外筛选和扩增得到的功能核酸不但和抗体一样能与靶分子高特异性结合,而且还具有许多抗体、蛋白质没有的优点,其特点主要体现在如下方面:
(1)所识别的靶分子范围广。从金属离子、有机小分子到生物大分子,如酶、氨基酸、生长因子、毒素、核苷酸、细胞粘附分子等,甚至于病毒、细菌和细胞均已筛选出相应的功能核酸。
(2)亲和力强,特异性高。筛选出的一些核酸适配体与靶分子之间的解离常数 (Kd)可以达nmol/L到pmol/L水平,甚至fmol/L。例如NeXstar Pharmaceuticals公司和科罗拉多大学筛选的100种蛋白质的适配体中,75%以上的适配体的解离常数都小于 1 nmol/L;血管内皮生长因子(VEGF165/164)与其适配体的解离常数为49 pmol/L[27];细胞生长因子与其适配体的解离常数甚至达到0.3 pmol/L[28]。另外,功能核酸不仅能识别靶标物的一个羟基或甲基的细小变化,甚至还能够区分旋光异构体。例如,咖啡因和茶碱仅有一个甲基的差别,然而茶碱与其适配体的结合力比咖啡因的强出10000倍[29];L-精氨酸与其适配体的亲和力比D-精氨酸高12000倍[30]。
(3)体外合成与筛选、易于修饰。蛋白质(如抗体)的经典制备方法是在生物体系中通过对目标物进行诱导免疫应答获得,当目标分子和内源性蛋白结构相似或抗原具有毒性时,可能会导致免疫应答反应失败,即受到免疫原性、机体耐受性等多种因素的限制。而功能核酸的筛选可利用SELEX技术在生物体外进行,并能进行精确的位点修饰,如同位素标记、荧光标记、生物素标记、电化学探针及猝灭基团修饰等。
(4)性质稳定,便于运输和保存。功能核酸在多数情况下即使变性后其活性也可恢复,且保存时间长,冻成干粉后还可以在室温保存数年甚至更久。而蛋白质对环境的耐受程度低,在高温、强酸、强碱等比较苛刻的化学环境下很容易产生变性,且该变性多为不可逆过程,其保存时间也相对较短。
(5)功能核酸大多数具有靶分子诱导构象变化,无毒性,无免疫原性,组织渗透性好。由于功能核酸具有核苷酸固有的性质,可以与某些DNA 或RNA分子相互融合,形成具有复合功能的序列,既能特异性识别目标物,同时又能产生可检测的信号[31]。
3 功能核酸在生物传感器中的应用
随着SELEX技术的快速发展,功能核酸的应用也越来越受到研究者们的关注。由于功能核酸制备简单快速、稳定性强、易于修饰、对目标分子特异性强等优点,在分离分析、纳米技术、有机合成、药物研发、临床诊断、靶向药物输送以及构建生物传感器等领域有着非常大的应用前景,是目前科学研究的热门课题。在构建的功能核酸传感器中,根据功能核酸的分类不同,将其分为基于核酸适配体的传感器,基于脱氧核酶的传感器和基于其他功能核酸的传感器。
3.1基于核酸适配体的传感器
核酸通过碱基配对、静电作用、氢键及疏水堆积等原因发生折叠,形成较为稳定的空间结构,这些空间结构由于氢键、范德华力及形状匹配等作用与目标分子特异性结合,可以成为该目标分子的识别元件。人们把含有这种识别元件的生物传感器称为基于核酸适配体的传感器。
目前,科学研究者已构建了多种核酸适配体传感器用于各种目标物的检测。
如核酸适配体与荧光共振能量转移、电致发光以及比色法等不同的信号传导机制结合,可以直接用于无机离子和小分子的快速检测。例如,钾离子(K+)适配体(5'-GGGTTAGGGTTAGGGTTAGGG-3')是一条富含G的单链核苷酸序列。当该适配体与目标K+结合后,适配体通过鸟嘌呤G分子间的氢键作用力折叠成四链体构型。Wang等[32]基于该原理设计了一种使用金纳米颗粒作为比色法指示剂的检测K+的方法。如图2所示,当K+不存在时,核酸适配体包裹金纳米颗粒,加盐后金纳米颗粒不团聚,溶液呈红色;当加入K+后,核酸适配体与K+结合,不能有效地保护金纳米颗粒,加盐后产生团聚,溶液颜色呈蓝色。核酸适配体序列 (5'-CCTGGGGGAGTATTGCCGAGGAGGGT-3')能高特异性结合腺苷形成三维结构。同样,Li等[33]基于金纳米颗粒和功能核酸适配体建立了一种检测腺苷的方法。如图3所示,在该实验中,腺苷核酸适配体被分裂为两段,分别修饰在不同的金纳米颗粒表面,利用核酸适配体片段与目标腺苷之间高亲和力,拉近金纳米颗粒之间的距离,通过表面等离子体共振改变溶液颜色,从而实现对腺苷的定量检测。
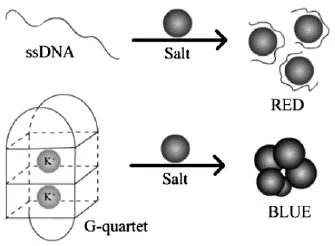
图2 核酸适配体传感器比色法检测K+原理示意图[32]Fig.2 The schematic of potassium ion detection based on Aptamer[32]

图3 基于金纳米颗粒的核酸适配体传感器用于腺苷的检测原理示意图[33]Fig.3 The schematic of adenosine detection based on Aptamer[33]
3.2基于脱氧核酶的传感器
长期以来,人们都认为只有某些特殊的蛋白质才具有生物催化活性,研究者们也一直采用“酶的化学本质为蛋白质”的理论。1981年,Cech小组[34]报道了四膜虫26SRNA前体的体外自我剪切,提出了RNA具有酶的催化活性,打破了 “生物酶的化学本质是蛋白质”的传统理念。1994年,Joyce等[35]利用催化洗脱手段和体外筛选技术发现了具有特异性催化Pb2+切割RNA底物的DNA单链,即为脱氧核酶(DNAzyme)。同年,Cuenoud等[36]也发现了这种具有较高催化活性和良好结构识别能力的单链DNA。
随着脱氧核酶的发现,许多脱氧核酶的荧光传感器被设计来用于各种目标物的检测,并且这些传感器均具有灵敏度高、无生物毒性等优点。例如,Li小组[37]设计了一种基于8-17脱氧核酶选择性识别铅离子(Pb2+)的荧光传感器,其原理如图4所示,将荧光基团(TAMRA)与猝灭基团(Dabcyl)分别标记于酶底物链的两侧,当有Pb2+存在时,脱氧核酶底物链会被切断,3'端和5'端相互远离,致使荧光基团和猝灭基团相互分离,体系荧光信号增强,从而实现对Pb2+的灵敏检测。Plaxco等[38]利用8-17脱氧核酶把其5'端固定在金电极表面,同时在3'端标记了亚甲基蓝,以此防止亚甲基蓝接近电极传递电子。如图5所示,在Pb2+存在下,催化脱氧核酶底物链裂解,使底物链断裂为两段,底物链两片段解离后,亚甲基蓝可以接近电极与其发生电子传递,从而产生可以检测到的电信号。另外,Yang等[39]构建了一种基于脱氧核酶功能化金纳米粒子的信号扩增反应检测Pb2+的电化学传感器,该方法的检测下限达到0.028 nmol/L。

图4 基于Pb2+的酶底物链两标记的脱氧核酶传感器设计原理图[37]Fig.4 The schematic of lead ion detection based on DNAzyme[37]
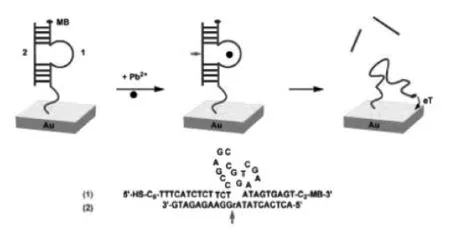
图5 基于Pb2+特异性切割的脱氧核酶及其电化学检测传感示意图[38]Fig.5 The schematic of lead ion detection based on DNAzyme and electrochemical detection[38]
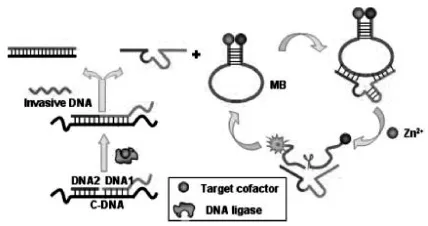
图6 基于分子信标的脱氧核酶传感器用于辅助因子ATP及NAD+的检测原理示意图[40]Fig.6 Design strategy of the DNAzyme cascade for amplified fluorescence detection of cofactor[40]
Lu等[40]设计将8-17脱氧核酶先分成两个独立的寡核苷酸片段,如图6所示,在(ATP或 NAD+)辅助因子和连接酶的作用下使其连接起来,随后引入一条外来的DNA链杂交使原8-17脱氧核酶被释放出来,释放出的8-17脱氧核酶与一具有发夹结构的分子信标底物结合生成具有催化功能的体系,从而实现对目标辅助因子ATP和NAD+的检测。
3.3基于其他功能核酸的传感器
核酸适配体与目标物通过分子间作用力可以特异性结合,人们发现,金属阳离子也能直接与碱基作用发生特异性结合,其中较为典型的有汞离子(Hg2+)和银离子(Ag+)。Hg2+能特异性结合胸腺嘧啶(Thymine,T)与其产生强的相互作用力,若单链中富含碱基T,在Hg2+存在的条件下,可以使单链DNA的构型发生转变,形成T-Hg2+-T错配结构。Ono等设计了一条两端分别修饰了荧光基团和猝灭基团的富含T的DNA探针,当Hg2+存在时,由于形成T-Hg2+-T结构使荧光基团与猝灭基团相互靠近,继而发生荧光共振能量转移,使体系的荧光被猝灭,从而依据体系荧光信号的变化对Hg2+进行定量检测。
类似的,Ag+与核酸链中的胞嘧啶(Cytosine,C)之间也有强的相互作用,能形成C-Ag+-C稳定结构。如图7所示,Yang等[41]设计合成了富含胞嘧啶C的DNA序列,在Ag+存在情况下,使单链DNA的构型转变,形成C-Ag+-C错配结构,在加入双链嵌入剂荧光染料SYBR Green1(SG)后,SG可嵌入到C-Ag+-C双链复合物中,使得SG的荧光增强。
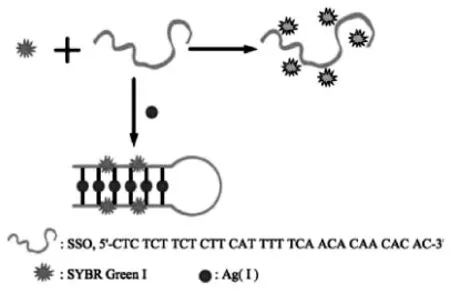
图7 基于形成C-Ag+-C荧光传感器用于Ag+的检测原理示意图[41]Fig.7 Schematic description of the fluorescent Ag+sensing mechanism[41]

图8 基于形成T-Hg2+-T及G-四链体结构传感器用于检测Hg2+的原理示意图[42]Fig.8 Schematic description of the fluorescent Hg2+sensing mechanism[42]
另外,富含G的核酸序列能特异性识别K+或Pb2+形成G-四链体结构,例如,Wang等[42]设计利用T-Hg2+-T调节G-四链体DNA抑制脱氧核酶的活性,构建了一种比色法检测Hg2+的传感器,如图8所示,当Hg2+存在时,富含T的DNA单链构型转变,形成T-Hg2+-T结构,抑制了G-四链体DNA的形成,即无DNAzyme的生成。然而,当不存在Hg2+时,DNA单链在K+及血红素的作用下,形成G-四链体DNA,伴随ABTS的H2O2介导氧化反应,体系比色信号发生变化,从而实现对Hg2+的检测。
4 结论与展望
SELEX技术自问世以来,在筛选技术上不断丰富和完善,应用领域不断拓展。功能核酸的出现拓宽了人们的视野,打破了人们对核酸只作为遗传信息存储和转运载体的传统观念,加深了对核酸的进一步理解,并且为生物分子的研究提供了一种新的活性物质。由于功能核酸的特殊功能,在生化分析和生物传感领域的研究者越来越多的应用功能核酸,并建立了一系列以功能核酸为分子探针的检测体系。功能核酸制备简单快速、稳定性强、易于修饰、对目标分子特异性强等优点,在分离分析、纳米技术、有机合成、药物研发、临床诊断、靶向药物输送以及构建生物传感器等领域有着非常大的应用前景。
[1]Lu Y.New Transition-Metal-Dependent DNAzymes as Efficient Endonucleases and as Selective Metal Biosensors[J].Chemistry-A European Journal,2002,8(20): 4588-4596.
[2]Navani N K,Li Y.Nucleic acid aptamers and enzymes as sensors[J].Current Opinion in Chemical Biology,2006,10(3):272-281.
[3]Silverman S K.In vitro selection,characterization,and application of deoxyribozymes that cleave RNA[J].Nucleic Acids Research,2005,33(19):6151-6163.
[4]Jennifer S B.Functional Nucleic Acids for Analytical Applications[J].Journal of the American Chemical Society,2009,131(32):11635-11636.
[5]Tuerk C,Macdougal S,Gold L.RNA pseudoknots that inhibit human immunodeficiency virus type 1 reverse transcriptase[J].Proceedings of the National Academy of Sciences,1992,89(15):6988-6992.
[6]Sassanfar M,Szostak J W.An RNA motif that binds ATP [J].Nature,1993,364(6437):550-553.
[7]Hermann T,Patel D J.Adaptive recognition by nucleic acid aptamers[J].Science,2000,287(5454):820-825.
[8]Ellington A D,Szostak J W.In vitro selection of RNA molecules that bind specific ligands[J].Nature,1990,346:818-822.
[9]Tuerk G,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J].Science,1990,249(4968):505-510.
[10]Liu J,Cao Z,Lu Y.Functional nucleic acid sensors[J]. Chemical Reviews,2009,109(5):1948-1998.
[11]Gopinath S C.Methods developed for SELEX[J].Analytical and Bioanalytical Chemistry,2007,387(1):171-182.
[12]Ahn J Y,Kim E Y,Ryu J C,et al.Selection of aptamers in SELEX process[J].Toxicology and Environmental Health Sciences,2009,1(1):1-7.
[13]You K M,Lee S H,Im A,et al.Aptamers as functional nucleic acids:In vitro selection and biotechnological applications[J].Biotechnology and Bioprocess Engineering,2003,8(2):64-75.
[14]Joyce G F.Directed evolution of nucleic acid enzymes [J].Annual Review of Biochemistry,2004,73:791-836.
[15]Willner I,Shlyahovsky B,Zayats M,et al.DNAzymes for sensing,nanobiotechnology and logic gate applications [J].Chemical Society Review,2008,37:1153-1165.
[16]Miyake Y,Togashi H,Tashiro M,et al.MercuryII-mediated formation of thymine-HgII-thymine base pairs in DNA duplexes[J].Journal of the American Chemical Society,2006,128(7):2172-2173.
[17]Ono A,Togashi H.Highly selective oligonucleotidebased sensor for mercury(II)in aqueous solutions[J]. Angewandte Chemie International Edition,2004,43(33): 4300-4302.
[18]Clever G H,Kaul C,Carell T.DNA-Metal base pairs[J]. Angewandte Chemie International Edition,2007,46(33): 6226-6236.
[19]Zhu Z Q,Su Y Y,Li J,et al.Highly sensitive electrochemical sensor for mercury(II)ions by using a mercuryspecific oligonucleotide probe and gold nanoparticlebased amplification[J].Analytical Chemistry,2009,81 (18):7660-7666.
[20]Ono A,Cao S,Togashi H,et al.Specific interactions between silver(I)ions and cytosine-cytosine pairs in DNA duplexes[J].Chemical Communications,2008,39(39): 4825-4827.
[21]Firooz A R,Ensafi A A,Kazemifard N,et al.Development of a highly sensitive and selective optical sensor fordetermination of ultra-trace amount of silver ions[J]. Sensors and Actuators B:Chemical,2013,176:598-604.
[22]Smirnov I,Shafer R H.Lead is unusually effective in sequence-specific folding of DNA[J].Journal of Molecular Biology,2000,296(1):1-5.
[23]Guschlbauer W,Chantot J F,Thiele D.Four-stranded nucleic acid structures 25 years later:from guanosine gels to telomer DNA[J].Journal of Biomolecular Structure and Dynamics,1990,8(3):491-511.
[24]Tyagi S,Kramer F R.Molecular beacons:probes that fluoresce upon hybridization[J].Nature Biotechnology,1996,14(3):303-308.
[25]Tyagi S,Marras S A,Kramer F R.Wavelength-shifting molecular beacons[J].Nature Biotechnology,2000,18 (11):1191-1196.
[26]Tyagi S,Bratu D P,Kramer F R.Multicolor molecular beacons for allele discrimination[J].Nature Biotechnology,1998,16(1):49-53.
[27]Ruckman J,Green L S,Beeson J,et al.2'-Fluoropyrimidine RNA-based aptamers to the 165-amino acid form of vascular endothelial growth factor(VEGF165)Inhibition of receptor binding and VEGF-induced vascular permeability through interactions requiring the exon 7-encoded domain[J].Journal of Biological Chemistry,1998,273 (32):20556-20567.
[28]Pagratis N C,Bell C,Chang Y F,et al.Potent 2'-amino-,and 2′-fluoro-2′-deoxyribonucleotide RNA inhibitors of keratinocyte growth factor[J].Nature Biotechnology,1997,15(1):68-73.
[29]Jenison R D,Gill S C,Pardi A,et al.High-resolution molecular discrimination by RNA[J].Science,1994,263(5152):1425-1429.
[30]Geiger A,Burgstaller P,Eltz H,et al.RNA aptamers that bind L-arginine with sub-micromolar dissociation constants and high enantio selectivity[J].Nucleic Acids Research,1996,24(6):1029-1036.
[31]Teller C,Shimron S,Willner I.Aptamer-DNAzyme hairpins for amplified biosensing[J].Analytical Chemistry,2009,81(21):9114-9119.
[32]Wang L H,Liu X F,Hu X F,et al.Unmodified gold nanoparticles as a colorimetric probe for potassium DNA aptamers[J].Chemical Communications,2006,36(36): 3780-3782.
[33]Li,F,Zhang J,Cao X N,et al.Adenosine detection by using gold nanoparticles and designed aptamer sequences[J].Analyst,2009,134(7):1355-1360.
[34]Kruger K,Grabowaki P J,Zaug A J,et al.Self-splicing RNA:autoexcision and autocyclization of the ribosomal RNA intervening sequence of tetrahymena[J].Cell,1982,31(1):147-157.
[35]Breaker R R,Joyce G F.A DNA enzyme that cleaves RNA[J].Chemistry&Biology,1994,1(4):223-229.
[36]Cuenoud B,Szostak J W.A DNA metalloenzyme with DNA ligase activity[J].Nature,1995,375(15):611-614.
[37]Chiuman W,Li Y.Efficient signaling platforms built from a small catalytic DNA and doubly labeled fluorogenic substrates[J].Nucleic Acids Research,2007,35(2): 401-405.
[38]Xiao Y,Rowe A A,Plaxco K W.Electrochemical detection of parts-per-billion lead via an electrode-bound DNAzyme assembly[J].Journal of the American Chemical Society,2007,129(2):262-263.
[39]Yang X R,Xu J,Tang X M,et al.A novel electrochemical DNAzyme sensor for the amplified detection of Pb2+ions[J].Chemical Communications,2010,46(18):3107-3109.
[40]Lu L M,Zhang X B,Kong R M,et al.A ligation-triggered DNAzyme cascade for amplified fluorescence detection of biological small molecules with zero-background Signal [J].Journal of the American Chemical Society,2011,133 (30):11686-11691.
[41]Yang Q,Li F,Huang Y,et al.Highly sensitive and selective detection of silver(I)in aqueous solution with silver(I)-specific DNA and Sybr Green I[J].Analyst,2013,138 (7):2057-2060.
[42]Li T,Dong S J,Wang E K.Label-free colorimetric detection of aqueous mercury ion(Hg2+)using Hg2+-modulated G-quadruplex-based DNAzymes[J].Analytical Chemistry,2009,81(6):2144-2149.
Study of aptamer and DNAzyme based functional nucleic acid sensing methods
Li Pan-pan,He Jing-lin*,Li Ting,Yang Chan,Xiao Hui,Huang Si-ying,Cao Zhong*
(Collaborative Innovation Center of Micro/nano Bio-sensing and Food Safety Inspection,Hunan Provincial Key Laboratory of Materials Protection for Electric Power and Transportation,School of Chemistry and Biological Engineering,Changsha University of Science and Technology,Changsha 410114,China)
This opinion covers the field of aptamers and DNAzymes,in which nucleic acids are molecularly engineered to have unique functions for the investigation of biomolecules.This review discusses these functional nucleic acids,their traditional selection approaches,special characteristics and the application in the analysis of biological sensing field.The aptamers and DNAzymes are highly useful for studies with molecular recognition.These unique applications have shown that functional nucleic acids hold great potential in genomics and proteomics.
aptamer;SELEX;DNAzyme;sensing analysis
国家自然科学基金(31527803,21545010)、中国科学院环境监测STS项目(KFJ-SW-STS-173)
*通信联系人,Tel/Fax:0731-85258733,E-mail:jinglin_he@163.com,zhongcao2004@163.com

