金纳米花-人血清白蛋白对色氨酸对映异构体的手性识别
杨成成,李 洋,马 骄,夏 巧,傅英姿
(西南大学化学化工学院,重庆400715)
金纳米花-人血清白蛋白对色氨酸对映异构体的手性识别
杨成成,李洋,马骄,夏巧,傅英姿*
(西南大学化学化工学院,重庆400715)
将人血清白蛋白(HSA)自组装于金纳米花(AuNFs)修饰的玻碳电极表面,从而构建了一个简单的手性传感界面,利用方波伏安技术(SWV)研究了该修饰电极与色氨酸对映异构体(D-Trp和L-Trp)的相互作用。实验结果表明,当D-或L-Trp与手性界面作用后,电极表面电子传递受阻,表现为不同的方波响应;其中LTrp的峰电流明显低于D-Trp,峰电流差值达到123.7μA;峰电流与浓度在1.0×10-6mol/L到5.0×10-3mol/L范围内呈线性相关。
手性识别;人血清白蛋白;色氨酸;金纳米花
0 引言
手性(chirality)是物质与其自身的镜像不能重合的特性,是自然界和生命体的基本属性[1]。手性广泛存在于生命科学、药物科学和食品科学等领域,对生命体的活动起到至关重要的作用。蛋白质、DNA、氨基酸、酶等生物分子在生物体内构成了一个复杂且庞大的手性系统,其中氨基酸作为生命物质的基本单元,不同构型的氨基酸在生命科学和其他相关领域发挥着不同的作用[2-3],如L-氨基酸是蛋白质的基本组成单元,而D-氨基酸不仅不参与蛋白质的合成,甚至会对生物体产生生理毒性[4]。L-Trp作为组成蛋白质的第二必需氨基酸,既可以决定蛋白质的生理活性,又在人和动物的成长和代谢过程中起着不可或缺的作用[5]。当人体内L-色氨酸的含量过低时可能会导致人体产生焦虑、抑郁等不良反应[6-7]。D-色氨酸(D-Trp)虽然不参与蛋白质的合成,但它却是制药工程中肽类抗生素和免疫抑制剂的重要合成中间体[8]。因此,在生命科学和制药工程中,对色氨酸对映异构体纯度和含量的检测变得至关重要[9]。目前为止,多种检测技术已被用到色氨酸对映异构体的识别和检测中,如高效液相色谱法[10]、毛细管电泳法[11]、荧光微量法[12]、化学发光法[13]和电化学方法[14]。其中,由于易操控、成本低、稳定性好和灵敏度高的优点,电化学方法已被广泛用于色氨酸对映异构体的识别和检测[15-16]。
人血清白蛋白(HSA)是由585个氨基酸残基组成的单链蛋白质,有3个结构相似的ɑ-螺旋结构域。人血清白蛋白分子中含有17个二硫键[17],可与贵金属牢固结合[18],而且贵金属纳米材料如纳米金与之结合后,由于良好的生物相容性,对蛋白质的生物活性也无影响[19];纳米金良好的电子传递能力[20]、较高的比表面积[21]等特点在一定程度上可以拓宽蛋白质作为手性选择剂的应用范围。
该实验中,首先在洁净的玻碳电极表面电沉积纳米金,然后通过Au-S键将人血清白蛋白自组装在电极上,由此构建了一种简单的电化学手性表面,并将该手性界面用于色氨酸对映异构体的选择性作用研究。
1 实验部分
1.1试剂和仪器
L-色氨酸(99%)、D-色氨酸(99%)和氯金酸(HAuCl4·4H2O,99.99%)购于阿拉丁试剂公司(中国上海),人血清白蛋白(HSA,98%)购于百灵威试剂公司(中国北京)。工作溶液为5.0 mmol/L [Fe(CN)6]4-/3-(由0.1 mol/L磷酸盐缓冲溶液pH7.4配制)。其余化学试剂均为分析纯,所有实验用水为去离子水。所有电化学测试在CHI 440A电化学工作站(中国,上海辰华)上进行。标准三电极体系中,以饱和甘汞电极为参比电极,铂丝电极为对电极,玻碳电极或修饰电极为工作电极。循环伏安(CV)、方波伏安(SWV)和交流阻抗(EIS)用于实验研究中。循环伏安扫描范围为-0.2 V~0.6 V,扫速100 mV/s。EIS测试频率范围在开路电位下为0.1~105 Hz,振幅为0.22 V。扫描电子显微图像由S-4800扫描电子显微镜(SEM,日本日立)得到。
1.2手性生物传感界面的制备
裸玻碳电极(GCE,Φ=4mm)分别用1.0、0.3 和0.05 μm的Al2O3抛光粉打磨抛光,依次在乙醇和去离子水中超声清洗,自然晾干。随后,将玻碳电极置于1%的HAuCl4溶液中,采用溶出法在-0.2 V的恒电位下电沉积60 s,取出并用去离子水冲洗干净。再在该修饰电极表面滴加8 μL,0.5 mg/mL的HSA溶液,将该修饰电极置于4℃下保存过夜。电极构建如图1所示。

图1 电极表面构建原理图Fig.1 The establishment of electrode surface schematic diagram
2 结果与讨论
2.1界面的SEM检测
图2a所示为导电玻璃在-0.2 V的电压下,电沉积60 s纳米金的SEM表征图,从图中可以看出,纳米金分散较为均匀。插图c为单个纳米金的SEM图,从图中可以看出单个纳米金为明显的花状结构。图2b所示为HSA孵育在纳米金表面的SEM表征图,可以看出在自组装HSA之后电极表面变得更加粗糙,而且相较于前面的图2a,该图像较为模糊,边缘增大且较亮,这是因为修饰了HSA分子后改变了电极表面纳米金粒子的形态。因此,可以说明HSA已经成功组装在电极表面。

图2 (a)AuNFs和(b)HSA/AuNFs的SEM表征;插图(c)单个AuNFs的SEM表征Fig.2 SEM images:(a)AuNFs,(b)HSA/AuNFs,(c)a single AuNF
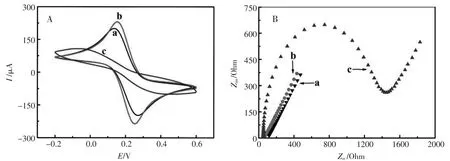
图3 不同修饰电极的CV(A)和EIS(B)响应:(a)裸GCE,(b)AuNFs/GCE,(c)HSA/AuNFs/GCEFig.3 CVs(A)and EIS(B)of different eletrodes in 5.0mmol/L[Fe(CN)6]4-/3-solution(pH7.4):(a)bare GCE,(b)AuNFs/GCE,(c)HSA/AuNFs/GCE
2.2修饰界面的电化学特性
该实验采用循环伏安技术(CV)对电极修饰过程中电极表面的电化学特性进行研究。电化学测试在5.0 mmol/L的[Fe(CN)6]4-/3-(pH7.4)溶液中进行,扫速为0.1 V/s。如图3A所示,裸GCE电极在电化学测试中呈现一对可逆的氧化还原峰 (曲线a),在电极表面电沉积纳米金后(AuNFs/GCE)峰电流显著增加(曲线b),这是因为纳米金具有提高电子传递速率的特性;在AuNFs/GCE表面修饰HSA后,由于蛋白质阻碍电子的传递,所以峰电流响应下降且明显降低(曲线c)。
交流阻抗技术(EIS)用于跟踪电极修饰过程中电极表面阻抗的变化。如图3B所示,测试出的阻抗图谱中包括低频的线性部分和高频的半圆部分,半圆的直径相当于界面电子传输的阻抗[22]。但由于修饰过HSA的电极表面阻抗相对于AuNFs/GCE和裸GCE表面的阻抗大很多,导致裸GCE和AuNFs/GCE阻抗的半圆不明显。裸GCE阻抗较小(曲线b),在电极表面电沉积纳米金后,阻抗变小,这是由于电极表面的纳米金粒子提高了电极表面的电子传输能力 (曲线a)。当AuNFs/GCE表面滴涂上HSA时,阻抗明显增加(曲线c),这与前面的循环伏安测试结果相符。
2.3修饰电极对色氨酸的识别
采用方波伏安技术研究了HSA/AuNFs/GCE修饰电极与L-或D-Trp的相互作用,如图4A所示,修饰电极分别与L-Trp和D-Trp(5.0 mmol/L)作用后,两者电流响应明显不同,峰电流差(△I=△IL-△ID)达到123.7 μA。产生这种现象是因为HSA和色氨酸均具有阻碍电子传输的特性,但是色氨酸对映异构体因其自身构型不同,所以与HSA的结合能力不同,电极表面电子传输能力也因此发生变化。如图4B所示EIS测试结果表明L-Trp与修饰电极作用后电极表面阻抗(曲线e)显著增大,而D-Trp与修饰电极作用后电极表面阻抗(曲线d)略有增加,且二者的阻抗差值为330 Ω。
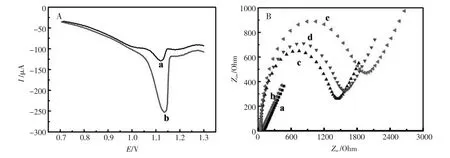
图4 (A)L-Trp(a)和D-Trp(b)在HSA/AuNFs/GCE表面的SWV响应,(B)不同修饰电极的EIS图:(a)裸GCE (b)AuNFs/GCE,(c)HSA/AuNFs/GCE(d)D-Trp/HSA/AuNFs/GCE,(e)L-Trp/HSA/AuNFs/GCEFig.4 (A)SWV of L-Trp(a)and D-Trp(b)on HSA/AuNFs/GCE in 5.0 mmol/L[Fe(CN)6]4-/3-solution,(B)EIS of different electrode in 5.0 mmol/L[Fe(CN)6]4-/3-solution(pH7.4):(a)bare GCE,(b)AuNFs/GCE,(c)HSA/AuNFs/GCE,(d)D-Trp/HSA/AuNFs/GCE,(e)L-Trp/HSA/AuNFs/GCE
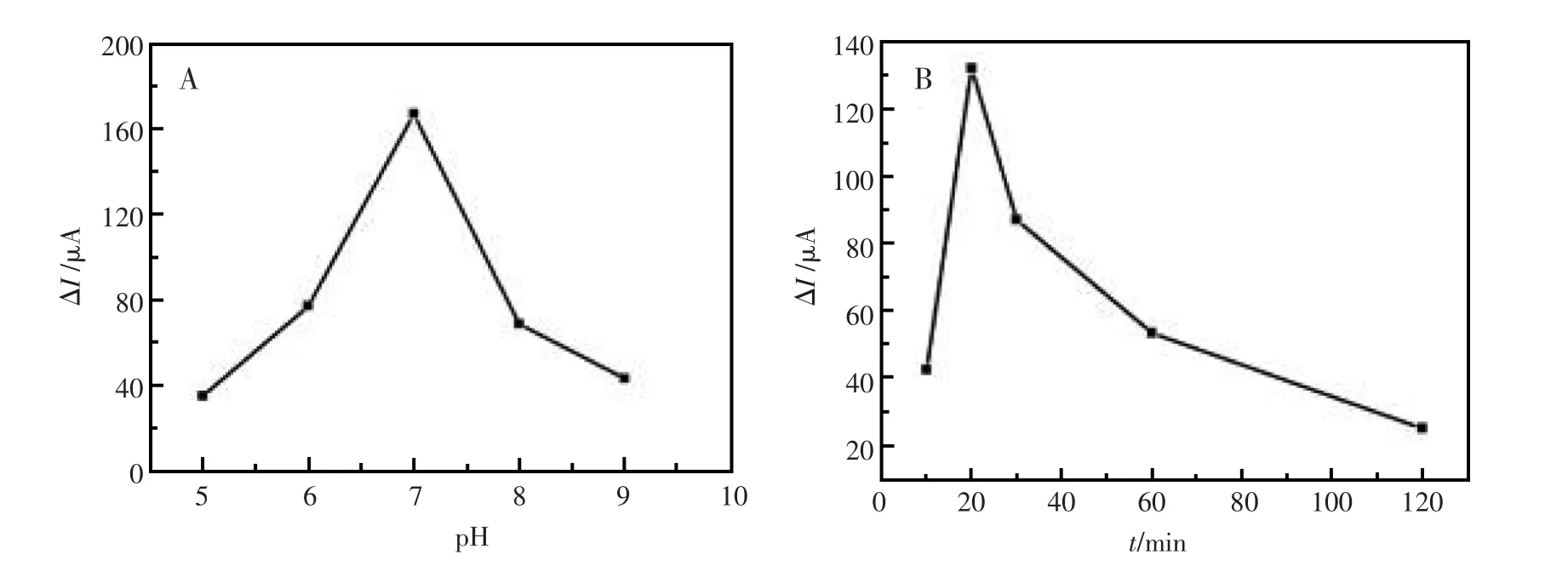
图5 pH和时间对手性识别的影响:(A)pH,(B)timeFig.5 pH and time dependence of chiral recognition:(A)pH,(B)time
2.4实验条件优化
2.4.1pH的影响
pH的变化会影响手性界面与色氨酸对映异构体之间的相互作用,图5A为HSA/AuNFs/GCE 与L-和D-色氨酸(5.0 mmol/L)作用后获得的方波响应。两种构型的峰电流差值随着pH的变化而变化,在pH5~pH7之间,峰电流差值随着pH的增大而增加;但随着pH的继续增加,峰电流差值却随pH增加而减小。因此,实验条件选择pH7为最佳pH。
2.4.2作用时间的影响
实验中通过控制时间来探究手性界面与色氨酸对映异构体的相互作用,将作用时间设置为10 min、20 min、30 min、1 h和2 h。通过图5B可知,当修饰电极与色氨酸对映异构体作用10 min后,出现了较小的峰电流差值,而在20 min后,两种构型的峰电流差值达到最大(ΔI=131.9 μA),但随着时间的继续增加,峰电流差值呈现下降的趋势,且在30 min到2 h之间峰电流差值变化不大。所以将20 min作为最佳的作用时间。
2.5线性
实验进一步研究了峰电流与L-或D-色氨酸浓度变化的关系,在最佳pH和时间条件下,HSA/AuNFs/GCE与不同浓度的L-Trp(直线a)和D-Trp(直线b)作用后进行了方波伏安测试。图6所示HSA/AuNFs/GCE与浓度从1.0×10-6mol/L 到5.0×10-3mol/L的两种构型色氨酸作用后,电极表面的电子传输能力发生改变,与未作用的修饰电极相比峰电流减小。随着色氨酸浓度的增大,峰电流呈上升趋势,这是因为两种构型的色氨酸会不同程度的破坏HSA的结构,使疏水基暴露在外,从而使HSA以一种更疏松的状态存在,有利于电子的传输[23]。从图6可以看出ΔID>ΔIL,但ΔIL的递减更为显著。经过线性拟合,得出线性方程分别为ΔID=4.067-0.2378c(r=0.9974)和ΔIL=2.619-0.3943c(r=0.9989)。
2.6不同色氨酸对映异构体识别方法比较
近年来,用电化学方法识别色氨酸对映异构体的研究已取得了很大的进展[24-25]。现将已有的研究成果做对比,如表1。该研究中,在玻碳电极上电沉积纳米金后自组装上HSA,用该修饰电极对色氨酸对映异构体进行识别,并展现出较高的手性选择性。

图6 峰电流与L/D-Trp的响应关系1.0×10-6mol/L~5.0×10-3mol/L:(a)D-Trp,(b)L-TrpFig.6 Dependence of the peak current on the concentration of(a)D-Trp and(b)L-Trp from 1.0×10-6mol/L to 5.0×10-3mol/L

表1 不同色氨酸对映异构体识别方法对比Tab.1 Comparison of different methods for the identification of tryptophan enantiomers
3 结论
由于HSA与色氨酸对映异构体的相互作用能力不同,不同电极表面的电子传输能力也不同,因此在SWV中得到不同的峰电流,从而可以进行手性识别研究。在该实验中,将HSA自组装于电沉积纳米金修饰的玻碳电极表面,构建了一个简单可靠的电化学传感界面,将其用于色氨酸对映异构体的手性识别研究,并得到了良好的手性识别效果。通过对pH和时间的条件优化,确定了最佳pH为7.0,最佳作用时间为20 min。在1.0×10-6mol/L到5.0×10-3mol/L的浓度范围内峰电流与浓度有很好的线性响应。该传感器不仅能够识别色氨酸手性异构体,而且为其他手性物质与HSA的作用提供了一定的理论基础,因此该方法具有潜在的应用价值。
[1]戴立信,席振峰,王梅祥.有机化学一结构与功能[M].北京:化学工业出版社,2006.139-140.
[2]Trojanowicz M,Wcislo M.Electrochemical and Piezoelectric Enantioselective Sensors and Biosensors[J]. Anal Lett.,2005,38:523-547.
[3]Qing G Y,Sun T L,Chen Z H,et al.Naked-Eye Enantioselective Chemosensors for N-Protected Amino Acid Anions Bearing Thiourea Units[J].Chirality,2009,21: 363-373.
[4]Gopal R,Seo C H,Song R I,et al.Effect of repetitive lysinetry-ptophan motifs on the bactericidal activity of antimicrobial peptides[J].Amino Acids,2013,44:645-660.
[5]Budisa N,Rubini M,Bae J H,et al.Global Replacement of Tryptophan with Aminotryptophans Generates Non-Invasive ProteinBased Optical pH Sensors[J].Angew. Chem.Int.Ed,2002,41:4066-4069.
[6]Suzuki Y,Suda T,Furuhashi K,et al.Increased serum kynurenine/tryptophan ratio correlates with disease progression in lung cancer[J].Lung Cancer,2010,67: 361-365.
[7]Van der Does A J Willem.The Effects of tryptophan depletion on mood andpsychiatric symptoms[J].J.Affect. Disorders,2001,64:107-119.
[8]Wang D H,Wei P,Ouyang P.Advance in Studying on DTryptophan[J].Chemical Industry and Engineering Progress,2002,21:103-105.
[9]Kang S Z,Chen H,Li X Q,et al.Preparation of L-alanine ethyl ester modified multi walled carbon nanotubes and their chiral discrimination between D-and L-tryptophan [J].DiamondRelat.Mater.,2010,19:1221-1224.
[10]Zhen Q N,Xu B,Ma L,et al.Simultaneous determination of tryptophan kynurenine and 5-hydroxytryptamine by HPLC:Applicationinuremicpatientsundergoing hemodialysis[J].Clin.Biochem.,2011,44:226-230.
[11]Kuhn R,Erni F,Bereuter T,et al.Chiral recognition and enantiomeric resolution based on host-guest complexation with crown ethers in capillary zone electrophoresis [J].Analytical Chemistry,1992,64(22):2815-2820.
[12]Miller G D,Johnson J A,MillerB S.Fluorometric Micromethod for Determination of Tryptophan[J].Anal. Chem.,1956,28:884-887.
[13]Liang Y D,Song J F.Flow-injection chemiluminescence determination of tryptophan through its peroxidation and epoxidation by peroxynitrous acid[J].J.Pharm.Biomed. Anal.,2005,38:100-106.
[14]Zor E,Patir L H,Bingol H,et al.An electrochemical biosensor based on human serum albumin/graphene oxide/3aminopropyltriethoxysilan-e modified ITO electrode for the enantioselective discrimination of D-and L-tryptophan[J].Biosens.Bioelectron.,2013,42:321-325.
[15]Gu X,Tao Y,Pan Y,et al.DNA-inspired electrochemical recognition of tryptophan isomers by electrodeposited chitosan and sulfonated chitosan[J].Anal.Chem.,2015,87(18):9481-9486.
[16]Tao Y,Dai J,Kong Y,et al.Temperature-Sensitive Electrochemical Recognition of Tryptophan Enantiomers Based on β-Cyclodextrin Self-Assembled on Poly(l-Glutamic Acid)[J].Anal.Chem.,2014,86(5):2633-2639.
[17]He X M,Carter D C.Atomic structure and chemistry of human serum albumin[J].Nature,1992,358(6383): 209-215.
[18]Li N,Zhao P,Astruc D.Anisotropic gold nanoparticles: synthesis,properties,applications,and toxicity[J]. Angew.Chem.Int.Ed.,2014,53(7):1756-1789.
[19]Kang Y J,Oh J W,Kim Y R,et al.Chiral gold nanoparticle-based electrochemical sensor for enantioselective recognition of 3,4-dihydroxyphenylalanine[J].Chem. Commun,2010,46:5665-5667.
[20]Huan S,Shen G,Yu R.Enantioselective recognition of amino acid by differential pulse voltammetry in molecularly imprinted monolayers assembled on au electrodes [J].Electroanal,2004,16:1019-1023.
[21]Qu L T,Dai L M,Osawa E.Shape/Size-Controlled Syntheses of Metal Nanoparticles for Site-Selective Modification of Carbon Nanotubes[J].J.Am.Chem.Soc.,2006,128:5523-5532.
[22]Liao Y H,Yuan R,Chai Y Q,et al.Study on an amperometric immunosensor based on Nafion-cystein composite membrace for detection of carcinaembryonic antigen[J]. Anal Biochem,2010,402(1):47-53.
[23]Liu Y,Chen M M,Wang S H,et al.New insight into the stereoselective interactions of quinine and quinidine,with bovine serum albumin[J].Mol.Recognit.,2014,27:239-249.
[24]Xu J,Wang Q,Xuan C,et al.Chiral Recognition of Tryptophan Enantiomers Based on β-Cyclodextrin-platinum Nanoparticles/Graphene Nanohybrids Modified Electrode [J].Electroanalysis,2016,28(4):868-873.
[25]Tao Y,Gu X,Deng L,et al.Chiral Recognition of d-Tryptophan by Confining High-Energy Water Molecules Inside the Cavity of Copper-Modified β-Cyclodextrin [J].The Journal of Physical Chemistry C,2015,119(15): 8183-8190.
Study on Au nanoflowers-human serum albumin for enantioselective of tryptophan enantiomers
Yang Cheng-cheng,Li Yang,Ma Jiao,Xia Qiao,Fu Ying-zi*
(School of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
A simple chiral sensing platform for enantioselective recognition of the tryptophan enantiomers was fabricated via the self-assembled of human serum albumin(HSA)on the gold nanoflowers(AuNFs)modified glassy carbon electrode.And the interaction between the modified electrodes and the tryptophan enantiomers(D-Trp and L-Trp)was studied via square wave voltammetry(SWV).The difference of peak currents in SWV display that the transmission of the electron on the electrode surface can be hindered by the interaction between D-or L-Trp and the chiral interface.The peak currents of L-Trp were significantly lower than that of D-Trp and the difference of peak currents reached 123.7 μA.The peak currents of L-Trp or D-Trp were linearly related to the concentration in the range of 1.0×10-6mol/L to 5.0×10-3mol/L.
enantioselective recognition;human serum albumin;tryptophan;gold nanoflowers
*通信联系人,E-mail:fyzc@swu.edu.cn

