达英-35对多囊卵巢综合征患者糖脂代谢的影响
李扬璐 阮祥燕,2* 赵 越 杜 娟 王利娟 崔亚美 Alfred O. Mueck,2
(1.首都医科大学附属北京妇产医院内分泌科,北京 100026;2. 德国图宾根大学妇产医院绝经内分泌中心,图宾根 D-72076, 德国)
· 更年期与妇科内分泌 ·
达英-35对多囊卵巢综合征患者糖脂代谢的影响
李扬璐1阮祥燕1,2*赵越1杜娟1王利娟1崔亚美1Alfred O. Mueck1,2
(1.首都医科大学附属北京妇产医院内分泌科,北京 100026;2. 德国图宾根大学妇产医院绝经内分泌中心,图宾根 D-72076, 德国)
目的观察达英-35治疗多囊卵巢综合征(polycystic ovary syndrome, PCOS)的疗效,探讨其对PCOS患者激素及糖脂代谢的影响。方法将确诊为PCOS的100名患者按照国际糖尿病联盟对代谢综合征的诊断分为代谢综合征(metabolic syndrome,MS)组和非代谢综合征组(non-MS)。观察并比较两组采用达英-35治疗3个月前后的激素、糖脂代谢指标的变化。结果治疗后MS组体质量指数显著降低,非MS组无明显改变;两组血清睾酮和黄体生成素(luteinizing hormone, LH)/测量卵泡刺激素(follicle stimulating hormone, FSH)明显下降(P<0.05);MS组总胆固醇降低,非MS组显著升高,两组间变化幅度比较,差异近似有统计学意义(P=0.054);两组三酰甘油浓度均有显著升高,MS组升高幅度较大,组间差异有统计学意义(P<0.05);MS组高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)在治疗后略有上升,而非MS组显著升高,组间比较差异无统计学意义(P<0.05);MS组LDL-C均有轻度下降,非MS组则略有上升,组间比较差异有统计学意义(P<0.05)。MS组空腹血糖显著下降,非MS组显著上升,组间比较差异有统计学意义(P<0.05)。MS组空腹胰岛素轻度下降,非MS组轻度上升,组间比较差异无统计学意义(P>0.05)。结论达英-35能够调整月经周期,改善高雄激素状态,并不恶化PCOS的糖脂代谢。在治疗过程中,除药物治疗外,还应注意配合饮食控制和运动,以期达到更好的疗效。
多囊卵巢综合征;代谢综合征;达英-35;糖脂代谢
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是一种常见的内分泌合并代谢紊乱性疾病,其远期合并症主要与代谢相关,包括肥胖、2型糖尿病、代谢综合征(metabolic syndrome, MS)等。达英-35 是治疗PCOS的一线用药,在调整月经周期,改善多毛、痤疮,防止子宫内膜增生等方面有显著疗效,但达英-35对糖脂代谢的影响一直存在争议。作为发生MS的高危人群,本研究将PCOS患者分为MS组和非MS组,探讨在代谢紊乱状态下达英-35对PCOS的影响。
1 研究对象与方法
1.1研究对象
选取2015年8月至2016年4月间在首都医科大学附属北京妇产医院内分泌科就诊的100例PCOS患者,年龄17~36岁,平均年龄(27.54±4.13)岁。患者均充分知情并自愿参加本研究。
1.2诊断标准
1)PCOS诊断标准:采用2003年鹿特丹标准[1]。
2)MS诊断标准:采用2005年国际糖尿病联盟(International Diabetes Federation, IDF)标准[2]。
3)排除标准:近3个月使用降压药、降糖药、口服避孕药等激素类药物、减肥药物、影响脂代谢药物;合并肝功能异常、乳腺癌、血栓病史者。
1.3治疗方法
所有患者在确诊为PCOS患者后,在药物撤退性出血或月经来潮第5天服用达英-35[Diane-35,每片含醋酸环丙孕酮(cyproterone acetate, CPA)2 mg和炔雌醇(ethinyloestradiol, EE)35μg],1片/d,连服21 d,停药后撤退性出血的第5天开始下一周期,共3个周期。
1.4观察及测量指标
所有患者均进行一般情况和基本参数的测量,包括年龄、身高、体质量、腰围、臀围、收缩压(systolic blood pressure, SBP)和舒张压(diastolic blood pressure, DBP),计算体质量指数(body mass index, BMI)和腰臀比(waist-hip ratio, WHR):BMI=体质量(kg)/身高2(m2),WHR=腰围(cm)/臀围(cm)。
所有患者在治疗前月经1~5 d或月经不规律的任意时间抽血,治疗3个月后在撤退性出血的1~5 d抽血,空腹12 h,早晨8∶00~10∶00肘静脉采血,测量卵泡刺激素(follicle stimulating hormone, FSH)、黄体生成素(luteinizing hormone, LH)、血清睾酮(testosterone),并计算LH/FSH;检测空腹血糖(fasting plasma glucose, FPG)、空腹胰岛素[fasting insulin, INS(OH)]、总胆固醇(total cholesterol, TC)、三酰甘油(triglyceride, TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、载脂蛋白AI(apolipoprotein AI, Apo AI)、载脂蛋白B(apolipoprotein B, Apo B)、脂蛋白a[lipoprotein a,Lp(a)]、C反应蛋白(C reactive protein,CRP)。胰岛素抵抗和敏感性评估采用胰岛素抵抗指数(homeostasis model assessment-insulin resistance index, HOMA-IR)和胰岛素敏感指数(insulin sensitivity index, ISI):HOMA-IR=[FPG(mmol/L)×INS(OH)(mIU/L)]/22.5,ISI=1/[FPG (mmol/L)×INS(OH)(mIU/L)]。
1.5分组
根据2005年IDF制定的MS诊断标准,将100例患者分为代谢综合征组(MS)和非代谢综合征组(non-MS)。两组分别为64例和36例。
1.6统计学方法

2 结果
2.1一般情况的比较
根据治疗前对两组患者的一般情况进行比较发现,MS组BMI、WHR、血压、TG、空腹血糖、空腹胰岛素、胰岛素抵抗指数以及CRP均明显高于非MS组,差异有统计学意义(P<0.05),Lp(a)浓度和胰岛素敏感指数显著低于对照组,其余指标差异无统计学意义(P>0.05),详见表1。
2.2治疗前后人体测量指标的比较
经过3个月的治疗后,MS组BMI显著下降(P<0.05),非MS组BMI则无明显变化(P>0.05),两组BMI降低幅度的比较,差异有统计学意义(P<0.05)。WHR、收缩压、舒张压等人体测量学指标在治疗前后差异无统计学意义(P>0.05),组间比较,差异有统计学意义(P>0.05),详见表2。
2.3治疗前后早卵泡期激素浓度的比较
两组患者在治疗后LH/FSH和睾酮浓度显著下降(P<0.05),但上述两项指标在两组间比较差异有统计学意义(P>0.05),详见表3。

表1 治疗前一般情况的比较
△1 mmHg=0.133kPa; MS:metabolic syndrome; BMI: body mass index; WHR: waist-hip ratio; SBP: systolic blood pressure; DBP: diastolic blood pressure; LH: luteinizing hormone; FSH: follicle stimulating hormone; T: testosterone; TC: total cholesterol; TG: triglyceride; HDL-C: high density lipoprotein-cholesterol; LDL-C: low density lipoprotein-cholesterol; Apo AI: apolipoprotein AI; Apo B: apolipoprotein B; Lp(a): lipoprotein a; FPG: fasting plasma glucose; FINS: fasting insulin; HOMA-IR: homeostasis model assessment-insulin resistance index; ISI: insulin sensitivity index; CRP: C reactive protein.
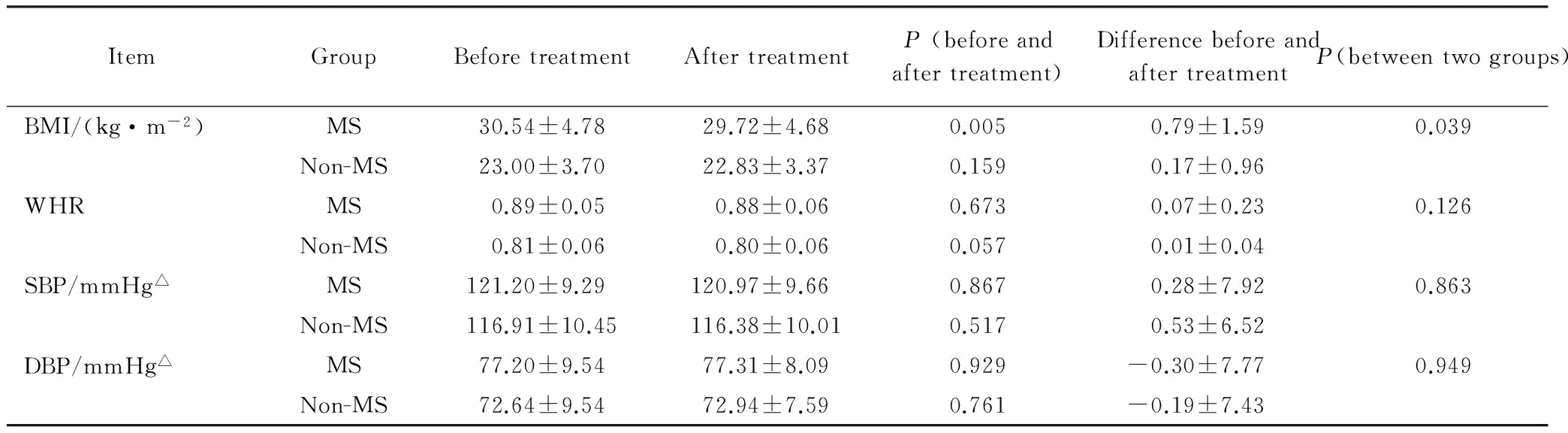
表2 治疗前后人体测量指标的比较
△1 mmHg=0.133kPa; MS:metabolic syndrome; BMI: body mass index; WHR: waist-hip ratio; SBP: systolic blood pressure; DBP: diastolic blood pressure.

表3 治疗前后早卵泡期激素浓度比较
LH: luteinizing hormone; FSH: follicle stimulating hormone; T: testosterone;MS:metabolic syndrome.
2.4治疗前后糖、脂代谢及炎性反应指标的比较
经过3个月的治疗,MS组TC轻度下降,但差异无统计学意义(P>0.05),而非MS组TC显著升高(P=0.054);两组治疗后TG均有显著升高,MS组升高幅度较大,两组间升高幅度差异有统计学意义(P<0.05);MS组HDL-C在治疗后略有上升,而非MS组显著升高,组间比较差异无统计学意义(P>0.05);MS组LDL-C均有轻度下降,非MS组则略有上升,组间比较差异有统计学意义(P>0.05)。两组Apo AI均显著上升,但变化幅度差异无统计学意义(P>0.05);Apo B均有上升,非MS组上升较显著,差异无统计学意义(P>0.05)。MS组空腹血糖显著下降,而非MS显著上升,两组差异有统计学意义(P>0.05)。MS组空腹胰岛素水平轻度下降,非MS组轻度上升,但两组间差异无统计学意义(P>0.05),其余指标在治疗前后及变化幅度差异均无统计学意义(P>0.05),详见表4。

表4 治疗前后糖、脂代谢及炎性反应指标的比较
TC: total cholesterol; TG: triglyceride; HDL-C: high density lipoprotein-cholesterol; LDL-C: low density lipoprotein-cholesterol; Apo AI: apolipoprotein AI; Apo B: apolipoprotein B; Lp(a): lipoprotein a; FPG: fasting plasma glucose; FINS: fasting insulin; HOMA-IR: homeostasis model assessment-insulin resistance index; ISI: insulin sensitivity index; CRP: C reactive protein;MS:metabolic syndrome.
3 讨论
代谢综合征以中心性肥胖(腰围增大)、高血压、高三酰甘油血症、低高密度脂蛋白血症和糖耐量减低为主要临床表现[3],越来越多的研究[4]显示,PCOS患者在较年轻时即表现出MS的临床特征。达英-35是治疗PCOS的常用药物,在降低雄激素、调整月经周期等方面有显著疗效,而达英-35对糖脂代谢的作用是否有益一直存在争议。因此本研究对有代谢紊乱倾向、尤其是已存在MS的PCOS人群进行观察,讨论如下。
3.1PCOS与MS
本研究共纳入100名PCOS患者,36名同时存在MS,与前述研究结果基本一致[5]。本研究结果显示,除MS的5项诊断指标外,MS组在BMI、空腹胰岛素、HOMA-IR同样高于对照组,而ISI低于对照组,反映了胰岛素抵抗(insulin resistance,IR)为发病的关键环节;PCOS患者大多数存在高雄激素血症,不仅导致排卵障碍,同时介导MS的发展,主要表现为加重中心性肥胖和IR。过多雄激素推动中心性肥胖和内脏脂肪沉积的发展,后两者又促进雄激素的产生,形成恶性循环。C反应蛋白(C reactive protein, CRP)是反映急性炎性反应的敏感指标,介导炎性反应的进展。研究显示,无论采用NIH标准或鹿特丹标准,PCOS患者CRP均高于正常人群[5]。通常认为,CRP升高被认为是心血管事件的危险因素,本研究MS组CRP明显高于非MS组,进一步证实MS组的心血管风险增加。
3.2达英-35对人体测量学指标的影响
口服避孕药(combined oral contraceptives, COC)最常见的不良反应之一是增重,也是许多PCOS患者停止服药的原因。相关假说认为,增重的原因是由于液体潴留和脂肪沉积,达英-35中的EE可发挥类盐皮质激素的作用,导致水钠潴留。雌激素促进皮下脂肪沉积,此外,口服避孕药还可通过影响饱腹感和增加食欲促进食物摄取[6]。但有研究[7-8]认为,达英-35并不导致体质量增加,甚至使体质量下降。Gallo等[6]对报道COC的相关文献进行研究认为,由于各种因素不能得到控制,目前可获得的资料不能说明COC促进体质量增加。
本研究显示,在达英-35治疗3个月后,MS组BMI显著降低,而非MS无明显变化,组间差异有统计学意义(P<0.05)。说明对于PCOS伴有MS患者,达英-35可使BMI减轻,而不影响非MS患者的体质量指数。由于腰围和血压是MS的诊断指标之一,因此,MS组的WHR和血压显著高于非MS组,达英-35对腰臀比和血压无不良影响。
3.3达英-35对激素的影响
PCOS以卵巢功能障碍为主要特征,主要原因为,卵巢对下丘脑分泌的促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)反应性减弱,使得LH脉冲频率和幅度增强;低浓度的黄体酮更加促进GnRH的脉冲分泌,导致LH/FSH比值增加,相对增加的LH刺激卵泡膜细胞分泌更多的雄激素。FSH调节卵泡颗粒细胞的芳香化酶活性,而FSH合成和分泌的相对不足导致卵泡发育障碍和芳香化酶浓度降低,使得雄激素前体物质转化为雌激素减少,最终导致卵巢雄激素分泌增加[9]。本研究中两组患者雄激素浓度均增高,尤以MS组为著。有研究[10]表明,肥胖PCOS女性的雄激素浓度高于非肥胖患者,在本研究中也得到了证实。
目前广泛采用的鹿特丹标准未将LH和LH/FSH纳入诊断标准,但日本妇产科学会[9]认为PCOS的LH和LH/FSH普遍增高,国内也有研究[11]支持这一理论。本研究中MS组LH/FSH略低于非MS组,差异无统计学意义(P>0.05)。研究[10]显示,LH/FSH在肥胖PCOS女性显著低于非肥胖PCOS女性,但在PCOS总体是升高的,而正常女性LH/FSH则不会升高。
经过达英-35治疗后,两组睾酮水平和LH/FSH均显著下降,与Wu等[12]的研究结果一致。这是因为达英-35中的EE能够抑制LH和卵巢雄激素分泌,EE能够增强肝脏合成性激素结合球蛋白,降低游离睾酮;而CPA有较强的孕激素活性,能够作用于雄激素受体,抑制睾酮及其活性产物——5α双清睾酮与雄激素受体结合,增加雄激素的代谢清除率,降低其生物效应[13-14]。因此,达英-35是降低雄激素,改善多毛、痤疮和调节月经的一线药物,广泛用于加拿大、墨西哥和欧洲。
3.4达英-35对糖、脂代谢的影响
PCOS普遍存在胰岛素抵抗,是2型糖尿病的高风险人群,口服避孕药对糖代谢的影响一直存在争议。有研究[7,9]显示COC会胰岛素抵抗、糖耐量血脂谱产生不良反应;而另有研究[15]表明达英-35可改善胰岛素敏感性(insulin sensitivity, SI),不引起糖耐量的改变[15];Vrbíková等[16]认为SI降低不是口服避孕药的必然结果,因为对于非肥胖PCOS患者其作用是中性的,SI是否降低与肥胖程度有关,且现有的研究大多未排除混杂因素的影响;一篇Meta分析[17]研究了COC与代谢改变的关系,认为二者不存在相关性。本研究显示,经过3个月治疗后,空腹血糖在MS组下降,而非MS组升高,组间比较差异有统计学意义(P<0.05)。空腹胰岛素、HOMA-IR和SI在治疗前后无明显改变,说明达英-35对糖代谢的总体作用是中性的,虽可使非MS患者的血糖浓度升高,但仍在正常范围内,能够降低合并MS的PCOS患者的血糖浓度。
关于达英-35对血脂的作用,目前也没有一致的研究结果。相关假说认为,达英-35中的EE可以升高HDL,但这种作用又可被CPA所拮抗,因此对HDL总的效应并不明显[16]。而Karabulut等[18]认为除HDL-C外,单用达英-35会造成血脂谱朝不利的方向发展。Jing等[19]的研究显示达英-35仅使TG升高,不造成其他血脂谱的改变,因此认为其恶化脂代谢的证据不充分。Meta分析显示当BMI>30 kg/m2时,口服避孕药升高HDL-C的作用更显著;此外,COC可升高TG,且当服用时间超过6个月时,这种作用更显著,但并未达到使胰腺炎风险增加的水平;对TC、LDL-C不造成影响[20-22]。本研究结果显示,经过治疗后两组TG均有明显升高,以MS组更显著;MS组TC、LDL-C、Lp(a)轻度下降,HDL-C升高,差异无统计学意义(P>0.05),非MS组TC、HDL-C显著升高,差异有统计学意义(P>0.05),LDL-C轻度升高,Lp(a)略有降低,差异无统计学意义(P>0.05)。Lp(a)是预测心血管疾病风险的指标,Lp(a)增高提示心血管疾病风险增高。以上结果显示了达英-35除使TG升高外,使抗动脉粥样硬化的保护性脂蛋白升高,心血管疾病风险降低,对于MS患者使致动脉粥样硬化的危险脂蛋白降低,TC降低,总的来说不使PCOS患者的脂代谢向不利方向发展。
因此,对于治疗PCOS,达英-35能够调整月经周期,改善高雄激素状态,不使PCOS的糖脂代谢朝不利方向发展。在治疗过程中,除药物治疗外,还应注重配合饮食和运动,以期达到更好的疗效。
[1] Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome(PCOS)[J]. Hum Reprod, 2004, 19(1): 41-47.
[2]Alberti K G, Zimmet P, Shaw J. et al. The metabolic syndrome—a new worldwide definition[J]. Lancet, 2005, 366(9491): 1059-1062.
[3]Alberti KGMM, Eckel R H, Grundy S M, et al. Harmonizing the metabolic syndrome: a joint interim statement of the international diabetes federation task force on epidemiology and prevention; national heart, lung, and blood institute; american heart association; world heart federation; international atherosclerosis society; and international association for the study of obesity[J]. Circulation, 2009, 120(16): 1640-1645.
[4]Bil E, Dilbaz B, Cirik D A. Metabolic syndrome and metabolic risk profile according to polycystic ovary syndrome phenotype[J]. J Obstet Gynaecol Res, 2016,42(7):837-843.
[5]Kelly C C, Lyall H, Petrie JR, e t al. Low grade chronic inflammation in women with polycystic ovarian syndrome[J]. J Clin Endocrinol Metab, 2001,86(6):2453-2435.
[6]Gallo M F, Lopez L M, Grimes D A, et al. Combination contraceptives: effects on weight[J]. Cochrane Database Syst Rev, 2014, 29(1):CD003987.
[7]Orbetsova M, Kamenov Z, Kolarov G, et al. Effect of 6-month treatment with oral antiandrogen alone and in combination with insulin sensitizers on body composition, hormonal and metabolic parameters in women with polycystic ovary syndrome (PCOS) in order to determine therapeutic strategy[J]. Akush Gimekol: sotilia, 2006,45(7):16-28.[8]Wu H, Ruan X, Jin J, et al. Metabolic profile of Diane-35 versus Diane-35 plus metformin in Chinese PCOS women under standardized life-style changes[J]. Gynecol Endocrinol, 2015, 31(7):548-551.
[9]Trikudanathan S. Polycystic ovarian syndrome[J]. Med Clin North Am, 2015, 99(1):221-235.
[10]Hsu M I, Liou T H, Liang S J, et al. Inappropriate gonadotropin secretion in polycystic ovary syndrome[J]. Fertil Steril, 2009, 91(4):1168-1174.
[11]马从顺,林芸,张春晖,等. 血清黄体生成素与卵泡刺激素比值对卵巢多囊样改变患者确诊多囊卵巢综合征的价值[J]. 中华妇产科杂志, 2011, 49(3): 177-181.
[12]Wu J, Zhu Y, Jiang Y, et al. Effects of metformin and ethinyl estradiol-cyproterone acetate on clinical, endocrine and metabolic factors in women with polycystic ovary syndrome[J]. Gynecol Endocrinol, 2008, 24(7):392-398.
[13]陈雪梅. 不同药物预处理多囊卵巢综合征并不孕患者的疗效及副反应分析[J]. 实用医学杂志, 2011,27 (15): 2830-2832.
[14]Ehrmann D A. Polycystic ovary syndrome[J]. N Engl J Med, 2005, 352(12):1223-1236.
[15]Cagnacci A, Paoletti A M, Renzi A, et al. Glucose metabolism and insulin resistance in women with polycystic ovary syndrome during therapy with oral contraceptives containing cyproterone acetate or desogestrel[J]. J Clin Endocrinol Metab, 2003,88(8):3621-3625.
[16]Vrbíková J, Cibula D. Combined oral contraceptives in the treatment of polycystic ovary syndrome[J]. Hum Reprod Update, 2005,11(3):277-291.
[17]Halperin I J, Kumar S S, Stroup D F. The association between the combined oral contraceptive pill and insulin resistance, dysglycemia and dyslipidemia in women with polycystic ovary syndrome: a systematic review and meta-analysis of observational studies[J]. Hum Reprod, 2011, 26(1):191-201.
[18]Karabulut A, Demirlenk S, Sevket O. Effects of ethinyl estradiol-cyproterone acetate treatment on metabolic syndrome, fat distribution and carotid intima media thickness in polycystic ovary syndrome[J]. Gynecol Endocrinol, 2012,28(4):245-248.
[19]Jing Z, Liang-Zhi X, Tai-Xiang W, et al. The effects of Diane-35 and metformin in treatment of polycystic ovary syndrome: An updated systematic review[J]. Gynecol Endocrinol, 2008, 24(10):590-600.
[20]武红琴,阮祥燕,卢永军,等. 综合管理下达英-35与达英-35联合二甲双胍治疗多囊卵巢综合征的疗效研究[J]. 首都医科大学学报, 2014,35(4):407-413.
[21]卢永军,阮祥燕,田玄玄,等. 多囊卵巢综合征综合治疗疗效的评价[J]. 首都医科大学学报,2013,34(4):525-529.
[22]杨颖,王金敏,彭书苹,等. 肥胖型多囊卵巢综合征患者临床特征分析[J]. 中国煤炭工业医学杂志, 2014,17(9) :1453-1455.
编辑慕萌
Effects of Diane-35 on the glucose and lipid metabolism in patients with polycystic ovary syndrome
Li Yanglu1, Ruan Xiangyan1,2*, Zhao Yue1, Du Juan1, Wang Lijuan1, Cui Yamei1, Alfred O. Mueck1,2
(1.DepartmentofEndocrinology,BeijingObstetricsandGynecologyHospital,CapitalMedicalUniversity,Beijing100026,China; 2.SectionofEndocrinologyandMenopause,DepartmentofWomen’sHealth,UniversityofTubingen,TubingenD-72076,Germany)
ObjectiveTo observe the effects of Diane-35 on polycystic ovary syndrome (PCOS), and to investigate its influence on hormone, glucose and lipid metabolism in PCOS patients. MethodsTotally 100 patients diagnosed as PCOS were divided into two groups, metabolic syndrome (MS) group (n=64) and non-MS group (n=36), according to the MS criteria formulated by International Diabetes Federation (IDF). Hormone level and parameters of glucose and lipid metabolism were detected and compared between the two groups before and after treatment by Diane-35 for 3 months. ResultsThe body mass index decreased significantly after treatment in MS group, while no obvious change in non-MS group. The serum testosterone and LH/FSH decreased in both groups (P<0.05). The total cholesterol in MS group slightly decreased, but increased significantly in non-MS group. The triglyceride in both groups increased significantly, especially in MS group, and the difference between the groups was statistically significant. HDL-C increased in both group, but only increased significantly in non-MS group (P<0.05). LDL-C decreased in MS group and increased in non-MS group without statistical difference, but the difference of between the groups was statistically significant. Fasting glucose decreased in MS group and increased in non-MS group significantly, and the difference between the groups was statistically significant. Fasting insulin decreased in MS group and increased in non-MS group without significant difference, and the difference between the groups was not significant. ConclusionDiane-35 can modify the menstrual cycle, and improve the hyperandrogenism such as hirsutism and acne, and do not deteriorate the glucose and lipid metabolism. PCOS treatment should combine diane-35 with diet and exercise, helping PCOS patients achieving the best effect.
polycystic ovary syndrome; metabolic syndrome; Diane-35; glucose and lipid metabolism
北京市自然科学基金(Y161011),北京市卫生系统高层次卫生技术人才(2014-2-016),国家外国专家局2016年度北京市引进国外技术、管理人才项目(高外端)(20161100031),首都医科大学附属北京妇产医院,北京妇幼保健院学科带头人项目(2013-1)。This study was supported by Natural Science Foundation Beijing(Y161011); Beijing Municipality Health Technology High-level Talent (2014-2-016); Foreign Technical and Administrative Talent Introduction Project in 2016,State Administration of Foreign Experts Affairs, the P. R. of China(20161100031); Project of Discipline Leader, Beijing Obstetrics and Gynecology Hospital, Capital Medical University, Beijing Maternal and Child Health Care Hospital(2013-1).
10.3969/j.issn.1006-7795.2016.04.003]
R711.75
2016-06-15)
*Corresponding author, E-mail:ruanxiangyan@163.com
网络出版时间:2016-07-2021∶12网络出版地址:http://www.cnki.net/kcms/detail/11.3662.r.20160714.2112.018.html

