Photoshop软件联合超声内镜在胃间质瘤不同侵袭危险性分级中的应用*
周羽翙,卢光荣,蔡振寨,汪青青,夏宣平,金健威,徐昌隆,薛战雄(.温州医科大学附属第二医院 消化内科,浙江 温州 5000;.温州医科大学附属第二医院,浙江 温州 5000;. 温州医科大学附属第一医院 消化内科,浙江 温州 5000)
论 著
Photoshop软件联合超声内镜在胃间质瘤不同侵袭危险性分级中的应用*
周羽翙1,卢光荣1,蔡振寨1,汪青青2,夏宣平1,金健威3,徐昌隆1,薛战雄1
(1.温州医科大学附属第二医院 消化内科,浙江 温州 325000;2.温州医科大学附属第二医院,浙江 温州 325000;3. 温州医科大学附属第一医院 消化内科,浙江 温州 325000)
目的 探讨Photoshop软件联合超声内镜(EUS)对胃间质瘤(GISTs)不同侵袭危险性分级的应用价值。方法 选取经病理及免疫组化确诊的GISTs患者97例,根据其肿瘤大小、核分裂象及肿瘤破溃分为极低危组、低危组、中危组以及高危组,利用Photoshop软件分别测定各组病灶EUS图像的灰度平均值(代表回声强度)及灰度标准偏差平均值(代表回声均匀度),行统计学分析,寻找各组差异。结果 不同侵袭危险性GISTs EUS图像有时肉眼难以鉴别;极低危、低危、中危及高危组EUS图像的灰度平均值(代表回声强度)分别为(56.54±6.10)、(59.20±7.51)、(77.77±10.90)和(83.43±12.47),极低危组与低危组比较、中危组与高危组比较,差异无统计学意义(P >0.05),其余各组两两比较,差异均有统计学意义(P <0.05);极低危、低危、中危及高危组的灰度标准偏差平均值(代表回声均匀度)分别为(8.46±2.59)、(12.57±5.89)、(12.84±4.15)、(16.69±4.69),除低危组与中危组比较差异无统计学意义外(P >0.05),其余各组两两比较,差异均有统计学意义(P <0.05)。结论 GISTs侵袭危险性越高,EUS回声强度总体上越高,而回声均匀性总体上越差,EUS联合Photoshop软件分析EUS图像的灰度平均值和灰度标准偏差可在术前辅助判断GISTs侵袭危险性。
胃间质瘤;超声内镜;Photoshop软件;灰度平均值;灰度标准偏差
胃间质瘤(gastrointestinal stromal tumors,GISTs)是消化系统常见的间叶组织肿瘤,大约占胃肠道肿瘤的60%~70%[1],是上消化道最常见的非上皮性肿瘤。目前多数学者认为GISTs均潜在恶性,不能简单地以良恶性划分,而是应进行侵袭危险性的分级。JOENSUU等[2]联合肿瘤大小、核分裂象、肿瘤原发部位及肿瘤破溃将GISTs侵袭危险性分为极低危、低危、中危和高危,但该分级因素之一核分裂象获得多依赖于肿瘤活检或术后切除的组织病理。超声内镜(endoscopic ultrasound,EUS)目前已成为消化道黏膜下隆起性病变的首选检查,本研究利用Photoshop软件(简称PS软件)对经病理、免疫组化确诊的不同侵袭危险性的GISTs超声图像进行处理分析,测定其灰度平均值(代表回声强度)及灰度标准偏差平均值(代表回声均匀度),并寻找其中差异,以期为日后临床工作中术前评估胃间质瘤侵袭危险性提供新的方法。
1 资料与方法
1.1一般资料
选取2004年11月-2015年4月就诊于温州医科大学附属第一医院、温州医科大学附属第二医院的因胃黏膜下隆起性病变行EUS检查的患者,其中行外科手术或内镜下切除治疗经病理、免疫组化检查确诊为GISTs 97例。根据肿瘤大小、核分裂象及肿瘤破溃将其分为极低危组、低危组、中危组以及高危组。极低危组22例,男12例,女10例,年龄37~75岁,平均61.7岁;低危组33例,男16例,女17例,年龄30~89岁,平均62.8岁;中危组27例,男14例,女13例,年龄38~79岁,平均62.4岁;高危组15例,男7例,女8例,年龄34~87岁,平均63.1岁。4组间性别及年龄差异无统计学意义(P >0.05)。
1.2器械
EUS主机型号为Olympus EU-M2000,MAJ-935超声探头驱动器,Olympus UM 2R、UM 3R超声探头,Olympus GIF-Q260J内镜。
1.3研究方法
所有超声图像均在相同的频率下(9 Hz)采集并以JPEG格式保存。每例均选取最清晰的超声图像1张(尽量排除伪影干扰,所得图像均由同一人分析处理,未告知其病理结果),利用Photoshop CS2 9.0软件中套索工具沿着病灶轮廓选定测定区间,测定其灰度平均值及灰度标准偏差。为减少误差,每张选定图片灰度平均值及灰度标准偏差各测定5次,然后取其平均值。
1.4统计学方法
本研究采用SPSS 19.0软件进行数据统计学分析。以Q_Q图行正态性检验,组间比较采用单因素方差分析及LSD-t检验。Origin 8.5软件绘制数据相似图。P <0.05时认为差异有统计学意义。
2 结果
97例GISTs患者EUS下表现为低回声团块,来源于黏膜肌层或固有肌层,向腔内或腔外突出。不同侵袭危险性GISTs EUS图像有时肉眼难以鉴别,见附表、图1和2。极低危、低危、中危及高危组EUS图像的灰度平均值(代表回声强度)分别为(56.54±6.10)、(59.20±7.51)、(77.77±10.90)和(83.43±12.47),极低危组与低危组比较、中危组与高危组比较,差异无统计学意义,其余各组两两比较,差异均有统计学意义(图3);如图4所示,极低危、低危、中危及高危组的灰度标准偏差平均值(代表回声均匀度)分别为(8.46±2.59)、(12.57±5.89)、(12.84±4.15)和(16.69±4.69),除低危组与中危组比较差异无统计学意义外,其余各组两两比较,差异均有统计学意义。因此,利用Photoshop软件分析超声图像可发现不同侵袭危险性GISTs之间的差异,中/高危组的图像回声强度高于极低/低危组,极低危组病灶回声最均匀,高危组回声均匀性最差,但低、中危组间无明显差异。
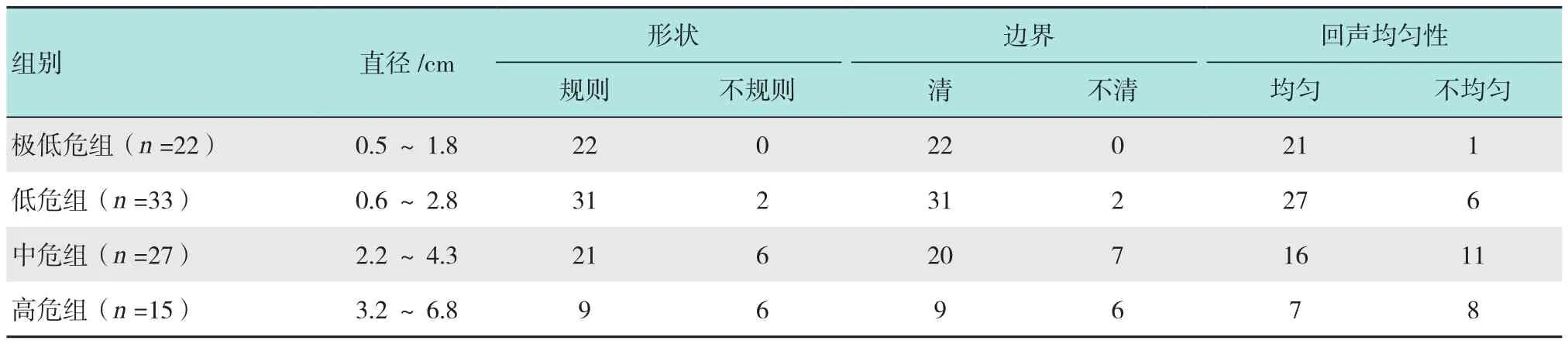
附表 不同侵袭危险性GISTs EUS表现
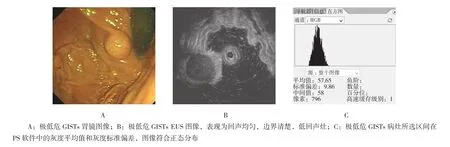
图1 极低危GISTs图像及PS软件灰度处理结果
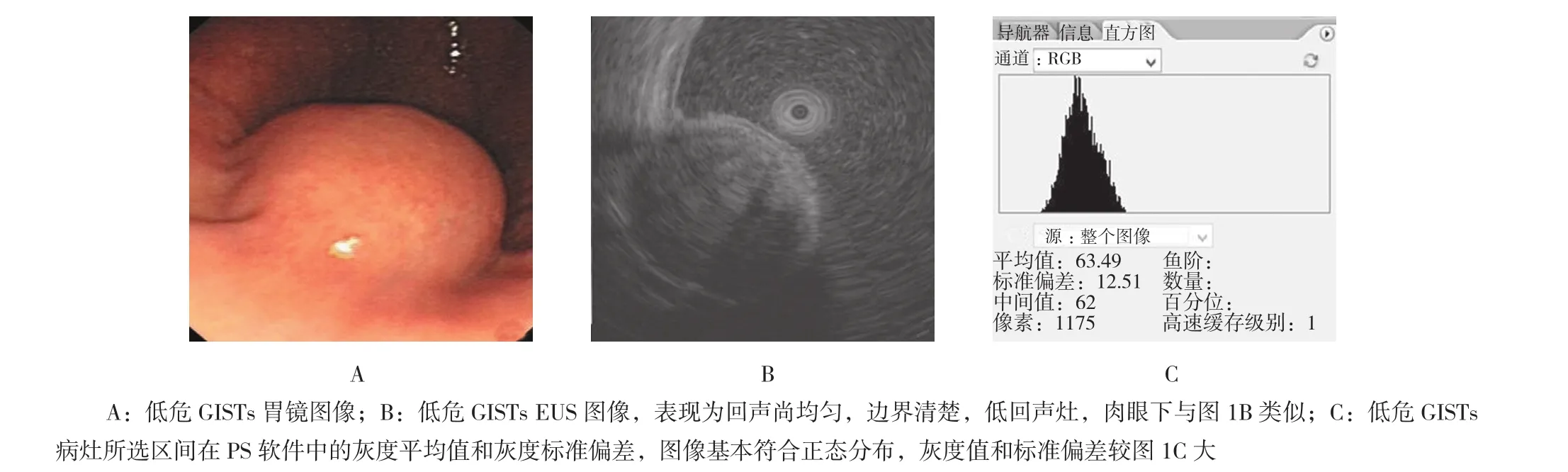
图2 低危GISTs图像及PS软件灰度处理结果

图3 GISTs不同侵袭危险性各组灰度平均值比较
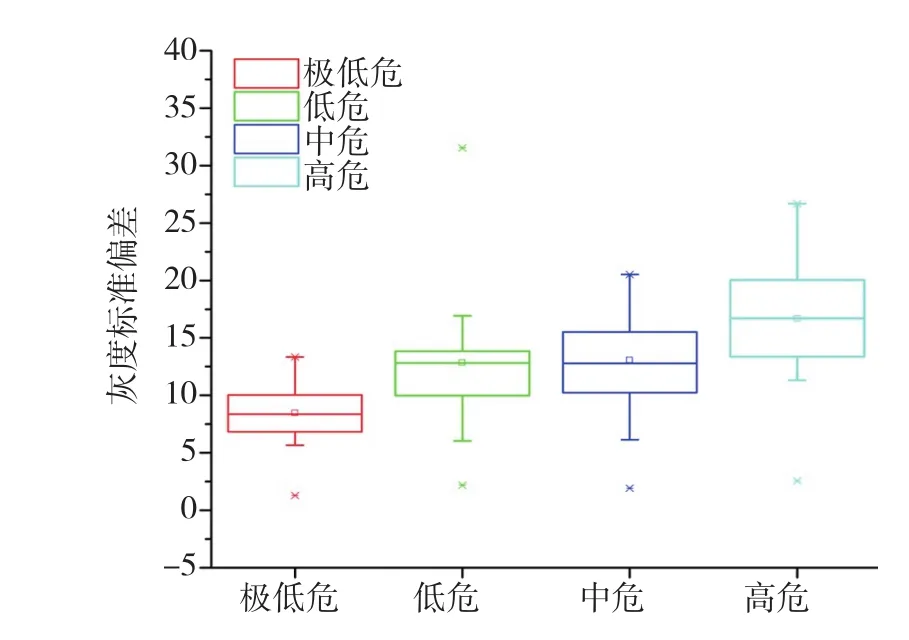
图4 GISTs不同侵袭危险性各组灰度标准偏差平均值比较
3 讨论
GISTs是消化系统最常见的间叶组织源性肿瘤,主要发生于胃和小肠,其中GISTs约占60%~70%[1]。有学者曾根据肿瘤大小及核分裂象将GISTs分为良性、恶性及交界性[3],但随后研究发现即使体积很小(< 2 cm)、核分裂象很低(<5/50高倍视野)的GISTs也偶见转移或复发[4]。因此,目前多数学者认为GISTs具有一定的恶性潜能,以侵袭危险性评估其生物学行为更为合理。目前,国际上采用JOENSUU等[2]在2008年提出的危险度分级系统,即联合肿瘤大小、核分裂象、原发肿瘤部位及肿瘤破溃情况将GISTs侵袭危险性分为极低危、低危、中危和高危,侵袭危险性越高,存活率越低[1]。目前认为极低度侵袭危险性GISTs可选择内镜下随访,而低度、中度、高度侵袭危险性GISTs则建议内镜下切除或外科手术治疗。因此,GISTs侵袭危险性的分级对进一步的治疗及疾病的预后存在着一定的指导意义。由于普通内镜下活检常难以取到病变组织,再加上有一定的危险性,GISTs推荐术前常规活检,故术前核分裂象难以获得,GISTs侵袭危险性较难在术前予以准确评估。
EUS兼具内镜的直观性与超声的穿透性,因其能清晰显示病变的起源层次、大小、形状、边界、回声特点和有无浸润征象等[5],已成为消化道黏膜下隆起性病变的首选检查。有国内外研究显示,EUS有助于术前判断GISTs的侵袭危险性。PALAZZO等[6]研究发现肿瘤直径< 3 cm,边界整齐,回声均匀是低度恶性特征;肿瘤直径> 4 cm,表面有溃疡,回声不均匀伴囊腔,形状不规则且突出于腔壁,周围浸润是高度恶性特征,如果上述特征具备2种及以上则诊断敏感性可达80%以上。王晓凡等[7]将38例GISTs患者的EUS图像依据侵袭危险性评分标准进行分级,并与术后病理分级结果进行比较,其中EUS下中度侵袭危险性分级不足2例,高度侵袭危险性分级不足3例,符合率约79%。此结果与国外学者RÖSCH[8]和CHAK[9]等研究结果相似。由此看来,EUS对于GISTs术前侵袭危险性评估有其局限性,根本原因为EUS对病灶回声的强度、均匀性判断无具体量化值,对极其相似的超声图像肉眼下难以区分,诊断存在经验水平论、主观性强的缺点[10]。
Photoshop软件是Adobe公司开发的图像处理软件,主要处理以像素所构成的数字图像。EUS图像是一种二维灰阶图像,图像里面包含着丰富的灰度信息,灰度值反映着图像黑-灰-白的变化(回声强度),图像越黑,其灰度值越小,由该软件分析EUS图像,可以提供具体的灰度量化值。TUMA等[11]利用Photoshop软件分析肾脏超声图像的平均灰度值及灰度标准差成功鉴别肾实质病变,为充分利用超声图像的信息提供了实例。国内钱燕敏[12]和卢光荣等[13]分别利用Photoshop软件予以辅助鉴别食管颗粒细胞瘤与食管间质瘤,GISTs与胃平滑肌瘤,两者在灰度平均值或灰度标准偏差平均值上存在差异。由此看来,利用Photoshop软件分析超声图像对鉴别不同病变及指导进一步治疗具有一定的价值。本研究利用Photoshop软件对不同侵袭危险性的GISTs EUS图像进行灰度值分析发现:侵袭危险性越高,图像回声强度总体上越高,图像回声均匀性总体上越差。此结果基本与PALAZZO等[6]研究结果符合。但本研究存在一定局限性,尽管采集图像时尽量排除伪影干扰,但仍难以避免干扰的存在;此外不同的医师在不同的EUS下采集的图像必然存在一定的差异,但若由同一医师在同一型号EUS下规范化采集图像,虽然其灰度值会有轻微变化,但比较两种疾病灰度值差异的结果以及EUS图像变化的总体趋势还是可靠的。考虑到这点,为减少误差,本研究由同一医师操作相同型号的EUS采集最清晰的图像,由不同的研究人员反复测其灰度平均值和灰度标准偏差。另外,本研究中GISTs病例不多,结果是否稳定仍需大样本量进行研究。
综上所述,EUS联合Photoshop软件分析EUS图像的灰度平均值和灰度标准偏差可在术前辅助判断GISTs侵袭危险性,至于EUS联合Photoshop软件对GISTs侵袭危险性分级的诊断准确率,有待继续收集大样本并结合病理以及免疫组化进一步行前瞻性研究。
[1] MIETTINEN M, SOBIN L H, LASOTA J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical,and molecular genetic study of 1765 cases with long-term followup[J]. Am J Surg Pathol, 2005, 29(1): 52-68.
[2] JOENSUU H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J]. Hum Pathol, 2008, 39(10): 1411-1419.
[3] MIETTINEN M, FURLONG M, SARLOMO-RIKALA M, et al. Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the rectum and anus: a clinicopathologic,immunohistochemical, and molecular genetic study of 144 cases[J]. Am J Surg Pathol, 2001, 25(9): 1121-1133.
[4] KIM I H, KWAK S G, CHAE H D. Prognostic factors of patients with gastric gastrointestinal stromal tumor after curative resection: a retrospective analysis of 406 consecutive cases in a multicenter study[J]. Eur Surq Res, 2015, 55(1-2): 12-23.
[5] 刘锦涛, 余细球,侯华军, 等. 超声内镜对内镜治疗上消化道病变的治疗价值[J]. 中国内镜杂志, 2008, 14(3): 243-245.
[6] PALAZZO L, LANDI B, CELLIER C, et al. Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours[J]. Gut, 2000, 46(1): 89-92.
[7] 王晓凡, 谭诗云, 李明, 等. 术前超声内镜检查对胃间质瘤危险性判断及治疗方式选择分析[J].中华全科医师杂志, 2014,13(6): 452-456.
[8] RÖSCH T, LORENZ R, DANCYGIER H, et al. Endosonographic diagnosis of submucosal upper gastrointestinal tract tumors[J]. Scand J Gastroenterol, 1992, 27(1): 1-8.
[9] CHAK A, CANTO M I, RÖSCH T, et al. Endosonographic differentiation of benign and malignant stromal cell tumors[J]. Gastrointest Endosc, 1997, 45(6): 468-473.
[10] HOTEYA S, LIZUKA T, KIKUEHI D, et al. Benefits of endoscopic submucosal dissection according to size and location of gastric neoplasm , compared with conventional mucosal resection[J]. J Gastroenteral Hepatol, 2009, 24(6): 1102-1106.
[11] TUMA J, NOVAKOVA B, SCHWARZENBACH H R, et al. Image analysis in the differential diagnosis of renal parenchyma lesions[J]. Ultraschall in der Medizin, 2011, 32(3): 286-292.
[12] 钱燕敏, 许国强, 陈洪潭, 等. 食管颗粒细胞瘤超声内镜图像的计算机分析研究[J]. 中华消化杂志, 2013, 33(4): 223-225.
[13] 卢光荣, 金健威, 叶晓华, 等. PhotoShop软件对胃间质瘤和胃平滑肌瘤内镜超声图像的鉴别价值[J]. 胃肠病学, 2014,19(9): 537-539.
(曾文军 编辑)
Photoshop combined with Endoscopic Ultrasonography in grading invasive risk of gastric stromal tumors*
Yu-hui Zhou1, Guang-rong Lu1, Zhen-zhai Cai1, Qing-qing Wang2, Xuan-ping Xia1,Jian-wei Jin3, Chang-long Xu1, Zhan-xiong Xue1
(1.Department of Gastroenterology, the Second Affi liated Hospital of Wenzhou Medical University,Wenzhou, Zhejiang 325000, China; 2.The Second Affi liated Hospital of Wenzhou Medical University,Wenzhou, Zhejiang 325000, China; 3.Department of Gastroenterology, the First Affi liated Hospital of Wenzhou Medical University, Wenzhou, Zhejiang 325000, China)
Objective To investigate the application value of Photoshop in grading invasive risk of gastric stromal tumors (GSTs). Methods EUS image of 97 cases of GSTs confirmed by pathological and immunohistochemical examination were collected. GSTs were divided into four groups (very low risk, low risk,intermediate risk, high risk) by tumor size, mitotic count and rupture of tumor. Mean gray value (intensity of echo)and gray value standard deviation (uniformity of echo) of EUS images of the lesions were determined by Photoshop and then the differences of each group were found by statistical analysis. Results It is diffi cult to differentiate EUS images of GSTs from each group by visual observation. The mean gray value of EUS image of very low risk group,low risk group, intermediate risk group and high risk group of GSTs respectively were (56.54 ± 6.10), (59.20 ± 7.51),(77.77 ± 10.90) and (83.43 ± 12.47). There was no signifi cant difference between very low risk group and low risk group (P > 0.05). There was no signifi cant difference between intermediate risk group and high risk group (P > 0.05). In addition, the others all had signifi cantly different from that of each group (P < 0.05). The mean gray value standard deviation of EUS image of very low risk group, low risk group, intermediate risk group and high risk group of GSTs respectively were (8.46 ± 2.59), (12.57 ± 5.89), (12.84 ± 4.15) and (16.69 ± 4.69). There was no signifi cant difference between low risk group and intermediate risk group (P > 0.05). In addition, the others all had signifi cantly different from that of each group (P < 0.05). Conclusions The higher risk of GSTs, the higher of echo intensity and the worse of echo uniformity under EUS. Photoshop combined with EUS is helpful for differentiating different risk of GSTs by analyzing mean gray value and gray value standard deviation of the lesions.
gastric gastrointestinal stromal tumors; endoscopic ultrasound; Photoshop; mean gray value; mean gray value standard deviation
R735.2
A
10.3969/j.issn.1007-1989.2016.08.005
1007-1989(2016)08-0020-05
2016-03-02
温州市公益性科技计划项目(No:Y20140511);2015温州医科大学附属第二医院院内科研项目(No:2015-09:04)
卢光荣,E-mail:luguangrong1987@163.com

