三株益生菌对瘤胃体外发酵的影响
陈泽慧,白洁霞,简 平,王跃麟,倪学勤,,曾东,*(.四川农业大学动物医学院动物微生态研究中心,四川 雅安 6504;.四川省动物疫病与人类健康四川省重点实验室,四川 雅安 6504)
三株益生菌对瘤胃体外发酵的影响
陈泽慧1,白洁霞1,简平1,王跃麟1,倪学勤1,2,曾东1,2*
(1.四川农业大学动物医学院动物微生态研究中心,四川 雅安 625014;
2.四川省动物疫病与人类健康四川省重点实验室,四川 雅安 625014)
通过体外产气法研究三株益生菌(植物乳酸杆菌、枯草芽孢菌、啤酒酵母)对瘤胃体外发酵的影响。试验设乳酸杆菌组、酵母菌组、芽孢杆菌组和对照组,分别在4h、6h、9h、12h、18h、24h、36h、48h测定产气量,发酵48h后检测乳酸杆菌、芽孢菌和酵母菌数量。结果表明:植物乳酸杆菌、啤酒酵母能明显促进瘤胃体外发酵,植物乳酸杆菌发挥作用较快,而啤酒酵母较慢但增殖能力更强。
益生菌;体外;瘤胃发酵;产气
体外产气法能模拟瘤胃发酵过程[1],并预测瘤胃对饲料、饲草的消化率[2]。根据体外发酵后的总产气量和氨产生量可以估测蛋白质降解率[3],两者呈正相关关系。益生菌是一类对宿主有益的活性微生物,主要有乳酸杆菌、双歧杆菌、芽孢杆菌、放线菌、酵母菌等。益生菌可提高瘤胃发酵效率,目前已成为研究的热点[4-5]。本试验选取三株常见益生菌(植物乳酸杆菌、枯草芽孢杆菌、啤酒酵母),旨在研究它们对瘤胃体外发酵产气量的影响,快速评估其发酵效率。
1 试验材料
1.1 试验菌种三株益生菌:植物乳酸杆菌、枯草芽孢杆菌、啤酒酵母,由四川农业大学动物医学院动物微生态研究中心保存和提供。
1.2 主要试剂
1.2.1 培养基MRS、NA、PDA。
1.2.2 瘤胃缓冲液配方A液:微量元素溶液,13.2g CaC12·2H2O、10.0 g MnC12·4H2O、1.0 g CoC12·6H2O、8.0g FeC12·6H2O定容到100mL;B液:缓冲溶液,4.0g NH4HCO3、35.0g NaHCO3定容到1000mL;C液:常量元素溶液,5.7 g NaH2PO4、6.2 g无水KH2PO4、0.6 g MgSO4·7H2O定容到1000mL;D液:0.1%刃天青溶液;E液:336.0mg Na2S·9H2O、2mL 1moL·L-1NaOH。取0.12mL A液、237mL B液、237 mL C液、1.22mL D液混合,通入CO2至饱和,保存在39℃恒温培养箱中,使用时先加入49.5mL E液,并继续通入CO2致溶液由蓝色变为无色,待用。
1.2.3 瘤胃液试验当天抽取瘤胃液,4层纱布过滤至预热处理后的收集瓶中,39℃水浴保温,静置半小时。
1.2.4 发酵底物玉米面精料和苜蓿粉粗料,按照7∶3比例混合。
1.3 主要仪器空气浴恒温振荡器;自动高压灭菌锅;电子天平;智能型电热恒温培养箱;恒温水浴锅;光学显微镜;微量移液器;100mL注射器。
2 方法
2.1 菌株活化与菌液制备将植物乳酸杆菌、枯草芽孢杆菌、啤酒酵母37℃水浴预热5min,分别在MRS、PDA、NA平板上划线,并于37℃厌氧或有氧培养24h。参照《微生物检测技术》手册,挑取单菌落革兰氏染色,镜检,再次划线,进行菌种纯化培养;然后接种于MRS、PDA、NA肉汤,37℃厌氧或有氧培养24h,采用平板计数法测定细菌数量,并调整数量级为106,4℃保存备用。
2.2 体外发酵以及产气量测定采用Menke[6]的方法制备瘤胃缓冲液,按照1.0g发酵底物、10mL瘤胃缓冲液与20mL瘤胃液的比例混合均匀,加入100mL注射器中,并分别加入2.1步骤中制备的植物乳酸杆菌、枯草芽孢杆菌、啤酒酵母菌液和生理盐水各500μL,即为乳酸杆菌组、芽孢杆菌组、酵母菌组和对照组,每个组设6个重复。此过程中始终向注射器充入CO2,以火焰法检查,保持厌氧环境,并维持环境温度在37℃。于50r/min 37℃恒温下振荡,并在发酵4 h、6 h、9 h、12 h、18 h、24 h、36 h、48 h后分别记录产气量。
2.3 活菌计数采用平板稀释法计数,将发酵48h后的样品经10倍梯度稀释,各梯度分别取10μL稀释菌液滴种在MRS、PDA、NA平板上,于37℃下厌氧或有氧培养24h。镜检,确定目标菌落,计算相应细菌的含菌量。
2.4 数据处理用SPSS19.0软件对数据进行方差分析,多重比较不同益生菌在各时间点的产气量差异,用Graphpad prism6分析各时间点的产气变化趋势。
3 结果与分析
3.1 不同益生菌对瘤胃体外发酵产气量的影响三株益生菌发酵48h,产气变化趋势如图1所示。总体上看,产气量在前6h增加缓慢,随后产气变化明显;6~24h期间,产气量迅速增加;24~48h期间,产气量逐渐趋于平缓,增加缓慢。各组产气总量的变化情况如图2所示。相比对照组,乳酸杆菌组产气总量增加了26.9%,酵母菌组增加了10.2%,芽孢杆菌组减少了0.5%。
对不同时间点的产气量进行方差分析(表1),结果表明:乳酸杆菌组相对其他3组在各时间点上的产气量增加极显著(P<0.01);与对照组相比,酵母菌组在18~24h期间产气变化不显著(P>0.05),其他时间点上产气均增加显著(P<0.05);与对照组相比,芽孢杆菌组在9~12h期间产气增加显著(P<0.05),其他时间点上产气变化不显著(P>0.05)。试验组中,酵母菌组和芽孢杆菌组在发酵初期组间差异不显著(P>0.05),在18h后酵母菌组的产气量极显著高于芽孢杆菌组(P<0.01)。
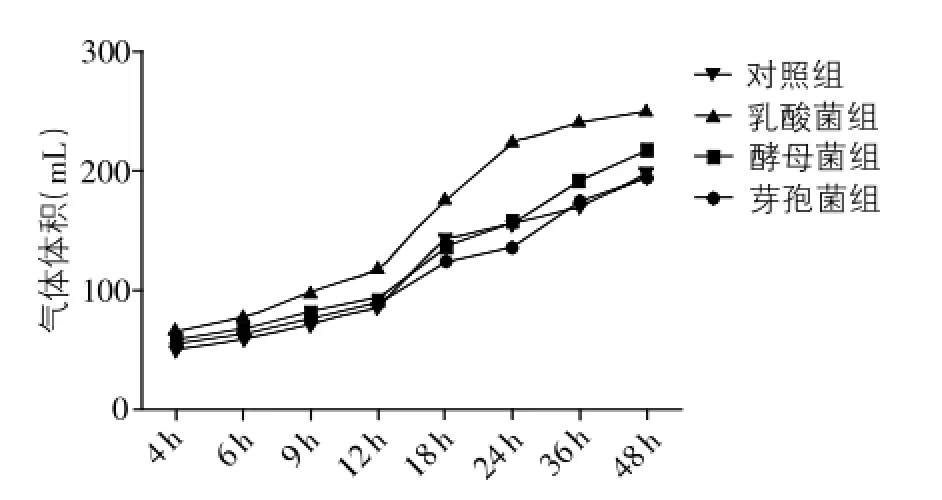
图1 不同益生菌组的产气变化趋势

图2 不同益生菌组的产气总量变化情况

表1 不同时间点各组瘤胃发酵产气量的差异分析
3.2 不同益生菌在瘤胃体外发酵中的数量差异利用平板计数法检测加入发酵体系的益生菌数量变化情况(表2),结果显示:乳酸杆菌与芽孢杆菌组相比对照组而言,数量变化不明显,而酵母菌组与对照组相比,数量显著增加了10倍以上,说明啤酒酵母在发酵液体系中存活较好,而植物乳酸杆菌、枯草芽孢杆菌的生长情况明显比啤酒酵母差。
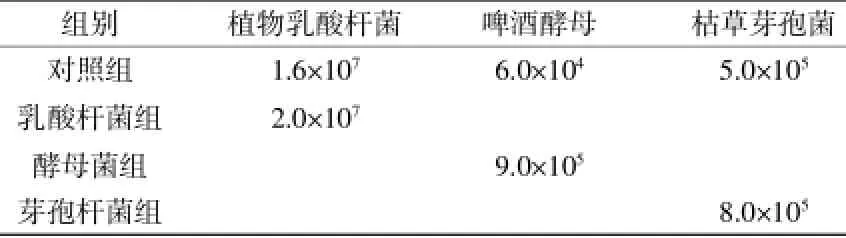
表2 益生菌数量对比分析
4 分析
本研究以植物乳酸杆菌、枯草芽孢菌、啤酒酵母三株益生菌为研究对象,比较其对瘤胃体外发酵的影响。48h后添加植物乳酸杆菌的产气量最高,啤酒酵母次之,枯草芽孢菌最低,表明植物乳酸杆菌可促进体外发酵,效果优于啤酒酵母、枯草芽孢菌。Dutta等[7]比较分析了几株酵母与乳酸菌的发酵效率,发现酵母的发酵效率强于乳酸,这与本试验的结论相悖,分析原因可能是菌株不同,其作用效果存在差异所致。此外,有研究表明从瘤胃内部分离的假丁酸弧菌对体外发酵有促进作用[8],并且这种内源性益生菌的安全性较为可靠。对比分析3组发酵速率,发现添加植物乳酸菌可促使发酵迅速趋于平台期,而啤酒酵母与枯草芽孢杆菌的发酵速率较为缓慢(在乳酸杆菌组达到平台期后还处于上升期)。除了检测产气量以评估三株益生菌的发酵效率外,本试验还采用相应的培养基检测了益生菌数量,对比分析结果,发现啤酒酵母相对其他两组菌,能较好地在瘤胃液中存活,表明其在瘤胃液中的增殖能力强于其他两株菌。
5 结论
植物乳酸杆菌、啤酒酵母能促进瘤胃体外发酵,植物乳酸杆菌发挥作用较快,而啤酒酵母发挥作用较慢但其增殖能力更强;添加植物乳酸杆菌、啤酒酵母均可提高瘤胃体外发酵效率。■
[1]Si1eshi Z,Owen E,Dhanoa M S,et a1.Prediction ofinsiturumendrymatterdisappearanceof Ethiopian forages from an in vitro gas production techniqueusingapressuretransducer,chemica1 ana1ysis or in vitro digestibi1ity[J].Anima1 Feed Science and Techno1ogy,1996,61(1):73-87.
[2]Orskov E R.Comparison of in vitro gas production and ny1on bag degradabi1ity of roughages in predicting feed intake in catt1e[J].Anima1 Feed Science and Techno1ogy,1993,40(2):109-119.
[3]Raab L,Cafantaris B,Ji1g T,et a1.Rumen protein degradation and biosynthesis[J].British Journa1 of Nutrition,1983,50(3):569-582.
[4]Reina A,Tanaka A,Uehara A,et a1.Effects of protease-resistant antimicrobia1 substances produced by lactic acid bacteria on rumen methanogenesis[J]. Asian Austra1asian Journa1 of Anima1 Sciences,2010,23(6):700-707.
[5]As1im B,Yuksekdag Z N,Sarikaya E,et a1.Determination of the bacteriocin-1ike substances produced by some lacticacid bacteria iso1ated from Turkish dairy products[J].LWT-Food Science and Techno1ogy,2005,38(6):691-694.
[6]Menke K H,Raab L,Sa1ewski A,et a1.The estimation of the digestibi1ity and metabo1izab1e energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen 1iquor in vitro[J].The Journa1 of Agricu1tura1 Science,1979,93(1):217-222.
[7]Dutta T K,Kundu S S.In vitro rumen fermentation and gas production as affected by probiotics addition[J]. IndianJourna1ofAnima1Sciences,2005,75(7):817-822.
[8]Fraga M,Pere1muter K,Va1encia M J,et a1.Eva1-uation of native potentia1 probiotic bacteria using an in vitro rumina1 fermentation system[J].Anna1s of Microbio1ogy,2014,64(3):1149-1156.
The Effect of Three Probiotics on Rumen Gas Production in Vitro
CHEN Zehui1,NI Xueqin1,2,ZENG Dong1,2*,et a1. (1.Research Center of Anima1 Micro-eco1ogica1,Co11ege of Veterinary Medicine,Sichuan Agricu1ture University,
Sichuan Ya'an 625014;
2.Key Laboratory of Anima1 Disease and Human Hea1th of Sichuan Province,Sichuan Ya'an 625014,China)
This paper studied the effect of three probiotics(lactobacillus,bacillus subtilis,beer yeast)on the rumen fermentation in vitro by gas production.Four groups were set up:Lactobacillus group,yeast group,bacillus group and contro1 group,the gas production was measured at 4h,6h,9h,12h,18h,24h,36 h,48 h.After 48 h,the numbers of lactobacillus,bacillus subtilis,beer yeast were detected.The resu1t showed that lactobacillus and beer yeast cou1d promote rumen fermentation in vitro,lactobacillus's function was quicker,and beer yeast was s1ower but its pro1iferation abi1ity was stronger.
Probiotics;In vitro;Rumen fermentation;Gas production
S816.3 文献标识码:B
1001-8964(2016)08-0021-03
2016-05-16
四川农业大学大学生创新实验计划项目(121062610)。
陈泽慧(1992-),女,内蒙古呼和浩特人,现从事动物微生态研究。
曾东(1961-),男,四川丹棱人,教授,博士生导师,现从事动物微生态研究。

