页岩黏土矿物CH4/CO2吸附规律的分子模拟
隋宏光, 姚 军
( 中国石油大学(华东) 石油工程学院,山东 青岛 266580 )
页岩黏土矿物CH4/CO2吸附规律的分子模拟
隋宏光, 姚军
( 中国石油大学(华东) 石油工程学院,山东 青岛266580 )
CH4和CO2在页岩黏土矿物中的吸附行为对页岩气的开采和CO2的封存具有重要意义。选取黏土矿物的主要成分蒙脱石为研究对象,构建层状裂缝型孔隙的分子模型,采用巨正则系综蒙特卡洛(GCMC)方法和分子动力学(MD)方法,在不同压力、不同温度条件下,研究不同狭缝孔隙宽度CH4和CO2气体的吸附行为,同时分析离子交换结构对吸附的影响。结果表明:CH4吸附符合Langmuir吸附规律,可以采用Langmuir方程进行拟合。随着温度的升高两种气体吸附量减小,随着压力的增大而增大;蒙脱石的离子交换结构对CH4的吸附影响较小,但促进对CO2的吸附;不同的狭缝孔隙宽度对应CH4和CO2的赋存状态不同,蒙脱石的离子交换结构影响CO2的赋存状态;平均作用势说明吸附层中分子间结合能力大于游离层,吸附态是CH4和CO2在蒙脱石狭缝中的主要赋存形式之一。基于CH4和CO2在页岩黏土矿物中的吸附规律,可为页岩气的勘探开发提供依据。
CH4; CO2; 蒙脱石; 吸附; 分子模拟
0 引言
随着清洁能源需求的增加,对页岩气藏的开发有重要意义[1-4]。页岩气是以甲烷为主要成分的混合气体,含有少量的乙烷、丙烷等,主要以游离态、吸附态赋存在页岩气藏中,还有少量的溶解态,其中吸附态占20%~85%(体积分数)[5]。页岩气藏的吸附特性对页岩气的储量计算[6-7]、开采方案制定,以及开采过程中纳米孔隙的渗流机理和后期的产能预测具有指导意义。
页岩气藏主要由黏土矿物和有机质组成,有机质对页岩气有较强的吸附能力,有机质的含量对研究页岩气的储量有重要意义[8-10]。页岩中不仅有吸附能力较强的有机质,还有与有机质相似、含有大量的微纳孔隙、对页岩气有较好吸附和储存能力的黏土矿物[11-13],黏土矿物主要由蒙脱石、伊利石和高岭石等组成,有大量发育的比表面可为页岩气提供吸附存储空间[14],其中蒙脱石对甲烷的吸附能力最强[15]。近年来,人们研究黏土矿物对CH4及CO2/CH4混合气体的吸附行为[14,16-20]。Titiloye J O等[21]采用分子模拟方法,从微观尺度分析CH4在钾基蒙脱石狭缝中的吸附行为、赋存形式和运移机理,与钠基蒙脱石比较发现,甲烷在钾基蒙脱石吸附量较大,蒙脱石中钾离子更容易吸附在蒙脱石孔隙表面,且钠离子位于孔隙中间位置。Yang X等[20]采用分子动力学方法,分析CO2在不同宽度黏土孔隙中的吸附行为及扩散系数。Jin Z等[22]研究不同含水密度条件下CH4和CO2的吸附行为表明,水占据蒙脱石表面形成吸附水层,将明显减少CH4和CO2的吸附量。Sui H等[23]采用分子模拟方法,研究甲烷气体在钠基蒙脱石中的吸附扩散行为,发现在小于2.0 nm的狭缝中,甲烷以吸附态存在。
笔者采用巨正则系综蒙特卡洛方法(GCMC),并结合分子动力学方法(MD),在不同压力、不同温度下,模拟不同狭缝宽度CH4和CO2在蒙脱石孔隙中的吸附行为,研究蒙脱石对CH4和CO2的吸附性能,阐明CH4和CO2在蒙脱石中的吸附机理,计算CH4和CO2在页岩储层蒙脱石中不同埋深(压力)的吸附量,以及CH4和CO2在蒙脱石孔隙中的分布,确定可以利用CO2置换技术开采页岩气藏,为页岩气的勘探开发提供指导和基础数据。
1 模拟方法
1.1模型
蒙脱石的结构特征为2∶1晶型,单斜晶体系,晶胞参数为a=0.523 nm,b=0.906 nm,c=0.960 nm,β=99°,蒙脱石晶胞的分子式为Na0.75(Si7.75Al0.25)(Al3.5Mg0.5)O20(OH)4[18,24]。根据蒙脱石结构,采用32个蒙脱石晶胞构建模拟单元超晶包,x方向和y方向的尺寸为4.224 nm和3.656 nm。两种模型分别为无离子交换模型(叶腊石)和有离子交换模型(钠基蒙脱石),钠基蒙脱石构建方法为对无离子交换模型进行类质同相替代,模型中16个三价铝原子被二价镁原子替代,8个四价硅原子被三价铝原子替代,结构类质同象替换后产生层间电荷;再用24个一价钠原子平衡,使替代后的模型呈电中性,即构建钠基蒙脱石。模型构建完成后对它进行结构优化,优化后模型结构见图1,其中红色、白色、黄色、紫色、绿色和粉色球分别为氧原子、氢原子、硅原子、钠原子、镁原子和铝原子。由图1可以看出,结构优化后,钠离子位于蒙脱石孔隙中间位置。所有模型使用Materials Studio(MS)(Biovia Inc, San Diego, USA)软件的Amorphous Cell模块构建。
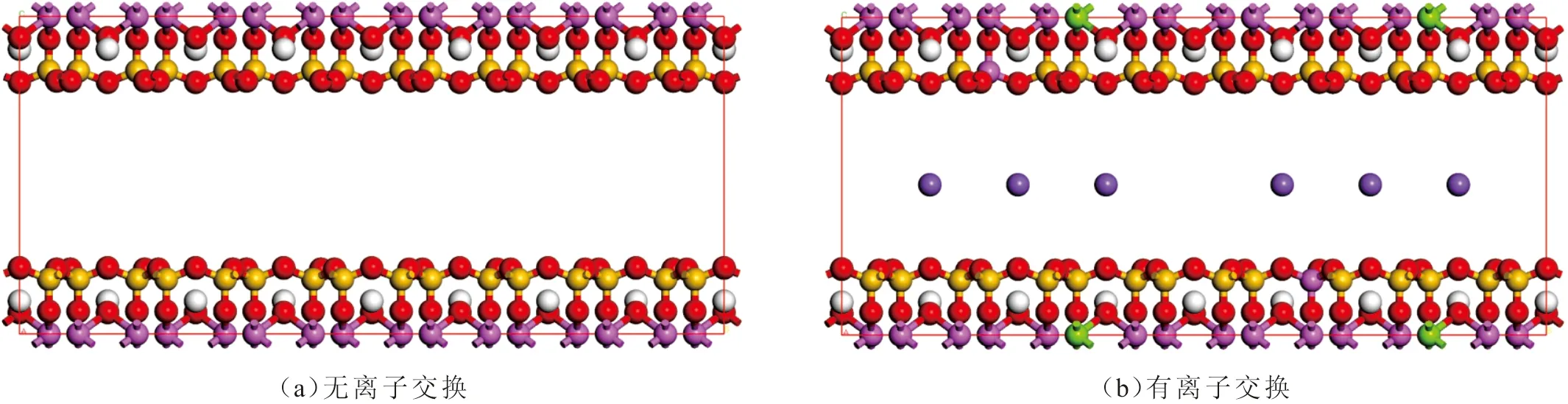
图1 蒙脱石模型Fig.1 Molecular simulation unit cell
1.2分子模拟方法
蒙特卡洛方法模拟计算采用MS软件包中Sorption模块。分子间的范德华力作用和静电力相互作用分别采用Atom和Ewald求和方法,模型体系采用周期性边界条件。每个循环包括4种尝试:(1)插入一个分子到模拟盒子中;(2)从模拟盒子中随机删除一个分子;(3)完全重生长一个分子;(4)移动一个分子,每种尝试的概率分别为0.4,0.2,0.2,0.2。每个数据点的前500×104步为吸附平衡阶段,后100×105步作为平衡后吸附量数据统计样本,力场选择CLAYFF力场[22],非键截断半径设置为 1.50 nm。模拟中用逸度代替压力模拟CH4和CO2的吸附,根据逸度系数计算逸度,逸度系数由Peng-Robinson方程[26]计算得到。采用Focite模块进行分子动力学方法模拟计算,力场与分子间作用力设置与蒙特卡罗方法相同。采用正则系综( NVT),利用Andersen热浴控温,进行1 ns的分子动力学运算,步长为1 fs,
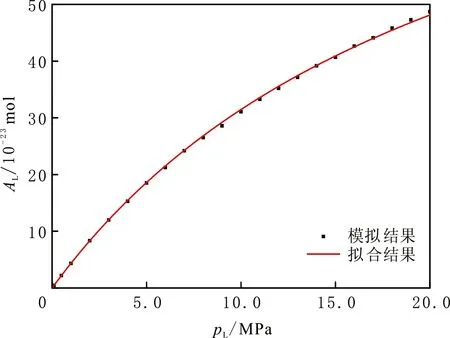
图2 CH4的等温吸附线及Langmuir公式拟合结果Fig.2 Adsorption isotherm and Langmuir equation fitting of CH4
其中前50×104步使体系达到平衡,后50×104步统计热力学性质。
2 结果与讨论
2.1CH4/CO2吸附等温线
在温度为298 K,压力由0.01 MPa增加到20.00 MPa时,CH4在4.0 nm无离子交换蒙脱石狭缝孔隙宽度的吸附等温线见图2。由图2可以看出,CH4在蒙脱石狭缝中的吸附等温线呈Ⅰ型Langmuir吸附,结果与文献[27]特征符合。对它采用Langmuir吸附公式[28]拟合
式中:A为吸附气含量;AL为Langmuir体积,代表最大吸附量;pL为Langmuir压力,为吸附量达到最大吸附量50%对应的压力;p为当前压力。根据Langmuir公式拟合可以得到:AL=107.99×10-23mol,pL=24.59 MPa,拟合程度R2>0.999 8,表明CH4在蒙脱石表面上的吸附符合Langmuir吸附规律。不同狭缝孔隙宽度的CH4在蒙脱石吸附Langmuir拟合结果见表1。

表1 CH4在蒙脱石吸附Langmuir拟合结果
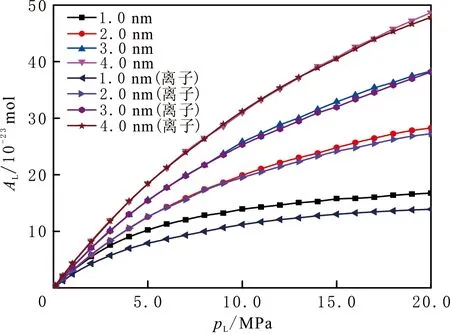
图3 CH4在1.0~4.0 nm蒙脱石狭缝孔隙宽度的吸附等温线Fig.3 Adsorption isotherm of methane in MMT with pore size of 1.0, 2.0, 3.0 and 4.0 nm
页岩中分布不同大小的孔隙,多数为纳米尺度。在温度为298 K,压力由0.01 MPa增加到20.00 MPa 时,CH4在1.0、2.0、3.0和4.0 nm蒙脱石狭缝孔隙宽度的吸附等温线见图3。由图3可以看出,随着孔隙变大,即可以容纳CH4分子的空间变大,绝对吸附量也随之变大。当孔隙宽度为1.0 nm时,蒙脱石狭缝中的钠离子对CH4吸附有较小的影响,随着孔隙变大,影响越来越小,表明钠离子的存在对CH4的吸附基本不起作用。这是由CH4分子的性质决定的,CH4为电中性分子,不存在产生偶极矩和四极矩[29]。较小狭缝孔隙宽度的影响是钠离子的存在占据吸附空间,而使吸附量变小。
在温度为298 K,压力由0.01 MPa增加到20.00 MPa时 ,CO2在1.0、2.0、3.0和4.0 nm蒙脱石狭缝孔隙宽度的吸附等温线见图4。由图4可以看出,钠离子对CO2的吸附影响较大,促进CO2的吸附,且在较小压力下可以达到吸附饱和状态。虽然CO2分子也为电中性,不产生偶极矩,但有较强的四极距[30],与钠离子有较强的相互作用。对比相同结构和条件下CH4和CO2的吸附,CO2的吸附量明显大于CH4的吸附量[31-32]。表明蒙脱石表面有利于CO2的储存,适合CO2的封存及页岩气的CO2驱的开采。
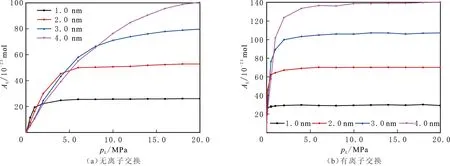
图4 CO2在1.0~4.0 nm蒙脱石狭缝孔隙宽度的吸附等温线Fig.4 Adsorption isotherm of CO2 in MMT with pore size of 1.0, 2.0, 3.0 and 4.0 nm
不同页岩气藏具有不同的地层深度,不同地层深度对应不同的地层温度,为研究温度对吸附的影响,对2.0 nm孔隙的模型分别模拟温度为298、340和380 K时的吸附等温线(见图5)。由图5可以看出,温度的升高导致吸附量下降,高温不利于CH4/CO2在蒙脱石上的吸附。这是因为温度的升高增加CH4和CO2分子的动能,使它不易被蒙脱石表面吸附,即对页岩气的加热也是一种有效的开采方式。

图5 温度为298、340和380 K时2.0 nm孔隙的吸附等温线Fig.5 Adsorption isotherms without cation exchange structure at temperatures of 298, 340 and 380 K in 2.0 nm pore
2.2CH4/CO2在黏土狭缝中的密度分布
有、无钠离子的黏土结构中CH4和CO2在压力为20.00 MPa,温度为298 K,狭缝孔隙宽度为1.0、2.0、3.0 nm和4.0 nm的密度分布曲线见图6-7。由图6-7可以看出,两种蒙脱石结构无论有、无离子交换,CO2的吸附量都大于CH4的吸附量,即黏土与CO2的相互作用更大。在有离子交换的蒙脱石结构中,CO2的吸附层密度较大,CH4的密度几乎没有变化,说明蒙脱石与CO2之间有范德华力和静电力的作用,而蒙脱石与CH4之间没有静电力的作用。比较不同结构不同狭缝孔隙宽度的两种气体密度分布还可
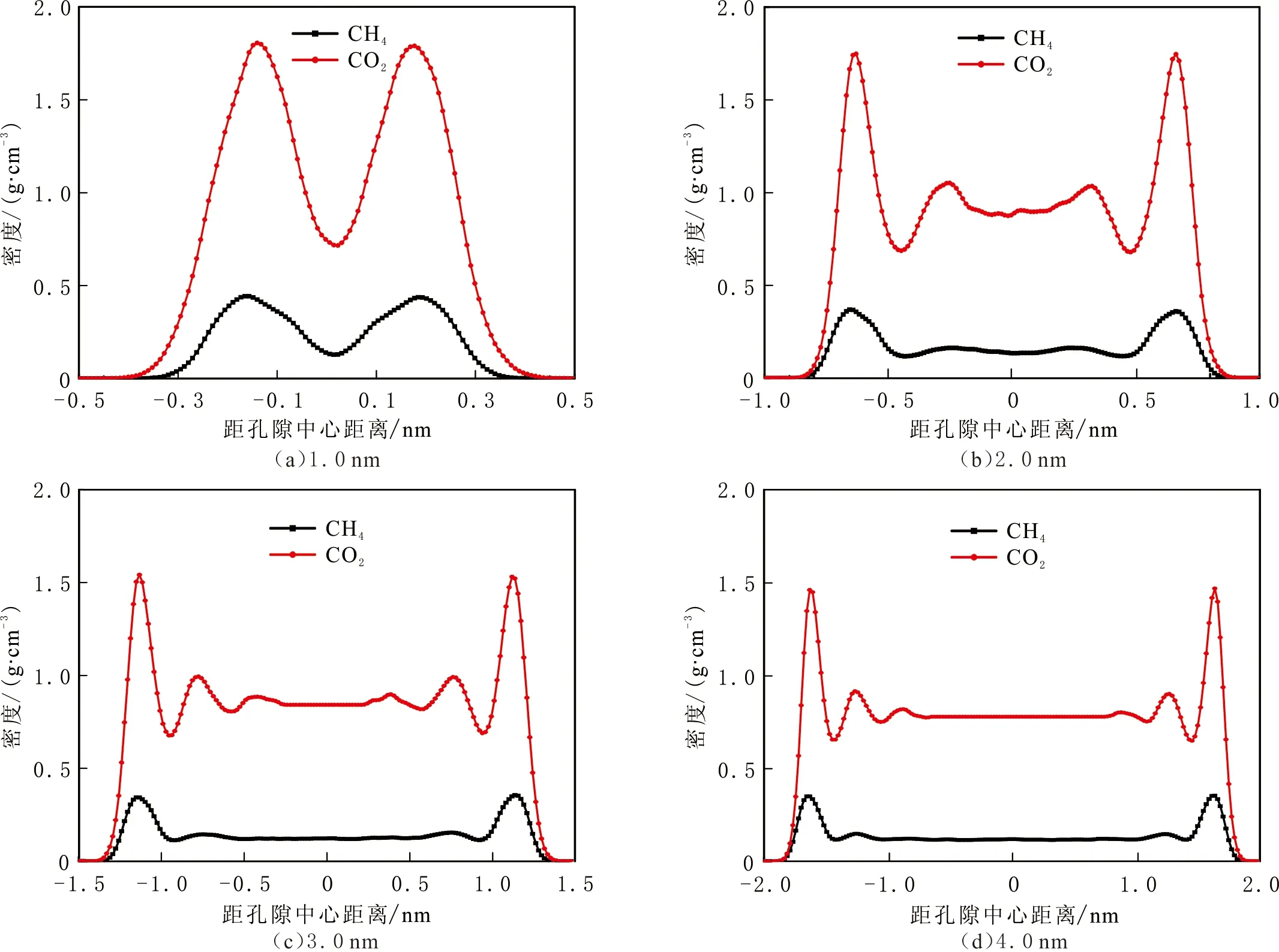
图6 CH4和CO2在无离子交换结构蒙脱石狭缝孔隙中的密度分布Fig.6 Density of CH4 and CO2 in MMT slit pores without cation exchange
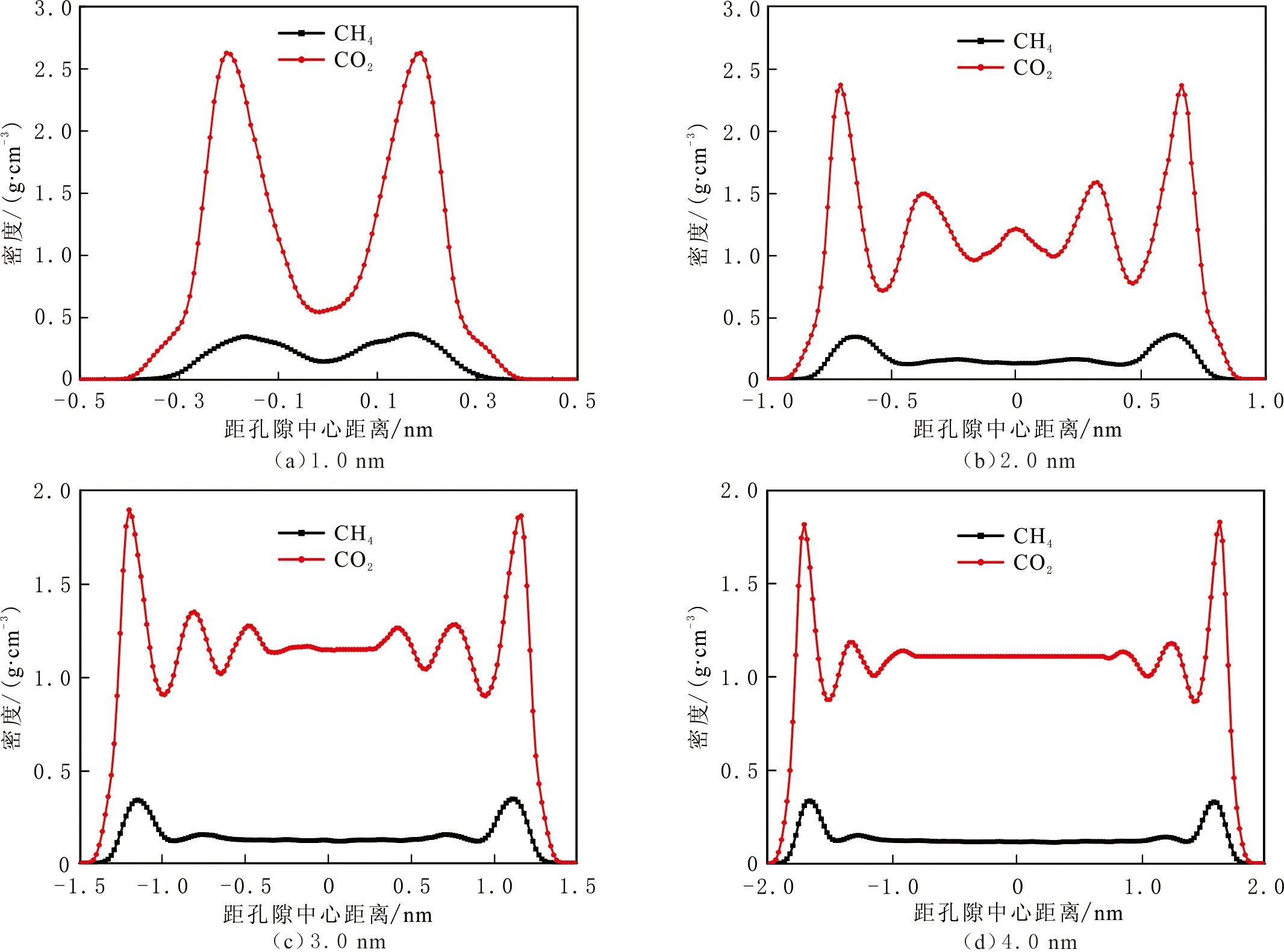
图7 CH4和CO2在有离子交换结构蒙脱石狭缝孔隙中的密度分布Fig.7 Density of CH4 and CO2 in MMT slit pores with cation exchange
以看出,在相同研究条件下,在小于1.0 nm的狭缝中,CH4和CO2气体以吸附态存在;在大于2.0 nm的狭缝中,CH4气体以吸附态和游离态共同存在。对于CO2气体,在无离子交换的蒙脱石结构中,在大于2.0 nm的狭缝中以吸附态和游离态共同存在;在有离子交换的蒙脱石结构中,在小于2.0 nm的狭缝中以吸附态存在。
2.3径向分布函数与平均作用势
分析CH4和CO2在蒙脱石狭缝孔隙中的微观结构特征,需要考虑径向分布函数(Radial Distribution Function,RDF)和平均作用势(Potentials of Mean Force,PMF)。径向分布函数是以某个参考原子为中心,在距其r(与参考原子间距离)处发现另一个原子的概率,它表示两个粒子之间在彼此空间占有的概率。平均作用势W体现成对粒子之间的结合能力,可根据两个粒子之间的径向分布函数计算得出[33-34]
W(r)=-kBTlng(r),
式中:kB为Bolzmann常数;T为系统的绝对温度;g(r)为径向分布函数。
蒙脱石狭缝的CH4和CO2分子中碳原子的径向分布函数见图8-9。由图8-9可以看出,两种蒙脱石结构中,CH4分子中碳原子的径向分布函数形状基本相同,出现一次明显的峰值,位于0.43 nm处,峰值大小随孔隙变大而减小。同样,CO2分子中碳原子的径向分布函数在两种蒙脱石结构中的形状也基本相同,但出现较为明显的两次峰值,无离子交换结构的峰值位于0.40 nm和0.75 nm处,有离子交换结构的峰值位于0.38 nm和0.72 nm处。表明不同的蒙脱石结构对CH4吸附影响较小,对CO2影响较大。
蒙脱石狭缝的CH4和CO2分子中碳原子的平均作用势见图10-11。由图10-11可以看出,在CO2吸附结构中,在0.39 nm和0.73 nm处出现两个粒子相接触极小势(Contact Minimum,CM)和分离极小势(Separated Minimum,SM),在CM与SM之间存在层障(Layer Barrier,LB),LB表明任意中心CO2分子周围存在不同的CO2分子层,分子层之间存在能垒。周围CO2进入中心CO2分子区域并与之发生作用,必须克服两层之间的层障(LB)。CO2克服能垒进入第一层与中心CO2形成粒子对,以及脱离第一分子层进入周围分子层中,这两个相反过程中CO2要克服的能垒并不相等(即分子层障能垒的顺、反方向不等)。分析PMF表明,CO2分子一旦由某些相互作用而形成紧密分布的吸附层,则吸附层中任一分子周围都形成不同的分子层,不同的分子为了处于更加稳定的状态而存在各自的第一分子层中,使吸附层更加稳定。在CH4的吸附结构中,在0.41 nm和0.81 nm处出现粒子接触极小势(CM),但趋势没有CO2吸附结构中明显,说明蒙脱石结构对CO2具有更强的作用,CO2形成的吸附层也更加稳定。
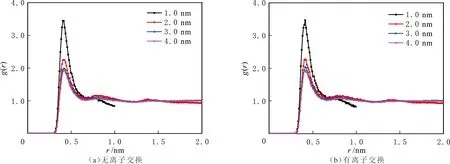
图8 不同蒙脱石狭缝宽度的CH4分子中碳原子的RDFFig.8 RDF between carbon atoms in CH4 in different width MMT pores
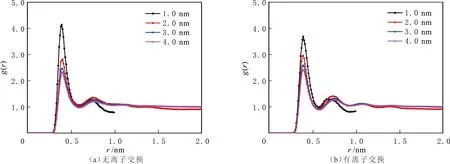
图9 不同蒙脱石狭缝宽度的CO2分子中碳原子的RDFFig.9 RDF between carbon atoms in CO2 in different width MMT pores
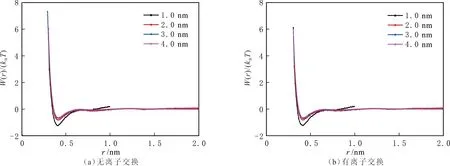
图10 不同蒙脱石狭缝宽度的CH4分子中碳原子的PMFFig.10 PMF between carbon atoms in CH4 in different width MMT pores
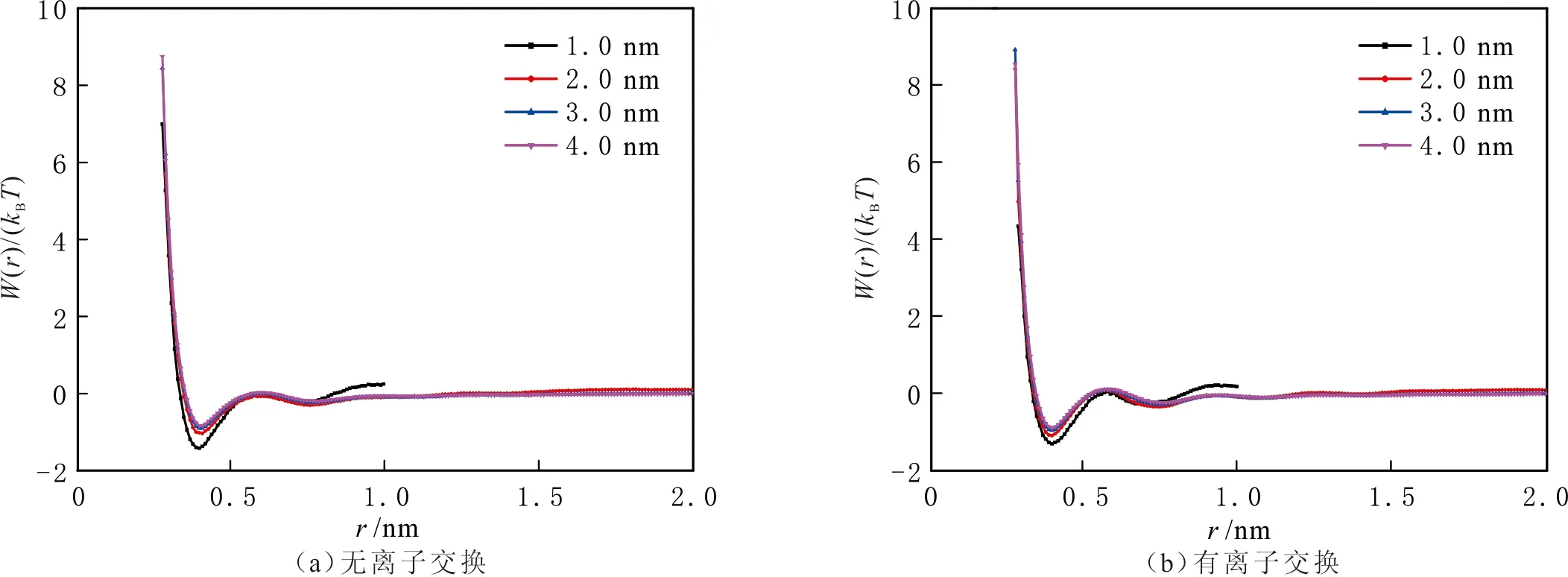
图11 不同蒙脱石狭缝宽度的CO2分子中碳原子的PMFFig.11 PMF between carbon atoms in CO2 in different width MMT pores
3 结论
(1)CH4在蒙脱石孔隙中的吸附符合Langmuir吸附规律,可以采用Langmuir方程进行拟合。CH4和CO2的吸附量随着温度的升高而减小,随着压力的增大而增大。
(2)离子交换的蒙脱石结构促进CO2的吸附,对CH4的吸附基本不起作用。
(3)在小于1.0 nm的蒙脱石狭缝中,CH4和CO2以吸附态存在;在大于2.0 nm的狭缝中CH4气体以吸附态和游离态共同存在。对于CO2气体,在无离子交换的蒙脱石结构中,在大于2.0 nm的狭缝中以吸附态和游离态共同存在;在有离子交换的蒙脱石结构中,在小于2.0 nm的狭缝中CO2气体以吸附态存在。
(4)由CH4和CO2分子间的平均作用势看出,它们各自吸附层中分子间结合能力大于游离层的,因此引起周围的分子向能量更低的吸附层聚集,形成稳定的吸附层,吸附态是一种更加稳定的CH4和CO2赋存状态。
[1]张金川,汪宗余,聂海宽,等.页岩气及其勘探研究意义[J].现代地质,2008,22(4):640-646.
Zhang Jinchuan, Wang Zongyu, Nie Haikuan, et al. Shale gas and its significance for exploration [J]. Geoscience, 2008,22(4):640-646.
[2]姚军,孙海,黄朝琴,等.页岩气藏开发中的关键力学问题 [J].中国科学:物理学 力学 天文学,2013,43(12):1527-1547.
Yao Jun, Sun Hai, Huang Zhaoqin, et al. Key mechanical problems in the development of shale gas reservoirs [J]. Scientia Sinica: Physica, Mechanica & Astronomica, 2013,43(12):1527-1547.
[3]胡文瑞.中国非常规天然气资源开发与利用[J].大庆石油学院学报,2010,34(5):9-16.
Hu Wenrui. Development and utilization of non-conventional natural gas resources in China [J]. Journal of Northeast Petroleum University, 2010,34(5):9-16.
[4]孙海,姚军,孙致学,等.页岩气数值模拟技术进展及展望 [J].油气地质与采收率,2012,19(1):46-49.
Sun Hai, Yao Jun, Sun Zhixue, et al. Recent development and prospect on numerical simulation of shale gas reserviors [J]. Petroleum Geology and Recovery Efficiency, 2012,19(1):46-49.
[5]Curtis J B. Fractured shale-gas systems [J]. AAPG Bulletin, 2002,86(11):1921-1938.
[6]Ambrose R J, Hartman R C C, Akkutlu I Y. Multi-component sorbed-phase considerations for shale gas-in-place calculations [C]. Oklahoma: SPE Production and Operations Symposium, 2011.
[7]Ross D J K, Marc Bustin R. The importance of shale composition and pore structure upon gas storage potential of shale gas reservoirs [J]. Marine and Petroleum Geology, 2009,26(6):916-927.
[8]杨镱婷,张金川,王香增,等.陆相页岩气的泥页岩评价——以延长下寺湾区上三叠统延长组长7段为例[J].东北石油大学学报,2012,36(4):10-17.
Yang Yiting, Zhang Jinchuan, Wang Xiangzeng, et al. Source rock evaluation of continental shale gas: A case study of Chang7 of Mesozoic Yanchang formation in Xiasiwan area of Yanchang [J]. Journal of Northeast Petroleum University, 2012,36(4):10-17.
[9]杨峰,宁正福,王庆,等.甲烷在页岩上吸附的热力学[J].中南大学学报:自然科学版,2014,45(8):2871-2877.
Yang Feng, Ning Zhengfu, Wang Qing, et al. Thermodynamic analysis of methane adsorption on gas shale [J]. Journal of Central South University: Science and Technology, 2014,45(8):2871-2877.
[10]吴逸豪,卢双舫,陈方文,等.泥页岩储层有机孔隙定量评价研究[J].特种油气藏,2015,22(5):65-68.
Wu Yihao, Lu Shuangfang, Chen Fangwen, et al. Quantitative characterization of organic pores in muddy shale reservoirs [J]. Special Oil and Gas Reservoirs, 2015,22(5):65-68.
[11]Schettler P D, Parmely C R. Contributions to total storage capacity in devonian shales [C]. Lexington: SPE Eastern Regional Meeting, 1991.
[12]Lu X C, Li F C, Watson A T. Adsorption studies of natural gas Storage in devonian shales [J]. SPE Formation Evaluation, 1995,10(2):109-113.
[13]吉利明,马向贤,夏燕青,等.黏土矿物甲烷吸附性能与微孔隙体积关系 [J].天然气地球科学,2014,25(2):141-152.
Ji Liming, Ma Xiangxian, Xia Yanqing, et al. Relationship between methane adsorption capacity of clay minerals and micropore volume [J]. Natural Gas Geoscience, 2014,25(2):141-152.
[14]Volzone C, Thompson J G, Melnitchenko A, et al. Selective gas adsorption by amorphous clay-mineral derivatives [J]. Clays and Clay Minerals, 1999,47(5):647-647.
[15]吉利明,邱军利,夏燕青,等.常见黏土矿物电镜扫描微孔隙特征与甲烷吸附性[J].石油学报,2012,33(2):249-256.
Ji Liming, Qiu Junli, Xia Yanqing, et al. Micro-pore characteristics and methane adsorption properties of common clay minerals by electron microscope scanning [J]. Acta Petrolei Sinica, 2012,33(2):249-256.
[16]吉利明,邱军利,张同伟,等.泥页岩主要黏土矿物组分甲烷吸附实验 [J].地球科学:中国地质大学学报,2012,37(5):1043-1050.
Ji Liming, Qiu Junli, Zhang Tongwei, et al. Experiments on methane adsorption of common clay minerals in shale [J]. Earth Science: Journal of China University of Geosciences, 2012,37(5):1043-1050.
[17]Ji L, Zhang T, Milliken K L, et al. Experimental investigation of main controls to methane adsorption in clay-rich rocks [J]. Applied Geochemistry, 2012,27(12):2533-2545.
[18]Jin Z, Firoozabadi A. Methane and carbon dioxide adsorption in clay-like slit pores by Monte Carlo simulations [J]. Fluid Phase Equilibria, 2013,360(0):456-465.
[19]Sharma A, Namsani S, Singh J K. Molecular simulation of shale gas adsorption and diffusion in inorganic nanopores [J]. Molecular Simulation, 2015,41(5-6):414-422.
[20]Yang X, Zhang C. Structure and diffusion behavior of dense carbon dioxide fluid in clay-like slit pores by molecular dynamics simulation [J]. Chemical Physics Letters, 2005,407(4):427-432.
[21]Titiloye J O, Skipper N T. Monte Carlo and molecular dynamics simulations of methane in potassium montmorillonite clay hydrates at elevated pressures and temperatures [J]. Journal of Colloid and Interface Science, 2005,282(2):422-427.
[22]Jin Z, Firoozabadi A. Effect of water on methane and carbon dioxide sorption in clay minerals by Monte Carlo simulations [J]. Fluid Phase Equilibria, 2014,382:10-20.
[23]Sui H, Yao J, Zhang L. Molecular simulation of shale gas adsorption and diffusion in clay nanopores [J]. Computation, 2015,3(4):678-700.
[24]Skipper N, Chang F R C, Sposito G. Monte Carlo simulation of interlayer molecular structure in swelling clay minerals. I: Methodology [J]. Clays and Clay Minerals, 1995,43(3):285-293.
[25]Cygan R T, Liang J J, Kalinichev A G. Molecular models of hydroxide, oxyhydroxide, and clay phases and the development of a general force field [J]. The Journal of Physical Chemistry B, 2004,108(4):1255-1266.
[26]Reid R C, Prausnitz J M, Poling B E. The properties of gases and liquids [M]. New York: McGraw Hill Book Co., 1987.
[27]Brunauer S, Deming L S, Deming W E, et al. On a theory of the van der waals adsorption of gases [J]. Journal of the American Chemical Society, 1940,62(7):1723-1732.
[28]Langmuir I. The adsorption of gases on plane surfaces of glass, mica and platinum [J]. Journal of the American Chemical Society, 1918,40(9):1361-403.
[29]Rallapalli P, Prasanth K P, Patil D, et al. Sorption studies of CO2, CH4, N2, CO, O2and Ar on nanoporous aluminum terephthalate [MIL-53(Al)] [J]. Journal of Porous Materials, 2011,18(2):205-210.
[30]Sylwester F, Artur P T, Piotr A G, et al. Can carbon surface oxidation shift the pore size distribution curve calculated from Ar, N2and CO2adsorption isotherms simulation results for a realistic carbon model [J]. Journal of Physics: Condensed Matter, 2009,21(31):1-10.
[31]李文华,房晓红,李彬,等.蒙脱石吸附CH4和CO2的分子模拟 [J]. 东北石油大学学报, 2014,38(3):25-30.
Li Wenhua, Fang Xiaohong, Li Bin, et al. Molecular simulation of the sorption of methane and carbon dioxide in the montmorillonite [J]. Journal of Northeast Petroleum University, 2014,38(3):25-30.
[32]Melnitchenko A, Thompson J G, Volzone C, et al. Selective gas adsorption by metal exchanged amorphous kaolinite derivatives [J]. Applied Clay Science, 2000,17(1-2):35-53.
[33]Song Q S, Guo X L, Yuan S L, et al. Molecular dynamics simulation of sodium dodecyl benzene sulfonate aggregation on silica surface [J]. Acta Physico-Chimica Sinica, 2009,25(6):1053-1058.
[34]Fujita T, Watanabe H, Tanaka S. Effects of salt addition on strength and dynamics of hydrophobic interactions [J]. Chemical Physics Letters, 2007,434(1-3):42-48.
2015-12-30;编辑:陆雅玲
国家自然科学基金项目(51234007,51490654,51504276);长江学者和创新团队发展计划项目(IRT1294)
隋宏光(1981-)男,博士研究生,主要从事油气渗流、页岩气藏存储方面的研究。
姚军,E-mail: rcogfr—upc@126.com
10.3969/j.issn.2095-4107.2016.02.012
O467;TE319
A
2095-4107(2016)02-0090-09

