电化学转化二氧化碳制备碳纳米材料及表征
吴红军, 李志达, 谷 笛, 邴国强, 纪德强, 刘 悦, 王宝辉
( 东北石油大学 化学化工学院,黑龙江 大庆 163318 )
电化学转化二氧化碳制备碳纳米材料及表征
吴红军, 李志达, 谷笛, 邴国强, 纪德强, 刘悦, 王宝辉
( 东北石油大学 化学化工学院,黑龙江 大庆163318 )
以Fe为阴极、Ni-Cr合金为阳极,在熔融碳酸盐电解质过程中,采用一步法电解CO2制备蜂窝状单质碳和碳纳米线。利用扫描电子显微镜(SEM)、X线衍射仪(XRD)、透射电子显微镜(TEM)、拉曼光谱仪(RAM)、比表面积测定仪(BET)及激光粒度仪等仪器,分别对碳纳米材料的形貌、晶型结构、比表面积和粒度进行表征。考察电解温度对单质碳形貌的影响,根据计算产碳质量与消耗电荷量的关系,确定最佳电解条件。结果表明:电解温度影响产物的整体形貌及产碳的电流效率,电解温度为850~900 K时获得的碳纳米材料形貌呈蜂窝状,电解温度为900~950 K时获得的碳纳米材料形貌呈线状。随着电解温度的升高,碳纳米材料的粒径逐渐增加,比表面积逐渐减小。产碳的电流效率随电解温度的升高而降低,在最优电解条件下,电流效率可达82.33%。
二氧化碳; 熔融碳酸盐电解质; 电解; 蜂窝状单质碳; 碳纳米线
0 引言
煤、石油、天然气等化石能源的大规模开发利用推动人类社会向前发展,同时也带来严重的生态环境问题。化石能源在使用过程中排放的CO2是造成全球温室效应的主要因素,实现CO2减排是全球亟待解决的重大战略课题之一[1-2]。目前,中外学者在CO2综合利用领域已取得研究成果,包括CO2的分离固定[3-4]、捕获储存[5]及化学转化[6]等技术,前两者的安全性问题不容忽视,因此,探索CO2的化学转化意义重大。韩国Park小组[7]、东京工业大学[8]、浙江大学和日本京都大学[9-10]等学者采用不同的化学手段对CO2进行转化,其成本低、安全性好,但同时也存在选择性差、转化率不高等缺点。近年来,利用高温熔盐介质将CO2转化为含能分子[11-16]引起科学界的广泛关注。
CO2的高温熔盐电化学转化是以高温熔盐为媒介,利用高温熔盐良好的导热性和离子传导能力,以及高温提供的快速反应动力,通过电化学方法将CO2或者碳酸根还原为具有附加价值的碳基物质并释放出氧气,实现电能向化学能的转化与储存[17],且整个过程可通过太阳能等绿色能源驱动[18]。Dipu A L等以掺杂Ni的氧化钇—氧化锆为阳极,以掺杂La0.8Sr0.2MnO3的氧化钇—氧化锆为阴极,在熔融电解质中将CO2降解为CO,并得到CO的释放速率与电解温度的关系[19]。Kaplan V等采用石墨和Ti分别作为阳极和阴极,在900 ℃的高温下通过连续电解将CO2还原为CO,且在高于100 mA/cm2的电流密度下得到纯净的CO[20]。除CO外,也有学者通过调控电解条件,在高温熔盐介质中将CO2还原为单质碳,但其形貌凌乱不规则[13,21]。笔者采用廉价的Fe和Ni-Cr合金作为电极材料,在熔融碳酸盐电解质中对CO2进行间接电解,通过调控电解温度,成功获得蜂窝状单质碳和碳纳米线,并采用不同的表征方法对获得的碳纳米材料的形貌、晶型结构、比表面积和粒度进行研究,分析它在工业领域的应用价值。
1 实验
1.1试剂及仪器
主要试剂:无水碳酸锂(Li2CO3,优级纯,天津市化学试剂三厂);无水碳酸钠(Na2CO3,优级纯,哈尔滨市化工试剂厂);无水碳酸钾(K2CO3,优级纯,北京化工厂);盐酸(HCl,分析纯,长春化学试剂厂);铁丝(Fe,河北稳态金属制品有限公司);镍铬合金丝(Ni-Cr,河北稳态金属制品有限公司)。
主要仪器:人工智能温度控制器(AI-518,厦门宇电自动化科技有限公司);直流稳压电源(1711A,美国BK Precision公司);电化学工作站(WaveNow,美国Pine公司);超声波清洗器(SG 3300 HBT,上海冠特超声仪器有限公司);鼓风干燥箱(DGG-9023A,上海森信实验仪器有限公司)。
1.2实验过程
1.2.1样品的制备
精确称量一定质量的Li1.43Na0.36K0.21CO3,混合研磨样品至均匀后盛于刚玉坩埚,并将刚玉坩埚置于陶瓷加热器中央,覆上保温棉及电解槽盖。加热至预设温度且稳定一段时间后,分别插入阴极(Fe丝,直径为1.6 mm,长度为9.9 cm,有效面积为5.0 cm2)、阳极(Ni-Cr合金丝,直径为1.6 mm,长度为9.9 cm,有效面积为5.0 cm2),接通直流电对体系进行电解。反应过程中,以一定流速通入CO2以补充碳源。
电流密度:200 mA/cm2,分别在850、875、900、925、950 K等温度条件下对体系进行电解。
1.2.2样品的提纯
反应结束后收集阴极析出的固体产物,由于冷却的电极上包含少量的碳酸盐,因此需要对它进行分离提纯:
(1)将电解产物置于体积比为1∶1的盐酸与超纯水的混合溶液并充分浸泡,直至不再有气泡产生;
(2)用超声波清洗器超声30 min清洗;
(3)在60 ℃温度的水浴中加热2~3 h;
(4)用0.22 μm的水膜进行抽滤,并用超纯水反复洗涤多次;
(5)置于105 ℃温度的鼓风干燥箱干燥4 h。
1.3样品的表征
采用场发射电子扫描电镜(SEM,Zeiss Sigma HV),在加速电压为10 kV下观察样品的表面形貌;利用电子透射显微镜(TEM,Tecnai/G2/F20/S-TWIN7),分析样品的内部微观结构;采用X线衍射仪(XRD,D/MAX 2200)分析样品晶型结构;利用拉曼光谱仪(RAM,LabRAM HR800),分析产物分子结构;采用激光粒度仪(Nano-ZS90,Malvern),测定样品的粒径尺寸;利用BET比表面积测定仪(BET,TristarⅡ-3020),测定样品的比表面积。
1.4电流效率的计算
不同电解条件下产碳的电流效率计算公式为
(1)
(2)
式(1-2)中:M为产物的相对分子质量;q为电化当量;η为电流效率;m为在电解时间内实际生成的电解产物质量;I为通过电解池的电流强度;t为电解时间;n为电子转移数。
2 结果与讨论
2.1阴极产物形貌及机理分析
不同电解温度下碳纳米材料的SEM图见图1(a-c),电解温度为900 K时碳纳米材料的TEM图见图1(d)。由图1(a-c)可知,当电解温度为850 K时,产物呈蜂窝状形貌;当电解温度升至900 K时,产物形貌发生明显变化,蜂窝状结构明显减少,粒径在50~200 nm的碳纳米粒子开始堆积并出现少量线状结构;当电解温度达到950 K时,线状结构比例越来越大,且较大的长径比例使这些线状结构无规则地缠绕在一起。由图1(b-c)可知,这些碳纳米线的直径为20~200 nm,且具有较高的应用价值[22-23]。在对样品进行扫描电镜分析过程中,也发现一些特殊的螺旋结构(见图1(b)),相对于无规则缠绕的线状结构,该结构更加规整。由图1(d)可以清晰地观察到无规则缠绕的碳纳米线及大量无定形碳。

图1 不同电解温度产物碳纳米材料的形貌Fig.1 SEM images of carbon nano-materials obtained at different electrolytic temperature TEM image of carbon nano-materials prepared
熔融碳酸盐电解质中的碳酸根离子通过电解转化为固态碳单质,其形成过程可用式(3-5)描述[24]:
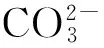
(3)
2O2-(熔融态)-4e-→O2(气态),
(4)
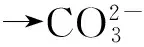
(5)
2.2碳纳米材料的XRD及Raman分析
不同电解温度下碳纳米材料的XRD谱图见图2(a)。由图2(a)可观察到LiCl、NaCl及KCl等杂质的特征衍射峰,主要来源于电解过程中极微量碱金属(Li、Na、K)的沉积,当对阴极碳产物进行酸洗处理时,碱金属与盐酸反应,生成碱金属盐。图2(a)中未出现明显的碳类特征峰,这是由于碳纳米材料以无定形碳为主,无定形碳的碳原子六角形环状平面形成的层状结构零乱而不规则,晶体形成有缺陷,且晶粒微小,因此在XRD谱图中的反射线模糊不清,难以精确定位它的特征峰位置。
碳纳米材料的拉曼谱图见图2(b)。由图2(b)可知,D峰和G峰是C原子晶体的拉曼特征峰,分别出现在1 350 cm-1和1 580 cm-1附近。D峰代表C原子晶格的缺陷,G峰代表C原子sp2杂化的面内伸缩振动。经计算,在850、900、950 K温度下碳纳米材料的2个特征峰的强度比(ID/IG)分别为1.040 5、1.053 4、1.107 6,因ID/IG的比值越小,石墨化程度越高,结构越规整;反之,C原子晶格缺陷越大[25]。因此,在850 K电解温度下制备的碳纳米材料结构更加规整。
2.3碳纳米材料的粒度和BET分析
对碳纳米材料进行粒度及BET分析,结果见图3。由扫描电镜分析结果可知,当电解温度为850 K时,蜂窝状碳纳米材料的孔径在200~400 nm之间。这种多孔结构使产物的比表面积大大增加,样品的比表面积约为43.0 m2/g,远高于相同电流密度、其他电解温度下制备的碳纳米材料的比表面积。当电解温度升高时,碳粒子沉积速度加快,导致产物粒径增加,比表面积减小。
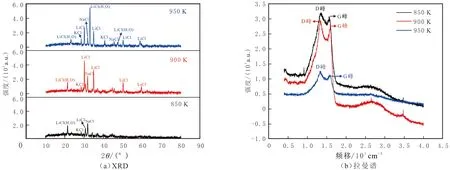
图2 不同电解温度下碳纳米材料的XRD谱及拉曼谱Fig.2 The XRD and Raman analysis of the carbon nano-materials prepared at different electrolytic temperature
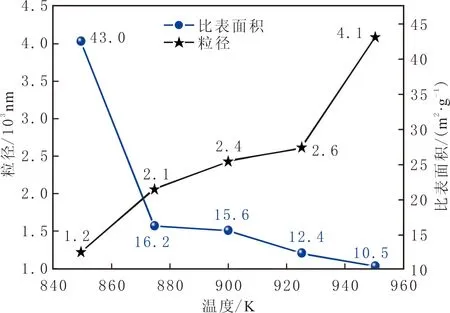
图3 不同电解温度下的碳纳米材料的粒径及比表面积Fig.3 Particle size and BET surface area of the carbon nano-materials obtained at different electrolytic temperature
2.4体系的电化学分析及电流效率的计算
电解过程中,外界环境及熔盐介质本身的性质影响电解体系的稳定性。电化学工作站记录的恒电流密度电解过程中电压随时间的变化曲线见图4(a)。根据电流效率计算公式(1-2),分别计算不同电解温度下产碳的电流效率(见图4(b))。
由图4(a)可知,电解温度相同时,体系的电压略有浮动,说明体系的电阻有微小变化,原因是随着电解反应进行,生成的单质碳附着在电极表面而影响电极的导电性。此外,电解质流动性的变化会改变体系的电导率,进而影响体系电压。当电解温度为850 K时,电解质流动性较差,电导率较低,故体系电压远高于其他电解温度时的电压。
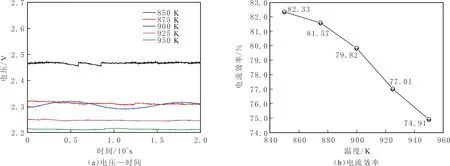
图4 电流密度为200 mA/cm2时的电压—时间曲线及不同电解温度下产碳的电流效率Fig.4 Cell voltage-time plots of the electrolysis system under current density of 200 mA/cm2 and current efficiency of carbon-production at different electrolytic temperature
由图4(b)可知,获得单质碳的电流效率在74.91%~82.33%之间。当电解温度为850 K时,生成单质碳的电流效率最大,可达82.33%;当电解温度升高时,易导致副反应加剧,如CO的生成等[20],故提高电解温度导致产碳电流效率下降;当温度低于850 K时,混合熔盐的流动性较差,离子传导能力不足,不宜用作电化学转化的媒介。
3 结论
(1)以Fe为阴极、Ni-Cr合金为阳极,在熔融碳酸盐电解质中通过一步法电解CO2可以合成碳纳米材料,实现CO2的资源化利用。
(2)电解温度为850~900 K时,合成的碳纳米材料形貌呈蜂窝状,电解温度为900~950 K时,合成的碳纳米材料形貌呈线状,直径为20~200 nm,具有较高的应用价值。随着电解温度的升高,碳纳米材料的粒径逐渐增加,比表面积逐渐减小,碳纳米材料的规整度也略有下降。
(3)在考察的电解条件下,产碳的电流效率在74.91%~82.33%之间;当电解温度为850 K时,生成单质碳的电流效率最高,可达82.33%。
[1]Wigley T M L. A combined mitigation/geoengineering approach to climate stabilization [J]. Science, 2006,314(5798):452-454.
[2]Falkowski P, Scholes R J, Boyle E, et al. The global carbon cycle: A test of our knowledge of earth as a system [J]. Science, 2000,290(5490):291-296.
[3]Elliot T R, Celia M A. Potential restrictions for CO2sequestration sites due to shale and tight gas production [J]. Environmental science & technology, 2012,46(7):4223-4227.
[4]Shekh A Y, Krishnamurthi K, Mudliar S N, et al. Recent advancements in carbonic anhydrase-driven processes for CO2sequestration: Minireview [J]. Critical reviews in environmental science and technology, 2012,42(14):1419-1440.
[5]李琴,李治平,胡云鹏,等.深部盐水层CO2埋藏量计算方法研究与评价[J].特种油气藏,2011,18(5):6-10.
Li Qin, Li Zhiping, Hu Yunpeng, et al. Assessment of CO2storage calculation for deep saline aquifers [J]. Special Oil & Gas Reservoirs, 2011,18(5):6-10.
[6]Taheri Najafabadi A. CO2chemical conversion to useful products: An engineering insight to the latest advances toward sustainability [J]. International Journal of Energy Research, 2013,37(6):485-499.
[7]Kim J H, Jurng T H, Park Y, et al. Characteristics of a chemical lung for carbon dioxide conversion to oxygen [C]. ACS Symposium series: Oxford University Press, 2010,1056:255-268.
[8]陈红萍,梁英华,王奔.二氧化碳的化学利用及催化体系的研究进展[J].化工进展, 2009,28(增刊1):271-278.
Chen Hongping, Liang Yinghua, Wang Ben. Chemical utilization of carbon dioxide and research progress of catalytic systems [J]. Chemical Industry and Engineering Progress, 2009,28(Supp.1):271-278.
[9]Takeguchi T, Furukawa S N, Inoue M, et al. Autothermal reforming of methane over Ni catalysts supported over CaO-CeO2-ZrO2solid solution [J]. Applied Catalysis A: General, 2003,240(1):223-233.
[10]井强山,方林霞,楼辉,等.甲烷临氧催化转化制合成气研究进展[J].化工进展,2008,27(4):503-507.
Jing Qiangshan, Fang Linxia, Lou Hui, et al. Progress of catalytic conversion of methane to syngas in the presence of oxygen [J]. Chemical Industry and Engineering Progress, 2008,27(4):503-507.
[11]Cassir M, McPhail S J, Moreno A. Strategies and new developments in the field of molten carbonates and high-temperature fuel cells in the carbon cycle [J]. International Journal of Hydrogen Energy, 2012,37(24):19345-19350.
[12]王宝辉,苑丹丹,吴红军,等.太阳能驱动高温熔融碳酸盐电解电势的理论分析[J].大庆石油学院学报,2010,34(5):92-96.
Wang Baohui, Yuan Dandan, Wu Hongjun, et al. Theoretical analysis of electrodeposition potentials of carbonates driven by solar energy [J]. Journal of Daqing Petroleum Institute, 2010,34(5):92-96.
[13]Le V K, Groult H, Lantelme F, et al. Electrochemical formation of carbon nano-powders with various porosities in molten alkali carbonates [J]. Electrochimica Acta, 2009,54(19):4566-4573.
[14]Li L, Shi Z, Gao B, et al. Preparation of carbon and oxygen by carbon dioxide electrolysis in LiF-Li2CO3eutectic molten salt [J]. Journal of The Electrochemical Society, 2016,163(2):E1-E6.
[15]Tomkute V, Solheim A, Olsen E. Investigation of high-temperature CO2capture by CaO in CaCl2molten salt [J]. Energy & Fuels, 2013,27(9):5373-5379.
[16]Licht S, Wang B, Wu H. STEP a solar chemical process to end anthropogenic global warming. II: Experimental results [J]. The Journal of Physical Chemistry C, 2011,115(23):11803-11821.
[17]尹华意.基于高温熔盐化学的减碳和固碳技术研究[D].武汉:武汉大学,2012.
Yin Huayi. Study of carbon reduction and carbon sequestration technology based on the high temperature molten salt [D]. Wuhan: Wuhan University, 2012.
[18]Licht S, Wu H. STEP iron, a chemistry of iron formation without CO2emission: Molten carbonate solubility and electrochemistry of iron ore impurities [J]. The Journal of Physical Chemistry C, 2011,115(23):25138-25147.
[19]Dipu A L, Ujisawa Y, Ryu J, et al. Electrolysis of carbon dioxide for carbon monoxide production in a tubular solid oxide electrolysis cell [J]. Annals of Nuclear Energy, 2015,81:257-262.
[20]Kaplan V, Wachtel E, Gartsman K, et al. Conversion of CO2to CO by electrolysis of molten lithium carbonate [J]. Journal of the Electrochemical Society, 2010,157(4):B552-B556.
[21]Kaplan B, Groult H, Barhoun A, et al. Synthesis and structural characterization of carbon powder by electrolytic reduction of molten Li2CO3-Na2CO3-K2CO3[J]. Journal of The Electrochemical Society, 2002,149(5):D72-D78.
[22]Cao Y, Xiao L, Sushko M L, et al. Sodium ion insertion in hollow carbon nanowires for battery applications [J]. Nano Letters, 2012,12(7):3783-3787.
[23]Sharma S, Sharma A, Cho Y K, et al. Increased graphitization in electrospun single suspended carbon nanowires integrated with carbon-MEMS and carbon-NEMS platforms [J]. ACS Applied Materials & Interfaces, 2012,4(1):34-39.
[24]Ijije H V, Lawrence R C, Chen G Z. Carbon electrodeposition in molten salts: Electrode reactions and applications [J]. RSC Advances, 2014,67(4):35808-35817.
[25]Brown S D M, Jorio A, Dresselhaus M S, et al. Observations of the D-band feature in the raman spectra of carbon nanotubes [J]. Physical Review B, 2001,64(7):073403.
2015-11-10;编辑:陆雅玲
黑龙江省教育厅面上项目(12531072)
吴红军(1979-),男,博士,教授,主要从事二氧化碳化学转化利用方面的研究。
10.3969/j.issn.2095-4107.2016.02.011
TQ324
A
2095-4107(2016)02-0085-05

