一株产脂肽菌的鉴定及其代谢产物驱油性能评价
王 静, 林军章, 宋 欣, 谭晓明, 胡 婧, 陈健斌
( 1. 中石化胜利油田分公司 石油工程技术研究院,山东 东营 257000; 2. 山东省黄河三角洲可持续发展研究院管理中心,山东 东营 257000 )
一株产脂肽菌的鉴定及其代谢产物驱油性能评价
王静1, 林军章1, 宋欣1, 谭晓明1, 胡婧1, 陈健斌2
( 1. 中石化胜利油田分公司 石油工程技术研究院,山东 东营257000;2. 山东省黄河三角洲可持续发展研究院管理中心,山东 东营257000 )
从油田采出水中分离得到一株产脂肽的细菌,经鉴定为枯草芽孢杆菌,该菌株发酵液表面张力最低为28.00 mN·m-1。分离提纯其代谢产物,经红外光谱分析表明为一种脂肽类生物表面活性剂。该脂肽类表面活性剂具有较低的临界胶束质量浓度(CMC),为3.3 mg·L-1,其水溶液最低表面张力为26.60 mN·m-1,油水界面张力为0.01 mN·m-1。理化特性分析表明,该脂肽类生物表面活性剂具有耐温(120 ℃)、耐盐(2×105mg·L-1),pH适应范围较广(6.0~10.0)等特性,对原油具有较强的乳化性能。物模驱油评价实验表明,在水驱基础上,可提高采收率9%以上。该研究为油田微生物采油工业化应用提供理论依据。
生物表面活性剂; 芽孢杆菌; 脂肽; 临界胶束质量浓度; 油藏适应性; 驱油性能
0 引言
脂肽类生物表面活性剂是微生物在一定条件生长代谢合成的、具有表面活性的脂肽类化合物[1]。脂肽分子由亲水肽键和亲油脂肪烃链组成[2]。脂肽类生物表面活性剂通常比合成表面活性剂拥有更为复杂和庞大的分子结构,单个分子占据更大空间,因而显示较低的临界胶束质量浓度(CMC)。它们能显著降低表面张力、改善界面性质,在极端苛刻条件下(高温、高盐)具有良好的选择性和专一性,生物相容性好,无毒或低毒,可被微生物降解[3]。由于脂肽类生物表面活性剂具有绿色环保、独特的理化性质等特点,一直受到人们的关注,在医药、食品、化妆品及微生物采油等领域具有重要的应用价值[4]。1968年,Arima K等[5]首次发现枯草芽孢杆菌菌株(Bacillussubtilis)产生的是脂肽类表面活性剂,它呈晶状,商品名为表面活性素(surfactin),是迄今报道效果最好的生物表面活性剂之一。1985年,Javaheri M等[6]研究BacilluslicheniformisJF-2在严格缺氧的条件下,可产生多种降低培养基表面张力(小于30 mN·m-1)的脂肽类物质,相对于辛烷的界面张力是 10-2mN·m-1。目前,已有很多关于筛选脂肽生产菌株的研究[7-9]。脂肽类生物表面活性剂提高原油采收率机理在于能够降低表界面张力,降低毛细管力,有利于原油流动,从而提高石油开采量[10]。郝瑞霞等[11]分析BacillussubtilisSP4能够产生生物表面活性物质等代谢产物,降低原油的重质馏分含量,改善原油的物理化学性质。王大威等[12]论述一株枯草芽孢杆菌ZW-3代谢的脂肽类生物表面活性剂(CMC值为33.3 mg·L-1)。曹娟等[13]研究Bacillussp. Y8A菌株能够以石蜡为碳源代谢产生脂肽类生物表面活性剂促进石油烃的降解。脂肽类生物表面活性剂应用于油田提高采收率研究,大多局限于菌株和代谢产物的表征,而对脂肽在油藏适应性方面的研究较少。
脂肽类生物表面活性剂不仅具有较强的耐温耐盐性能,而且具有良好的表界面活性,可显著改善水驱油效率。目前,由于受到脂肽类生物表面活性剂产率的限制,生产成本较高,在价格上很难取代化学表面活性剂。为此,一方面,可以通过优化培养条件和构建基因工程菌,提高脂肽产量;另一方面,在油田现场发酵,直接使用发酵液,减少脂肽分离纯化过程,从而大幅度降低生产成本,为工业应用创造条件。
笔者对分离得到的高产脂肽菌株TH开展鉴定及其代谢产物性能评价,为其在油田微生物采油工业化应用提供理论依据。
1 实验
1.1样品来源
菌株TH,胜利油田产出水中分离获得;原油,胜利油田某区块的脱水原油;实验用地层水,胜利油田同区块产出液。
1.2培养基配方
(1)富集培养基.液体石蜡,1.00 g·L-1;MgSO4,0.20 g·L-1;CaCl2,0.02 g·L-1;KH2PO4,1.00 g·L-1;K2HPO4,1.00 g·L-1;FeCl3,0.05 g·L-1;NH4NO3,1.00 g·L-1;酵母膏,1.00 g·L-1;蒸馏水定容至1 L,pH为7.0~7.2。
(2)发酵培养基.葡萄糖,20.00 g·L-1;酵母粉,1.00 g·L-1;NaNO3,3.00 g·L-1;K2HPO4,3.00 g·L-1;NaCl,5.00 g·L-1,蒸馏水定容至1 L;在115 ℃温度下,高压蒸气灭菌20 min。
1.3仪器
采用QBZY型全自动表面张力测定仪(上海方瑞仪器有限公司生产);TX500D旋转滴超低界面张力仪(上海梭伦科技信息有限公司生产)。
1.4菌株鉴定
通过形态学、生理生化实验及其 16SrDNA 的相似性分析,菌株被鉴定到种。根据基因组提取试剂盒的要求,提取基因组DNA。以提取的细菌DNA作为模板,用细菌通用引物扩增16SrDNA序列。引物序列为:BSF(27f),AGAGTTTGATCCTGGCTCAG;BSR(1541r),AAGGAGGTGATCCAGCCGCA反应体系为ddH2O 15.7 μL,10X Buffer 2.5 μL,25 mmol MgCl21.5 μL, 10 mmol dNTP 2.0 μL;10 μmol引物1 0.5 μL,10 μmol引物2 0.5 μL,Taq酶0.3 μL,DNA模板2 μL;反应退火温度为55 ℃。PCR产物按试剂盒要求进行胶回收,连接T载体,转化E.coliDH5α,测序并通过NCBI的Gen Bank数据库进行比对,构建遗传发育进化树[14]。
1.5生物表面活性剂提纯与鉴定
采用酸沉和CH2Cl2进行旋转蒸发提纯脂肽类生物表面活性剂,利用茚三酮或碘蒸气熏蒸显色对脂肽类生物表面活性剂进行分析,采用红外光谱法对它进行结构鉴定[15-16]。
1.6临界胶束质量浓度(CMC)测定
表面活性剂分子在溶剂中缔合形成胶束的最低质量浓度即为CMC。CMC可作为表面活性剂表面活性的一种度量指标,CMC值越小,表明这种活性剂形成胶束所需的质量浓度越低,达到表面饱和吸附的质量浓度越低,改变表面性质起到润湿、乳化、增溶、起泡等作用所需的质量浓度也越低。因此,CMC值是鉴定表面活性剂的重要指标。
将分离纯化后的脂肽配置不同的质量浓度,分别测定其表面张力,用表面张力与质量浓度的对数作图。当表面吸附达到饱和时,曲线出现转折点,该点的质量浓度即为临界胶束质量浓度。
1.7表面活性评价
将分离纯化后的脂肽类生物表面活性剂配制不同的质量浓度,进行乳化性能和油水界面张力降低性能评价。
1.7.1乳化性
取1支厌氧管,加入5 mL柴油和5 mL脂肽溶液,剧烈振荡1 min,放置于37 ℃恒温箱,分别测量5 min和24 h的乳化液和油相体积,求得其乳化稳定值。计算公式为:乳化稳定值=乳化层高度/油相高度×100%。
1.7.2油水界面张力降低性能
在60 ℃温度条件下,对该区块原油采用旋转滴法进行油水界面张力的测定。
1.8油藏适应性
为菌种发酵液应用于油田实际,需要考虑地层的主要限制因素,如油藏温度、地层水pH、矿化度对脂肽类生物表面活性剂性能的影响。
1.8.1耐温性能
用pH为7.0的蒸馏水制备质量浓度为3.3 mg·L-1的脂肽溶液(表面张力为 34.60 mN·m-1),用于测定温度对脂肽类生物表面活性剂的表面活性影响。在不同温度、不同处理时间(1 h或2 h)条件下处理,然后冷却至室温,测定其表面张力。
1.8.2耐盐性能
在质量浓度为3.3 mg·L-1的脂肽水溶液(其表面张力为 34.60 mN·m-1)中加入NaCl,使溶液质量浓度分别为5.00、10.00、20.00、50.00、100.00、200.00 g·L-1,在室温下,测定其表面张力并观察是否有沉淀产生。
1.8.3耐pH值性能
调整质量浓度为3.3 mg·L-1的脂肽溶液(其表面张力为 34.60 mN·m-1),使溶液pH分别为 2、4、6、8、10、12,测定其表面张力。
1.9物理模拟驱油
原油与煤油按体积配比1∶9混合配制成模型油(主要模拟地层原油黏度);对实际地层水或模拟地层水过滤去除杂质。
(1)填装岩心,测定其渗透率,选择渗透率很接近的岩心;
(2)将岩心抽真空、饱和地层水,测定岩心孔隙度;
(3)将岩心用该区块原油饱和,计算初始含油饱和度,并老化7 d;
(4)一次水驱,水驱至采出水含水率为98%以上,计算一次水驱采油率;
(5)注入不同质量浓度的生物表面活性剂0.2~0.3 PV(PV为注入孔隙体积倍数);
(6)二次水驱,水驱至含水率为100%,计算采用生物表面活性剂驱油提高的采收率;
整个实验过程在温度为60 ℃的恒温箱内进行,泵的速度设为1 mL·min-1。
2 结果与分析
2.1菌种鉴定
2.1.1形态特征
菌株TH 为短杆状,大小为(0.5~0.8)μm×(1.5~3.0)μm,革兰氏阳性,能运动,无鞭毛,有芽孢。在30 ℃温度的LB 固体平板上培养48 h,菌落呈淡黄色、圆形、不透明、边缘平整、表面湿润光滑(见图1)。

图1 菌株TH形态Fig.1 TH form chart
2.1.216SrDNA结果
菌株TH通过形态学及16SrDNA序列比对形成系统发育树(见图2),它与枯草芽孢杆菌(Bacillussubtilis)同源性最近,达到100%,因此将该菌初步鉴定为枯草芽孢杆菌。
2.2代谢产物分析
菌株TH发酵产生的生物表面活性剂用酸沉和CH2Cl2旋转蒸发提纯后约为2.00 g·L-1,TLC分析结果显示,表面活性剂与茚三酮显色呈现紫红色,碘蒸气显色为黄色(见图3),初步判定菌株产生的是脂肽类生物表面活性剂。经过红外扫描结果显示,在3 500~3 100 cm-1处存在明显的N-H伸缩,在1 740 cm-1处有羰基(见图4),是明显的脂肽类表面活性剂标志。
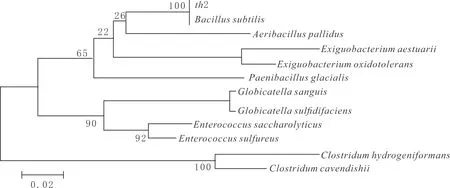
图2 菌株TH系统发育树Fig.2 TH phylogenetic tree

图3 TLC显色结果Fig.3 TLC coloration results
2.3CMC测定
筛选的脂肽类生物表面活性剂TH具有显著降低表面张力能力,表面张力最低为26.60 mN·m-1, CMC为3.3 mg·L-1(见图5)。该临界胶束质量浓度为石油磺酸盐(油田常用的表面活性剂)的1%左右。
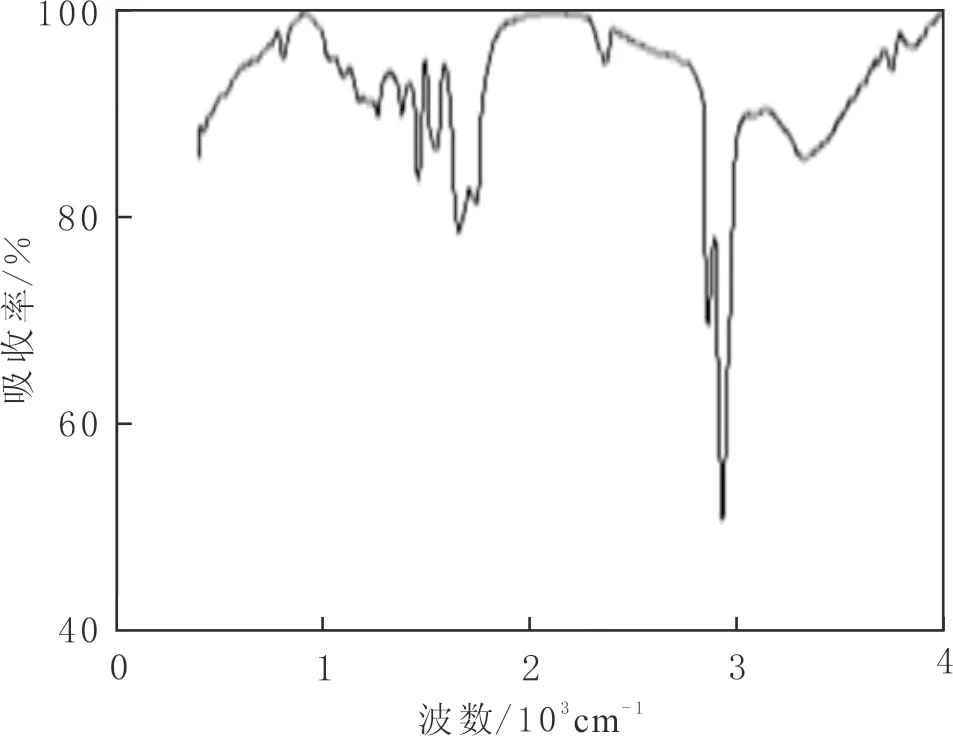
图4 红外光谱Fig.4 Infrared spectrogram
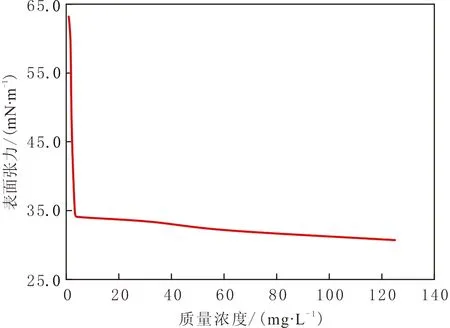
图5 TH脂肽临界胶束质量浓度的测定Fig.5 The measured critical micelle concentration of TH lipopeptide
2.4表面活性评价
2.4.1乳化性
不同质量浓度的脂肽溶液与柴油按等体积混合剧烈振荡后静置24 h,测定乳化稳定值,质量浓度为500 mg·L-1的脂肽溶液乳化值在90%以上(见图6),表现优良的乳化性能。
2.4.2油水界面张力
对胜利油田沾3区块原油,将不同质量浓度的脂肽溶液与区块地层水按1∶1的体积配比混合,测定油水界面张力。脂肽类生物表面活性剂能够显著降低该区块原油的油水界面张力,如采用质量浓度为500 mg·L-1的TH脂肽溶液可使油水界面张力降到10-2mN·m-1以下(见图7)。
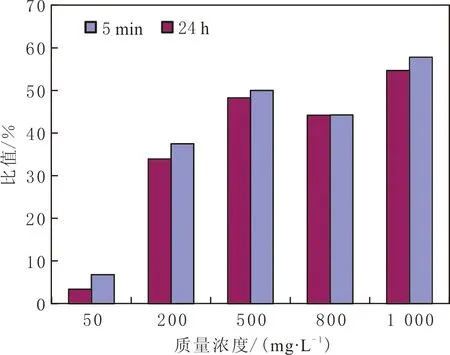
图6 不同质量浓度TH脂肽溶液乳化稳定值的测定Fig.6 Determination of emulsion stability of TH lipopeptide solution with different concentrations
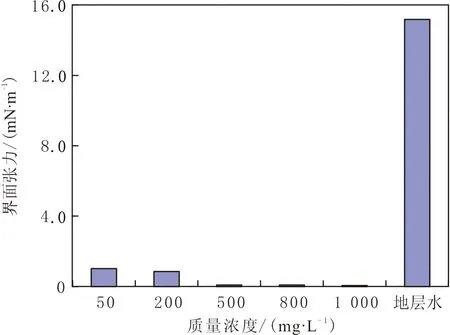
图7 不同质量浓度TH脂肽溶液对沾3区块原油油水界面张力的测定Fig.7 Determination of oil-water interfacial tension with different concentrations of TH lipopeptide solution for oil from block Zhan3
2.5油藏适应性评价
2.5.1耐温性
不同温度、不同时间TH脂肽表面张力的变化见图8。由图8可知,在80~120 ℃温度时,对脂肽处理1~2 h,其表面张力影响不大。该脂肽类生物表面活性剂在经受2 h、120 ℃温度的热处理后,其表面张力略有降低,说明它对温度变化有较强的耐受性。
2.5.2耐盐性
不同矿化度TH脂肽表面张力的变化见图9。由图9可知,当矿化度度达到 100.00 g·L-1时,3.3 mg·L-1的脂肽水溶液表面张力为38.50 mN·m-1。若再提高矿化度,其表面活性逐渐被抑制,表面张力逐渐增大。说明该脂肽类生物表面活性剂能耐受较高的矿化度。
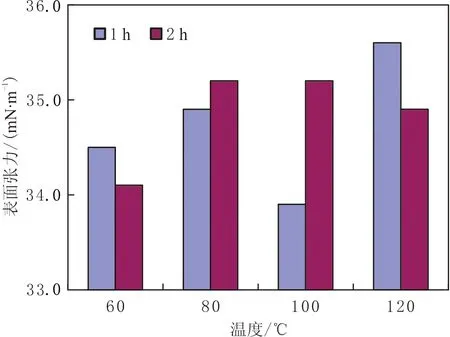
图8 不同温度、不同时间TH脂肽表面张力的变化Fig.8 Changes in surface tension of TH peptides solution at different temperatures for different soaking time
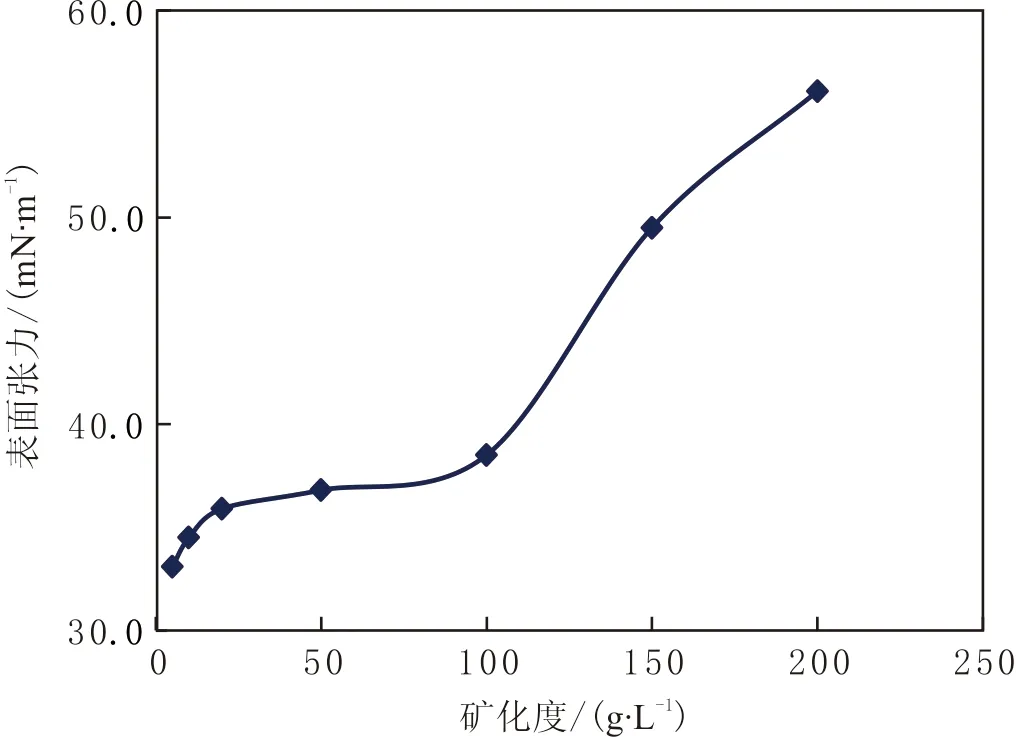
图9 不同矿化度TH脂肽表面张力的变化Fig.9 Changes in surface tension of TH lipopeptide with different salinity water
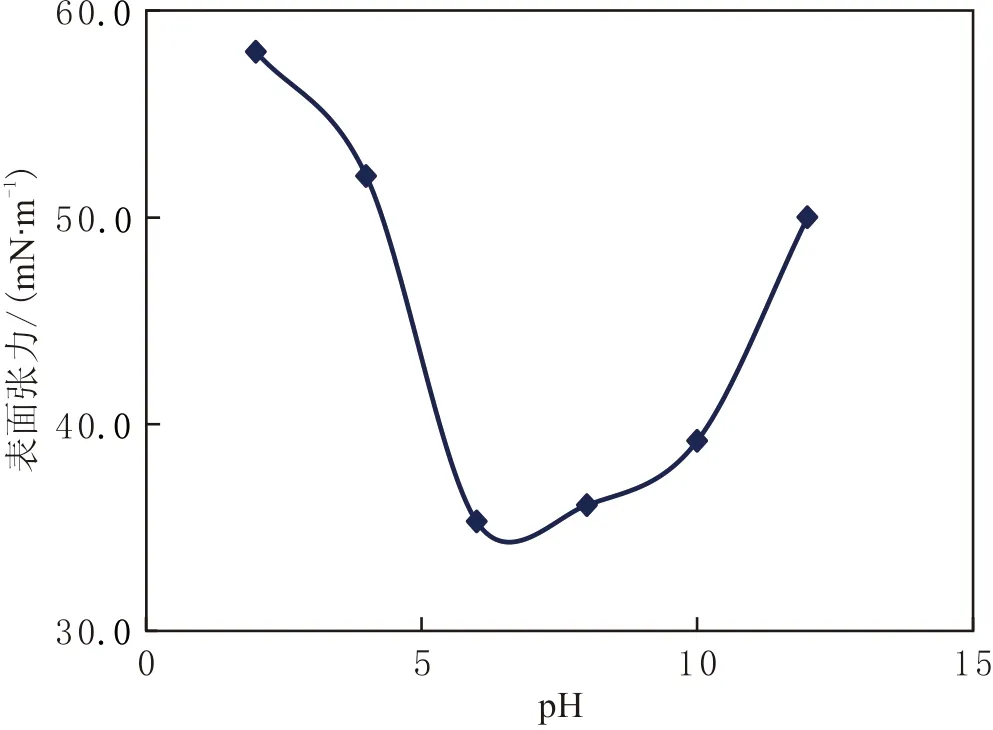
图10 不同pH的TH脂肽表面张力的变化Fig.10 Changes in surface tension of TH lipopeptide under different pH
2.5.3对pH的适应性
pH的适应性评价结果(见图10)表明,当pH为6.0~10.0时,该脂肽溶液的表面张力变化不大。当pH在6.0~8.0之间时,其表面张力降到最低,说明其表面活性的最适宜pH为6.0~8.0,pH低于6.0或高于8.0时观察到表面活性下降。由此可见,该脂肽在酸性条件下不稳定,pH为1.0~3.0时溶液中表面张力最高,在中性和碱性条件下活性非常稳定。说明该脂肽类生物表面活性剂具有较广的pH适应范围。
2.6物理模拟驱油
以胜利油田沾3区块油藏条件作为物理模拟实验条件,油藏温度为60 ℃,岩心数据见表1。
在一次水驱和二次水驱的实验过程中,保持泵速恒定1 mL/min,应用该区块地层水添加该脂肽进行二次水驱(见表2),发现脂肽类生物表面活性剂在一次水驱基础上能够显著提高采收率,改善驱油效果。当提纯的脂肽粗品使用质量浓度为2.0 g·L-1时,可提高采收率近9%,并且抗稀释性能良好;在稀释100倍的条件下(0.02 g·L-1)提高采收率7%左右,原因是该脂肽类生物表面活性剂具有很低的临界胶束质量浓度。

表1 实验岩心基本参数

表2 不同质量浓度脂肽类生物表面活性剂物模驱油效率
3 结论
(1)从油田产出水中筛选获得的菌株TH通过形态学及16SrDNA序列分析表明,生物学鉴定该菌为枯草芽孢杆菌(Bacillussubtilis)。应用红外光谱法(FT-IR)检测推断代谢产物为脂肪酸和肽组成的脂肽类物质,CMC为3.3 mg/L,说明该脂肽类生物表面活性剂的应用质量浓度很低。
(2)在胜利油田沾3区块,该脂肽类生物表面活性剂的质量浓度为500.00 mg·L-1,可使油水界面张力降到10-2mN·m-1以下。该脂肽类生物表面活性剂具有较好的耐高温高盐离子的特征和较广的pH适应范围。在温度为120 ℃时,3.3 mg·L-1脂肽水溶液的表面张力为34.60 mN·m-1;矿化度为100.00 g·L-1时,同质量浓度的脂肽水溶液表面张力为38.50 mN·m-1;pH适应范围为6.0~10.0。
(3)该脂肽类生物表面活性剂在现有的培养条件下质量浓度为2.00 g·L-1,物模实验表明在水驱的基础上可提高采收率9%,具有良好的应用前景。
[1]李俊峰,刘丽.脂肽类生物表面活性剂的研究进展[J].化学与生物工程,2015,32(1):12-15.
Li Junfeng, Liu Li. Research progress of lipopeptide biosurfactant [J]. Chemistry & Bioengineering, 2015,32(1):12-15.
[2]吕应年,杨世忠,牟伯中.脂肽的分离纯化与结构研究[J].微生物学通报,2005,32(1):67-73.
Lv Yingnian, Yang Shizhong, Mu Bozhong. Isolation and identification of a ipopeptide [J]. Microbiology, 2005,32(1):67-73.
[3]朱海霞,方新湘,海日古丽.生物表面活性剂在油田开采中的应用[J].现代化工,2008,28(2):407-410.
Zhu Haixia, Fang Xinxiang, Xeyrigul. Application of biosurfactants in petroleum exploitation [J]. Modern Chemical Industy, 2008,28(2):407-410.
[4]李媛,陆晓滨,董贝磊,等.脂肽类生物表面活性剂生产的研究[J].食品工业与科技,2008,29(11):296-302.
Li Yuan, Lu Xiaobin, Dong Beilei, et al. Reserch on production of lipopeptide biosurfactants [J]. Science and Technology of Food Industry, 2008,29(11):296-302.
[5]Arima K, Kakinuma A, Tamura G. Surfactin acrystalline peptidelipid surfactant produced by bacillus subtilis: Isolation,characterization and its inhibition of fibrin clot formation [J]. Biochem Biophys Res Commun, 1968,31(3):488-496.
[6]Javaheri M, Jenneman G, McInerney M, et al. Anaerobic production of a biosurfactant by bacillus licheniformis JF-2 [J]. Appl Environ Microbiol, 1985,50(3):698-700.
[7]张卉,郝国良,徐俊斌.生物表面活性剂产生菌的筛选及培养条件优化[J].沈阳师范大学学报:自然科学版,2011,29(2):293-296.
Zhang Hui, Hao Guoliang, Xu Junbin. Screening of biosurfactant producing strain and optimization of its culture conditions [J]. Journal of Shenyang Normal Univesity: Naturan Science Edition, 2011,29(2):293-296.
[8]Seghal K G, Anto T T, Joseph S B, et al. Optimization and characterization of a new lipopeptide biosurfactant produced by marine brevibacterium aureum MSA13 in solid state culture [J]. Bioresource Technology, 2010,101(7):89-96.
[9]Tomasz J, Marcin, Tomas R, et al. Isolation and characterization of two new lipopeptide iosurfactants produced by pseudomonas fluorescens BD5 isolated from water from the Arctic Archipelago of Svalbard [J]. Bioresource Technology, 2010,101(15):18-23.
[10]Stefan I, Wu Yongfu, Patrick S, et al. New surfactant classes for enhanced oil recovery and their tertiary oil recovery potential [J]. Journal of Petroleum Science and Engineering, 2010,71(1/2):23-29.
[11]郝瑞霞,鲁安怀,王关玉.枯草芽孢杆菌对原油作用的初探[J].石油学报(石油加工),2002,18(5):15-20.
Hao Ruixia, Lu Anhuai, Wang Guanyu. Metabolism of bacullus subtilis on Crude oils [J]. Acta Petrolei Sinica(Petroleum processing Section), 2002,18(5):15-20.
[12]王大威,刘永建,杨振宇,等.脂肽生物表面活性剂在微生物采油中的应用[J].石油学报,2008,29(1):111-115.
Wang Dawei, Liu Yongjian, Yang Zhenyu, et al. Application of surfactin in microbial enhanced oil recovery [J]. Acta Petrolei Sinica, 2008,29(1):111-115.
[13]曹娟,刘怡辰,张振华,等.脂肽类生物表面活性剂产生菌的分离及特性研究[J].环境科学学报,2009,29(10):2056-2062.
Cao Juan, Liu Yichen, Zhang Zhenhua, et al. Isolation and characterization of lipopeptide tabiosufactant-producing microoranism [J]. Acta Scientiae Circumstantiae, 2009,29(10):2056-2062.
[14]余焱,张志坚,宋柏函.一株高效生物表面活性剂产生菌的分离、鉴定及培养条件的优化[J].复旦大学学报:自然科学版,2012,51(4):501-506.
Yu Yan, Zhang Zhijian, Song Baihan. solation, Identification and culture conditions optimization of a high-efficiency bio-surfactant producing bacterium [J]. Journal of Fudan University: Natural Science Edition, 2012,51(4):501-506.
[15]罗建波,吴卫霞,张凡,等.一株产脂肽类生物表面活性剂菌株的分离及代谢产物分析[J].化学与生物工程,2010,27(2):46-49.
Luo Jianbo, Wu Weixia, Zhang Fan, et al. Solation and metabolite analysis of a strain producing lipopeptide biosurfactant [J]. Chemisstry & Bioengineerring, 2010,27(2):46-49.
[16]李宝庆,鹿秀云,郭庆港,等.枯草芽孢杆菌BAB-1产脂肽类及挥发性物质的分离和鉴定[J].中国农业科学,2010,43(17):3547-3554.
Li Baoqing, Lu Xiuyun, Guo Qinggang, et al. Isolation and identification of lipopeptides and volatile compounds produced by bacillus subtilis strain BAB-1 [J]. Scientia Agricultura Sinica, 2010,43(17):3547-3554.
2015-09-15;编辑:关开澄
国家高技术研究发展计划(863计划)项目(2013AA064401)
王静(1979-),女,工程师,主要从事微生物提高采收率方面的研究。
10.3969/j.issn.2095-4107.2016.02.010
TE327
A
2095-4107(2016)02-0078-07

